影响厌氧氨氧化工艺的因素及其研究进展
焦陇珍,单铭港,王峥嵘,江雨峰,周柯岑,严子春,2
(1.兰州交通大学环境与市政工程学院,甘肃兰州 730070;2.甘肃省黄河水环境重点实验室,甘肃兰州 730020)
目前我国传统脱氮主要采用硝化反硝化技术,但该技术存在工艺流程长,需外加碳源,运行成本高等缺点,且随着污水排放标准的不断提高,该工艺已不能解决城市污水经二级处理后仍存在低C/N 比的问题,因此国内外学者一直致力于新型脱氮技术的研究[1]。随着脱氮工艺的改进,出现短程硝化反硝化[2]、同步硝化反硝化[3]、厌氧氨氧化等一系列新型生物脱氮工艺。20 世纪末,首次在荷兰的一座脱氮流化床反应器中发现了厌氧氨氧化(anaerobic ammonium oxidation,Anammox)[4]。厌氧氨氧化技术因其运行费用低、无需外加碳源、脱氮效率高等优点而成为人们研究的热点[5]。
厌氧氨氧化菌是厌氧自养菌,可将氨氮和亚硝氮转化为氮气实现脱氮,但脱氮过程易受温度、pH、溶解氧、COD 等环境条件影响[6-8]。本文对厌氧氨氧化的反应原理、影响因素等方面的研究进展进行了总结分析,为提高脱氮处理效果提供参考和依据。
1 厌氧氨氧化反应
厌氧氨氧化(Anammox)是指厌氧氨氧化菌以NO2-为电子受体氧化氨氮,在厌氧条件下将NH4+和NO2-转化成N2和少量NO3-的生物脱氮过程[9]。
1.1 反应原理
2014 年Lotti 等通过动力学和化学计量对Strous等提出的厌氧氨氧化反应方程式进行了修订[10,11],如式(1)所示:

1997 年Graaf 等采用15N 示踪标记法提出NO2-并没有直接形成N2H4而是在亚硝酸盐还原酶(NIR)还原成NH2OH[12];但2006 年Strous 等发现厌氧氨氧化菌缺乏将亚硝酸盐转化为羟氨酶的基因,最后证明中间产物为NO,而不是联胺[13]。Anammox 反应的代谢机理图(见图1)。
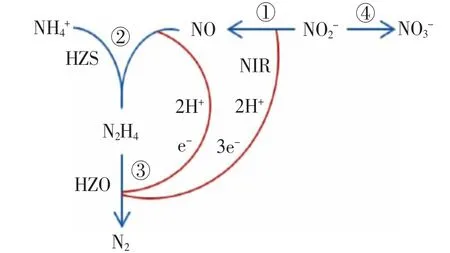
图1 厌氧氨氧化反应的代谢机理模型[14]Fig.1 Model diagram of anaerobic ammonia oxidation metabolism
1.2 厌氧氨氧化菌
厌氧氨氧化菌(AnAOB)是化能自养菌,其形态多样,细胞外无荚膜,属于浮霉菌门;世代周期长,生长富集缓慢,内含大量血红素c,富集期间会由棕色变为红色。其细胞结构(见图2)。
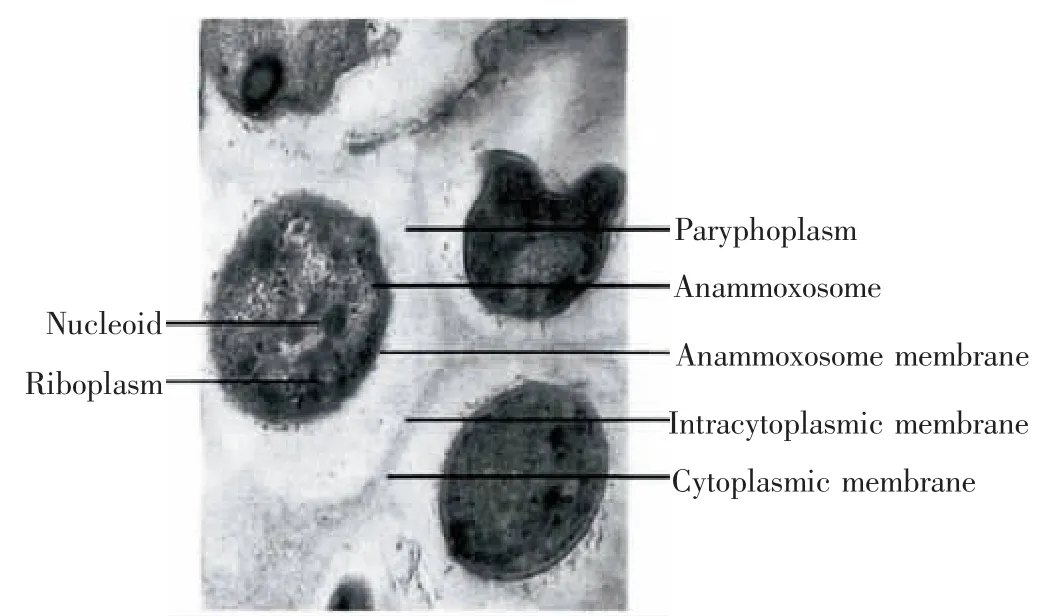
图2 厌氧氨氧化菌透射电镜图[15]Fig.2 Transmission electron micrograph(TEM)of Anammox bacterrium cell
2 厌氧氨氧化的影响因素
2.1 环境条件
2.1.1 温度 AnAOB 的适宜温度为30~40 ℃。研究发现温度可通过影响微生物酶催化反应速率影响厌氧氨氧化菌活性,超出适宜范围微生物活性会受到抑制。Awata 等采用厌氧氨氧化膜生物反应器考察温度对Anammox 活性的影响,发现温度降低Anammox 的去除效果会随之下降[16],Lin 等通过宏蛋白组学研究温度对厌氧氨氧化菌群落蛋白质组的影响,发现当温度为15 ℃时厌氧氨氧化菌活性明显受到了抑制[17]。Ma 等以血红素c 作为指标论证不同温度下厌氧氨氧化能力的可能性,相同温度下血红素c 浓度与氮去除负荷(NRR)呈正相关,温度对血红素c 有显著影响[18]。
2.1.2 pH 值 AnAOB 适宜pH 为6.7~8.3。有研究表明改变pH 值可以在较低温度下保持一定的厌氧氨氧化菌活性[19]。纪鑫奇等研究pH 对厌氧氨氧化/反硝化耦合脱氮的影响,发现当pH 超过适宜范围时,Anammox 活性会显著下降,表明pH 过高会抑制厌氧氨氧化活性[20]。也有相关文献证明过高的pH 会造成不可逆的抑制作用甚至停止反应[21]。
2.1.3 溶解氧 AnAOB 是严格厌氧菌。DO 对厌氧氨氧化过程产生抑制作用的主要原因:(1)氧分子参与反应生成一些对AnAOB 有抑制作用的自由基和氧化物;(2)一定浓度的DO 会促进好氧微生物的生长,使AnAOB 活性受到抑制。在低溶解氧条件下AnAOB 的活性暂时受到抑制,DO 过高不利于AnAOB 的生长和增殖,甚至会使厌氧氨氧化菌失去活性,但随着DO 浓度降低AnAOB 活性会逐渐恢复,表明溶解氧对AnAOB 的抑制作用是可逆过程[22],即一定量的DO 并不会对AnAOB 造成不可逆的影响,只是暂时抑制其活性[23]。研究表明在有氧条件中,NO2-不稳定会被硝化细菌氧化为NO3-,使NO3-积累抑制微生物活性,从而消耗厌氧氨氧化反应底物,影响反应器的脱氮效率[24]。
2.2 物料浓度
2.2.1 有机物 厌氧氨氧化菌属于化能自养菌,无机碳源为其代谢增殖所需,无需有机碳源参与[25]。陈重军等采用连续流UASB 反应器研究乙酸钠对厌氧氨氧化脱氮性能的影响,试验研究表明当有机物浓度为40 mg/L时反应器对总氮的去除效果最佳可达88.5%,进水COD 为60 mg/L、80 mg/L 时,反应器的脱氮性能受到了不同程度的抑制[26]。Pijuan M 等研究COD 短期和长期条件下对厌氧氨氧化反应器的影响,短期投加COD不会使氨氮浓度增加,因此并不会影响厌氧氨氧化活性;长期投加会使Anammox 的活性降低,微生物群落发生转移,导致厌氧氨氧化分数降低,当停止投加一段时间后发现其活性逐渐恢复[27]。
2.2.2 基质浓度 NH4+-N、NO2--N 是厌氧氨氧化反应的主要底物和能量来源,Strous 等通过化学计量关系得出厌氧氨氧化过程基质理论值(RIS)为NH4+/NO2-=1:1.32。Ren-Cun Jin 等研究表明亚硝酸盐对厌氧氨氧化的抑制作用显著,当RIS 在1.2~1.5 时微生物会消耗过量的亚硝酸盐,RIS 从1.5 提升至1.8 时过量的亚硝酸盐抑制了厌氧氨氧化菌的活性,从而得出最佳进水底物比RIS 为1.2[28]。钱俊伟等发现随着进水总氮容积负荷从0.61 kg/(m3·d)升高到2.52 kg/(m3·d)时,总氮去除负荷提高到1.29 kg/(m3·d);但总氮容积负荷增加至3.2 kg/(m3·d)时总氮去除负荷降低至1.08 kg/(m3·d),此时厌氧氨氧化菌的活性受到抑制,反应器脱氮效能降低[29]。Lotti 等发现亚硝氮浓度为300 mg/L 时AnAOB菌仍具有一定的活性[30]。
2.2.3 微生物浓度 浮霉菌门为厌氧氨氧化功能菌,可以去除反应器内的氨氮和亚硝氮,促进厌氧氨氧化反应进行[31]。在属分类水平下,Brocadia 菌属对NH4+和NO2-亲和性更强,生长速率较快,且适量的有机物可增加Brocadia 菌属丰度,又可以使反应器内具有一定量的反硝化菌,两者共存形成稳定高效脱氮的耦合生物膜,加快脱氮性能[32]。Bacillus 属于厚壁菌门且为有机化能营养型细菌,可进行反硝化作用,过多有机物会使反硝化菌与厌氧氨氧化菌竞争底物基质影响反应器的脱氮性能[33]。
3 体系中的微生物作用
在Anammox 反应器的菌种中存在厌氧氨氧化菌和异养菌,大多数异养菌都参加氮循环过程,并且进行反硝化过程使得异氧反硝化菌与厌氧氨氧化菌竞争底物基质,从而影响厌氧氨氧化菌的活性和生长增殖[34]。Zhao 等证明Ignavibacterium 和Gp4 与厌氧氨氧化菌存在交互营养共生关系[35]。吕恺等研究发现生物膜上的氨氧化细菌(AOB)与厌氧氨氧化菌形成良好的协同作用,并且厌氧氨氧化菌与亚硝酸盐氧化菌(NOB)竞争亚硝酸盐时具有优势[36]。低有机物浓度下反硝化菌利用NO3--N 和NO2--N 与厌氧氨氧化菌协同脱氮,反应器内Anammox 菌产生的NO3--N 被反硝化菌利用,同时反硝化菌为Anammox 菌提供无机碳源和NO2--N,两者表现为共生关系,相互促进使反应器的脱氮效果提高[37];高有机物条件下反硝化菌与厌氧氨氧化菌竞争共同底物NO2--N 和生存空间,导致反应器脱氮性能下降(见图3)。
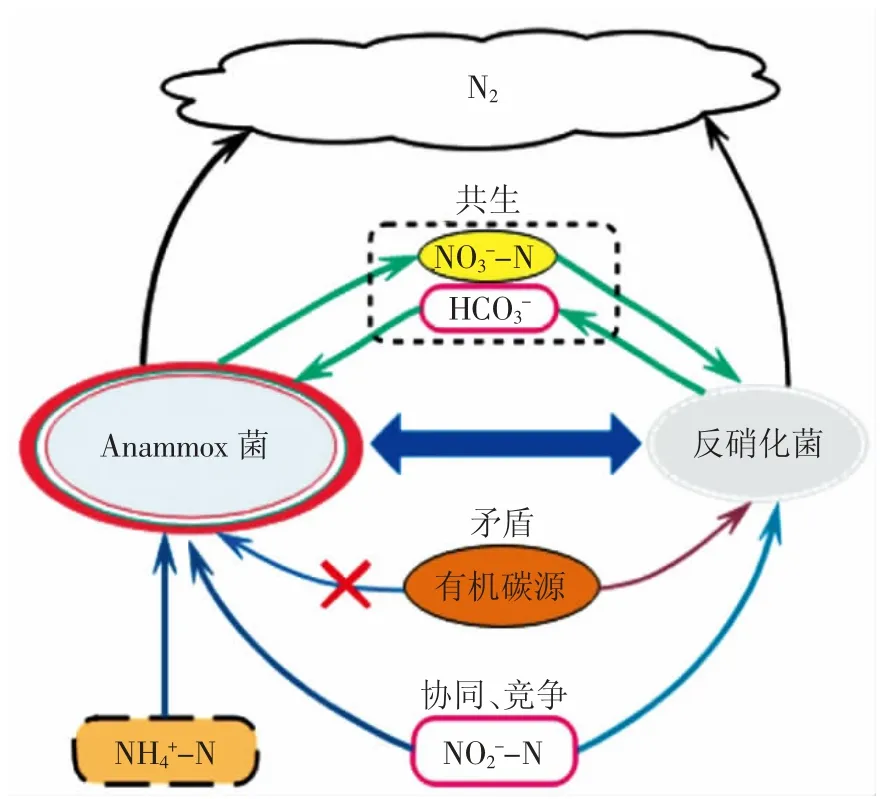
图3 厌氧氨氧化菌与反硝化菌关系Fig.3 The relationship between Anammox bacteria and denitrifying bacteria
4 厌氧氨氧化技术的应用
世界上第一座厌氧氨氧化反应器在荷兰鹿特丹Dokhaven 污水厂于2002 年建成并运行,随着国内外研究者的进一步研究,该工艺逐渐向工艺实际应用的方向发展,目前已有一百多座厌氧氨氧化污水处理厂[38]。
新加坡樟宜污水厂是首座采用主流厌氧氨氧化工艺的处理厂,通过缺氧好氧交替进行,水力停留时间短等措施使AOB 成为优势菌种,实现了部分厌氧氨氧化和短程硝化,出水水质较好,樟宜污水厂的能耗可降低至60%[39]。西安市第四污水处理厂在缺氧段投加填料培养厌氧氨氧化菌实现厌氧氨氧化脱氮,相比传统脱氮可节约40%的能耗;2015-2018 年对厌氧氨氧化菌丰度分析表明填料上的AnAOB 丰度逐渐增加,2018年采用同位素示踪法定量测得表明厌氧氨氧化过程的脱氮比例占30%左右,目前该污水厂的Anammox 已稳定运行[40]。Han 等在北京高碑店污水处理厂采用短程硝化/厌氧氨氧化(PN/A)工艺处理污泥消化液发现生物膜中的AnAOB 丰度显著提高[41]。
5 总结与展望
目前,厌氧氨氧化的实际应用受厌氧氨氧化菌生长富集缓慢、细胞产率低、环境因素等条件限制,因此未来发展应研究解决以下方面的问题:(1)优化工艺条件提高厌氧氨氧化菌活性,培养出对环境要求低、世代周期短的新型厌氧氨氧化菌以实现菌的快速富集;(2)将厌氧氨氧化与传统脱氮工艺相结合,充分发挥各工艺的优势以达到更好地脱氮效果,例如SHARON 反应器与厌氧氨氧化工艺串联运行处理高氨氮废水,可弥补传统脱氨工艺对高C/N 废水处理效果差的问题。探索厌氧氨氧化耦合其他工艺的脱氮性能,为加快实际应用提供技术指导。

