血必净注射液辅助治疗重症肺炎的疗效及其对细胞免疫、炎症因子影响的系统评价Δ
韩甜甜,李丹华,赖艳妮,刘小虹
(1.广州中医药大学第一临床医学院,广东 广州 510000; 2.广州中医药大学第一附属医院检验科,广东 广州 510000; 3.广州中医药大学第一附属医院呼吸科,广东 广州 510000)
重症肺炎的发病机制与感染、毒素和免疫学因素有关,研究结果显示,感染后激活机体免疫,产生细胞因子风暴,而由此引起的免疫损伤、免疫抑制是导致疾病进展的主要原因[1-2]。目前,临床治疗重症肺炎多以抗菌、抗炎等对症支持治疗为主,但是,广谱抗菌药物的使用会导致耐药菌株的形成,激素等免疫治疗则会影响人体本身免疫功能,故临床需要既可抗炎又可调节免疫的安全性较高的药物用于重症肺炎的治疗。血必净注射液于2004年上市,已有多项关于该药的临床研究,涉及多个学科,丰富了该药的临床有效性和安全性证据体系。其中,2011年开展的血必净注射液治疗重症肺炎的多中心观察性研究结果显示,该药在改善病情严重程度、降低病死率等方面显示出良好的疗效[3]。现代药理研究结果表明,血必净注射液具有调节免疫、抗炎和改善微循环等功效。但目前仍无关于血必净注射液治疗重症肺炎的疗效及其对细胞免疫及炎整因子影响的系统评价。因此,本研究对已发表的、符合条件的血必净注射液辅助治疗重症肺炎的临床研究进行系统评价,以期为该药的临床应用提供参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型:国内外已发表的临床随机对照试验。
1.1.2 研究对象:符合美国胸科学会制定的重症肺炎诊断标准[4-5]或中华医学会制定的的重症肺炎诊断标准[6]。
1.1.3 干预措施:研究组的干预措施为血必净注射液联合常规治疗;对照组的干预措施为常规治疗。
1.1.4 结局指标:有效率;炎症因子[白细胞介素6(IL-6)、白细胞介素8(IL-8)、肿瘤坏死因子α(TNF-α)和白细胞介素10(IL-10)]水平;细胞免疫因子(CD3+、CD4+和CD4+/CD8+)水平。
1.1.5 排除标准:(1)回顾性研究文献;(2)诊断标准不明确的文献;(3)治疗小儿重症肺炎的文献;(4)患者合并其他危重症者(肿瘤、肺纤维化、肺结核以及其他系统继发呼吸衰竭等)的文献;(5)采用免疫治疗、血液透析等特殊治疗的文献;(6)重复发表的文献。
1.2 文献检索策略
以“Xuebijing”“severe pneumonia OR sever pneumoniae”“Inflammatory factors”和“Immunity”为检索词,检索PubMed、EMBase和the Cochrane Library等数据库中自建库至2020年3月发表的文献;以“血必净”“重症肺炎”“炎症因子”和“免疫”为检索词,检索中国知网(CNKI) 、万方数据库(Wanfang Data) 、维普数据库(VIP)和中国生物医学文献服务系统数据库(CBM)中自建库至2020年3月发表的文献,查找有关血必净注射液辅助治疗重症肺炎的随机对照试验。
1.3 文献筛选、资料提取与质量评价
2名研究者按照标准进行文献筛选与评估;提取内容包括基本信息、治疗方案、研究方法学质量、结局指标及结果数据等;基于Cochrane系统评价员手册5.1.0版的偏倚风险评估工具,评价所纳入研究的方法学质量。
1.4 统计学方法
采用RevMan 5.3软件对数据进行处理。计量资料的效应分析统计量以均数差(MD)或标准化均数差(SMD)及其95%置信区间(CI)表示,计数资料的效应分析统计量以比值比(OR)及其95%CI表示。合并分析前,采用卡方检验进行异质性分析。若I2<50%,P>0.10,提示无异质性,采用固定效应模型进行荟萃分析(Meta分析);反之,提示异质性较大,采用随机效应模型进行Meta分析。
2 结果
2.1 文献检索结果与纳入文献的基本特征
初步检索出相关文献243篇,经过逐层筛选,最终纳入20篇文献[7-26],包括1 748例患者(研究组共876例,对照组共872例);其中1篇文献[7]以英文发表,19篇文献[8-26]以中文发表。文献筛选流程与结果见图1;纳入文献的基本特征见表1。
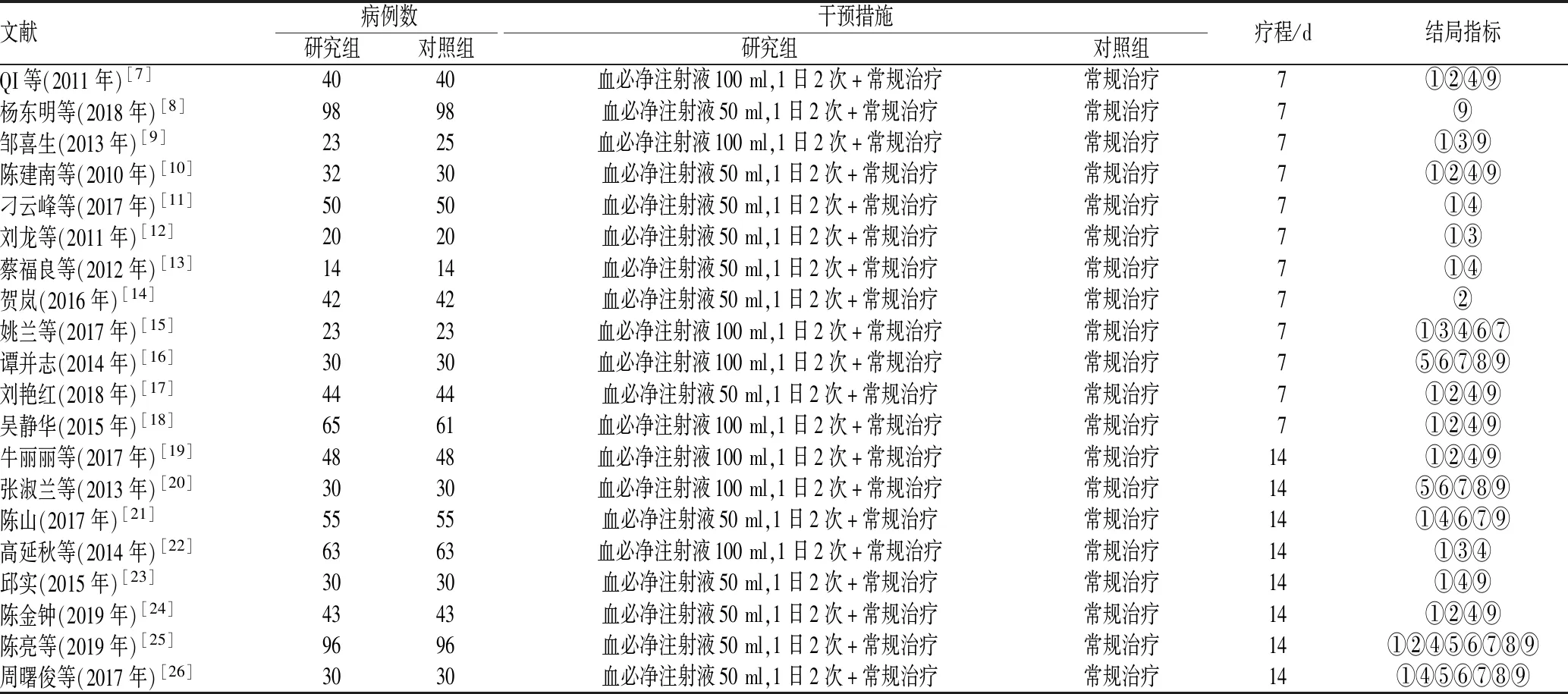
表1 纳入文献的基本特征Tab 1 Basic characteristics of included literature

图1 文献筛选流程与结果Fig 1 Process and results of literature screening
2.2 纳入研究的方法学质量评价
对纳入研究进行质量评价,结果显示,研究质量等级偏低,多数研究未明确盲法、分配隐藏、数据完整性以及偏倚来源,见表2、图2—3。
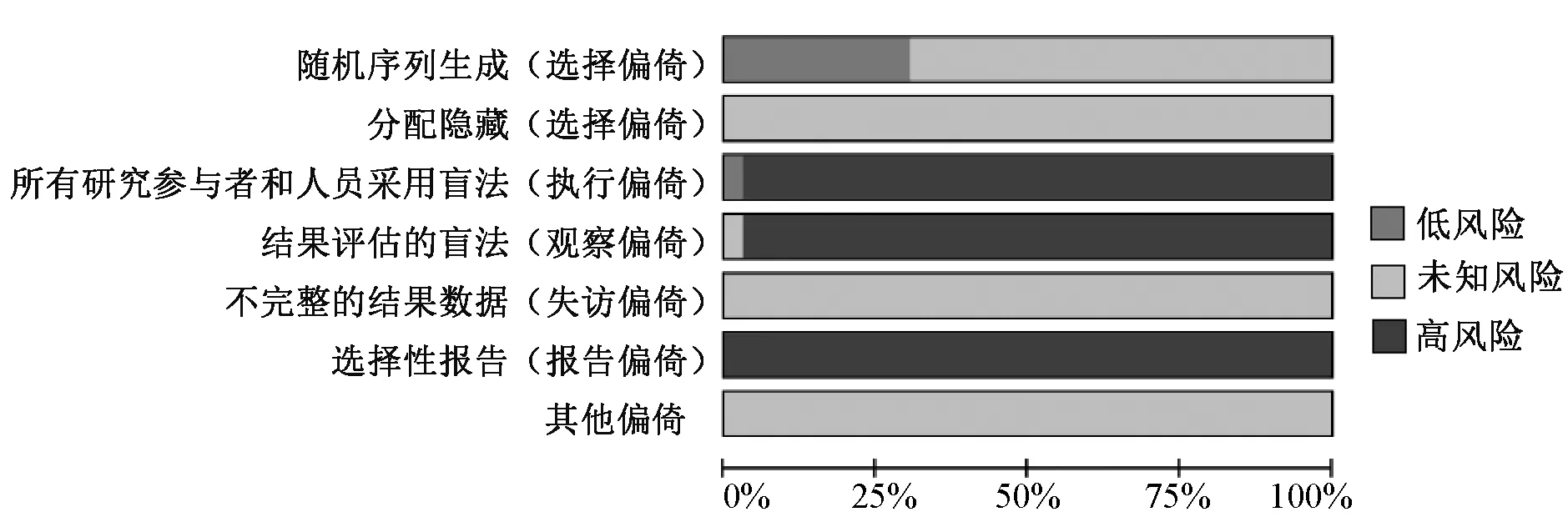
图2 纳入文献的偏倚风险总图Fig 2 Summary of bias graph of included literature

图3 纳入文献的偏倚风险图Fig 3 Bias graph of included literature
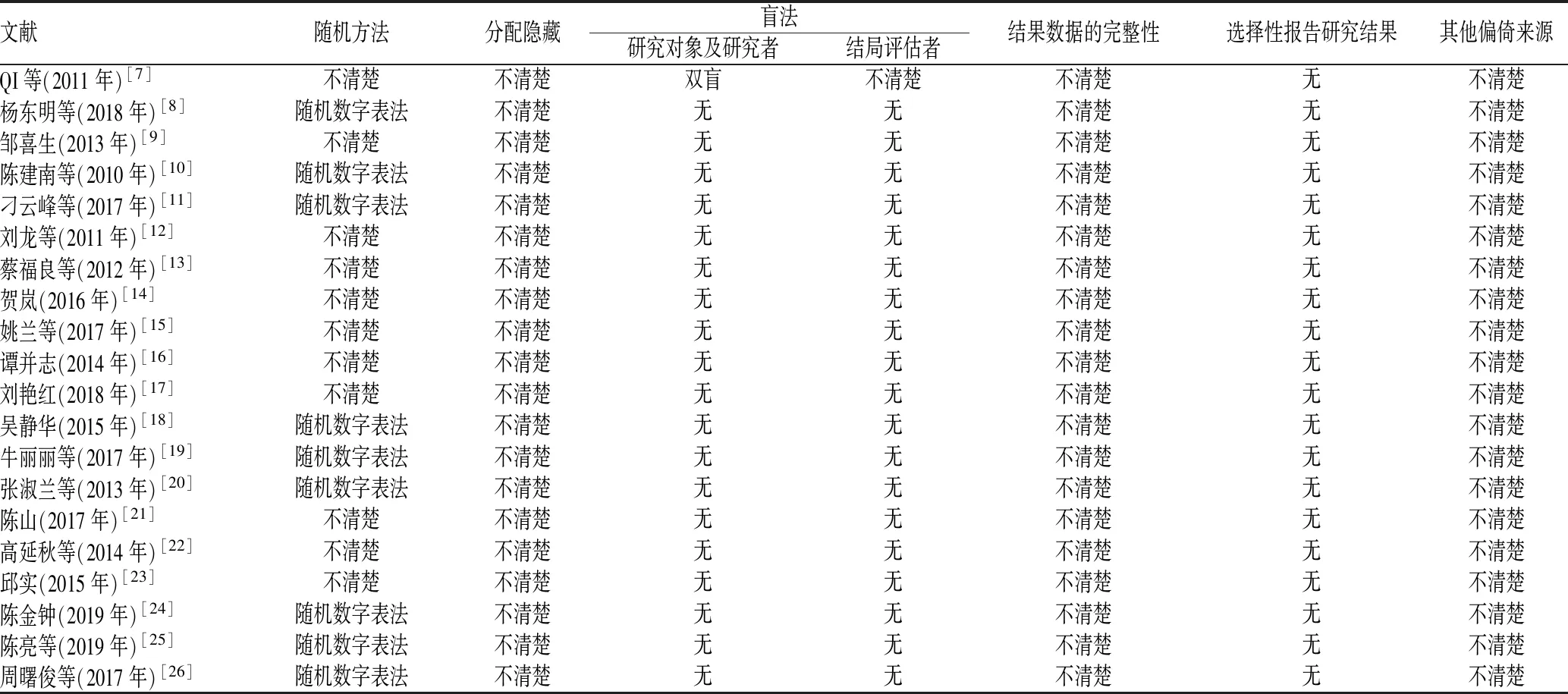
表2 纳入研究的方法学质量评价Tab 2 Methodological quality evaluation of included literature
2.3 Meta分析结果
2.3.1 有效率:14项研究[7-10,16-21,23-26]报告了有效率,其中6项研究[8-10,16-18]的疗程为7 d,其余8项研究[7,19-21,23-26]的疗程为14 d,两个亚组间无异质性(Chi2=4.72,df=13,P=0.98,I2=0%),采用固定效应模型进行Meta分析。结果显示,研究组患者的有效率明显优于对照组,差异有统计学意义(OR=3.75,95%CI=2.68~5.25,P<0.000 01),见图4。
2.3.2 炎症因子:(1)治疗后的IL-6水平。16项研究[7-10,16-21,23-26]报告了治疗后的IL-6水平,其中8项研究[6-10,15-16,19]的疗程为7 d,其余8项研究[7,19,21-26]的疗程为14 d,两个亚组间有异质性(Chi2=331.97,df=15,P<0.000 01,I2=95%),采用随机效应模型进行Meta分析。结果显示,研究组患者治疗后的IL-6水平明显低于对照组,差异有统计学意义(SMD=-1.86,95%CI=-2.48~-1.24,P<0.000 01),见图5。(2)治疗后的IL-8水平。8项研究[7,10,14,16,18-19,24-25]报告了治疗后的IL-8水平,其中4项研究[10,14,16,18]的疗程为7 d,其余4项研究[7,19,24-25]的疗程为14 d,两个亚组间有异质性(Chi2=52.52,df=7,P<0.000 01,I2=87%),采用随机效应模型进行Meta分析。结果显示,研究组患者治疗后的IL-8水平明显低于对照组,差异有统计学意义(SMD=-1.09,95%CI=-1.51~-0.68,P<0.000 01),见图6。(3)治疗后的IL-10水平。4项研究[8,12,15,22]报告了治疗后的IL-10水平,其中3项研究[8,12,15]的疗程为7 d,1项研究[22]的疗程为14 d,两个亚组间无异质性(Chi2=5.70,df=3,P=0.13,I2=47%),采用固定效应模型进行Meta分析。结果显示,研究组患者治疗后的IL-10水平明显高于对照组,差异有统计学意义(SMD=0.31,95%CI=0.06~0.55,P=0.01),见图7。(4)治疗后的TNF-α水平。14项研究[7,10-11,13,15,17-19,21-26]报告了治疗后的TNF-α水平,其中6项研究[10-11,13,15,17-18]的疗程为7 d,其余8项研究[7,19,21-26]的疗程为14 d,两个亚组间有异质性(Chi2=286.66,df=13,P<0.000 01,I2=95%),采用随机效应模型进行Meta分析。结果显示,研究组患者治疗后的TNF-α水平明显低于对照组,差异有统计学意义(SMD=-1.98,95%CI=-2.62~-1.34,P<0.000 01),见图8。
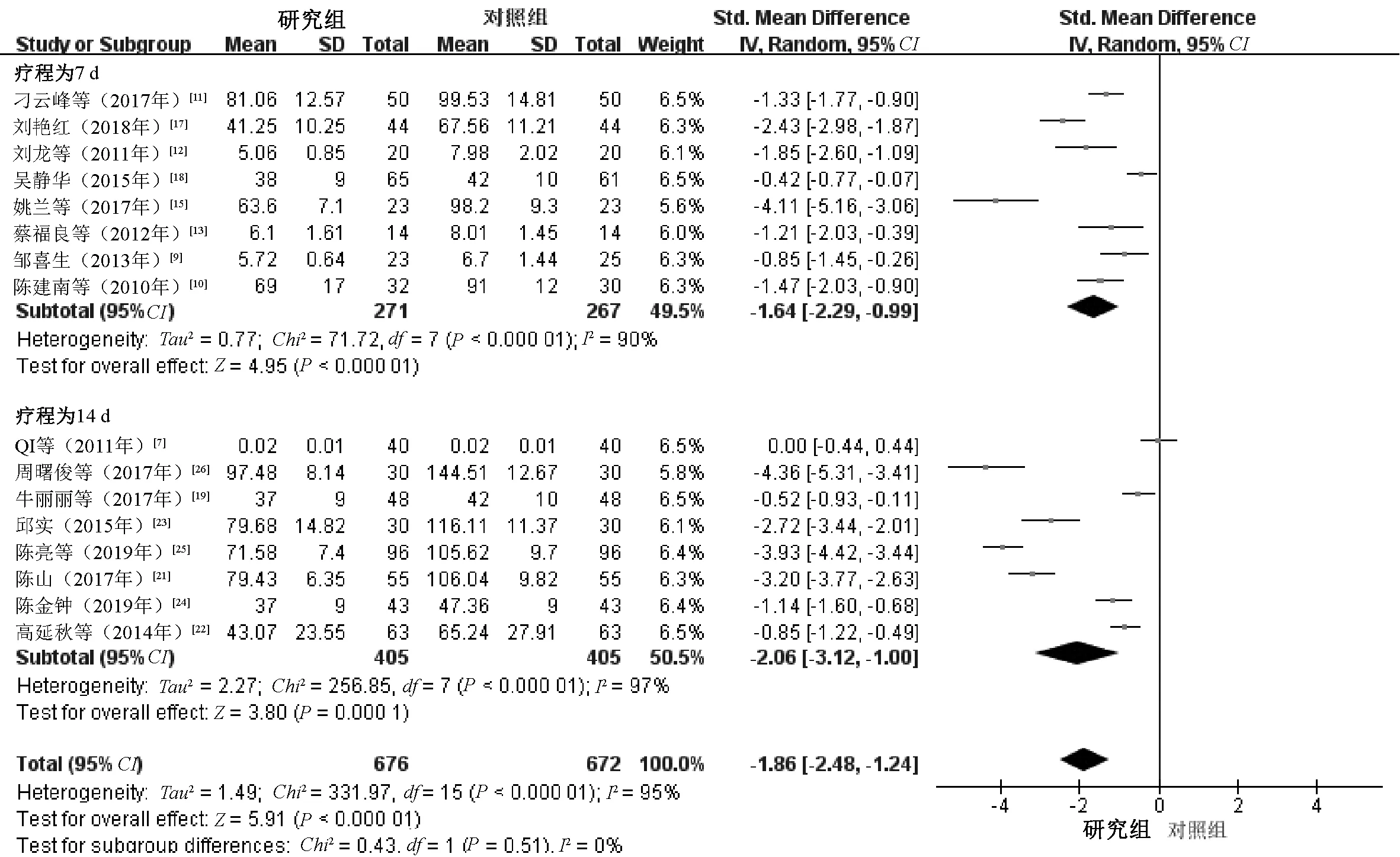
图5 两组患者治疗后IL-6水平比较的Meta分析森林图Fig 5 Meta-analysis of comparison of IL-6 levels between two groups after treatment
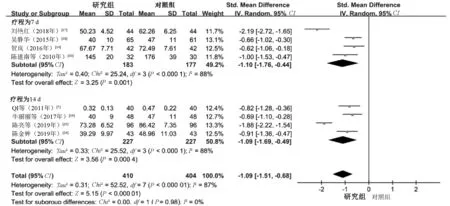
图6 两组患者治疗后IL-8水平比较的Meta分析森林图Fig 6 Meta-analysis of comparison of IL-8 levels between two groups after treatment

图8 两组患者治疗后TNF-α水平比较的Meta分析森林图Fig 8 Meta-analysis of comparison of TNF-α levels between two groups after treatment
2.3.3 细胞免疫因子:(1)治疗后的CD3+水平。4项研究[16,20,25-26]报告了治疗后的CD3+水平,其中1项研究[16]的疗程为7 d,其余3项研究[20,25-26]的疗程为14 d,两个亚组间有异质性(Chi2=26.10,df=3,P=0.13,I2=89%),采用随机效应模型进行Meta分析。结果显示,研究组患者治疗后的CD3+水平明显高于对照组,差异有统计学意义(MD=9.05,95%CI=6.17~11.93,P<0.000 01),见图9。(2)治疗后的CD4+水平。6项研究[15-16,20-21,25-26]报告了治疗后的CD4+水平,其中2项研究[15-16]的疗程为7 d,其余4项研究[20-21,25-26]的疗程为14 d,两个亚组间有异质性(Chi2=383.76,df=5,P<0.000 01,I2=99%),采用随机效应模型进行Meta分析。结果显示,研究组患者治疗后的CD4+水平明显高于对照组,差异有统计学意义(MD=9.20,95%CI=3.55~14.86,P=0.001),见图10。(3)治疗后的CD4+/CD8+水平。4项研究[16,20,25-26]报告了治疗后的CD4+/CD8+水平,其中1项研究[16]的疗程为7 d,其余3个研究[20,25-26]的疗程为14 d,两个亚组间有异质性(Chi2=12.78,df=3,P=0.005,I2=77%),采用随机效应模型进行Meta分析。结果显示,研究组患者治疗后的CD4+/CD8+水平明显高于对照组,差异有统计学意义(MD=0.52,95%CI=0.31~0.73,P<0.000 01),见图11。
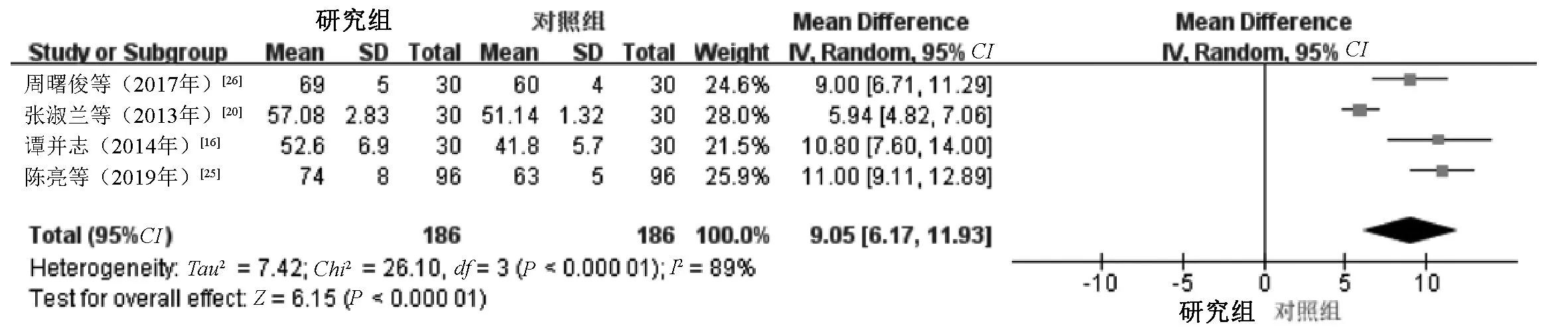
图9 两组患者治疗后CD3+水平比较的Meta分析森林图Fig 9 Meta-analysis of comparison of CD3+ levels between two groups after treatment

图10 两组患者治疗后CD4+水平比较的Meta分析森林图Fig 10 Meta-analysis of comparison of CD4+ levels between two groups after treatment
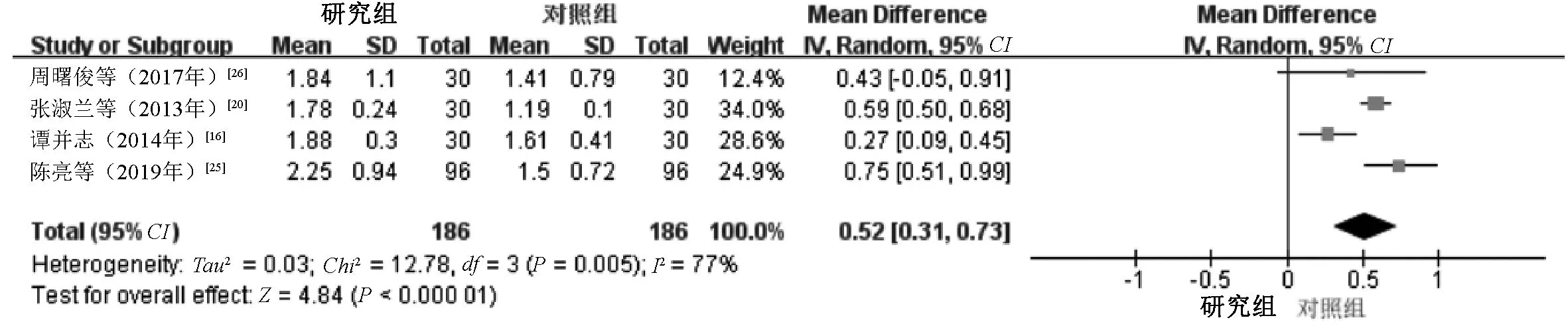
图11 两组患者治疗后CD4+/CD8+水平比较的Meta分析森林图Fig 11 Meta-analysis of comparison of CD4+/CD8+ levels between two groups after treatment
3 讨论
本研究最终纳入20篇有关血必净注射液辅助治疗重症肺炎的文献进行系统评价,结果显示,研究组患者的有效率显著高于对照组,治疗后的IL-6、IL-8和TNF-α水平显著低于对照组,治疗后的IL-10、CD3+、CD4+和CD4+/CD8+水平显著高于对照组,上述差异均有统计学意义(P<0.05)。提示血必净注射液联合常规治疗,能提高重症肺炎的治疗有效率,同时能减轻血清中IL-6、IL-8和TNF-α对机体的损伤,提高IL-10水平以达到直接或间接降低血清IL-6水平的目的。此外,研究组患者的CD3+、CD4+含量以及CD4+/CD8+的比值均高于对照组,提示联合应用血必净注射液,能有效改善重症肺炎患者的免疫功能。张淑文等[27]的研究结果显示,血必净注射液能明显降低脓毒症模型大鼠血清炎症介质水平,使促炎与抗炎达到平衡,并能改善其免疫功能状态,与本结果一致。
目前临床和基础研究结果表明,重症肺炎与细菌或病毒感染有关,相应病原微生物入侵,炎症介质持续释放,导致全身性炎症反应综合征和凝血功能障碍[28-29]。因此,除使用抗菌药物对病原微生物进行积极的早期治疗外,抗炎和抗凝治疗还可以改善重症肺炎患者的预后。目前,重症肺炎的主要治疗策略涉及抗菌和抗炎治疗[30]。但是,长期的抗菌药物治疗不仅会增加细菌耐药的风险,还会产生肝肾毒性和其他不良反应[31]。此外,先前的抗炎策略在临床研究中显示出有限的疗效,部分原因是因为其靶向单一细胞因子[32]。最近的研究结果显示,中药在治疗重症肺炎方面具有良好的临床疗效[33]。表明在补充疗法和替代疗法中,中药治疗可能代表一种新的重症肺炎治疗方法。血必净注射液是在“菌毒炎并治”及“三证三法”的辨证原则及理论指导下开发而成的中药注射剂[34-36]。该药的有效成分由红花、赤芍、川芎、丹参和当归构成,具有化瘀解毒的作用[37]。血必净注射液具有潜在的抗炎和增强免疫功能的作用[38]。有研究结果表明,红花黄色素可以有效调控免疫失衡,调节抗炎因子及抑炎因子,在炎症过度反应阶段可以有效抑制炎症因子如TNF-α、IL-6的合成与释放,促进抑炎因子IL-10的产生;并通过促进T淋巴细胞增殖活性,提高细胞免疫应答效应,调控细胞免疫[39]。
本次Meta分析结果显示,在常规治疗基础上联合使用血必净注射液对重症肺炎患者的炎症因子和细胞免疫因子水平有影响,但纳入的研究中,大多数为非多中心、小样本量的临床随机双盲对照研究,循证医学证据等级偏低。需高质量、大样本、多中心的临床随机双盲对照研究以验证其有效性,为临床提供更多证据。
综上所述,血必净注射液能有效调节炎症因子,减轻重症肺炎的症状和各种炎症反应。

