DNA去甲基化参与提高白菜型冬油菜抗寒性的生理机制
王万鹏 ,马 骊,孙柏林,郭秀娟 ,王世发 ,牛早霞 ,祁伟亮,蒲媛媛,路晓明,呼芳娣,许金苗 ,马学才,武军艳,李学才 ,方 彦,孙万仓,刘丽君
(1. 甘肃农业大学农学院/甘肃省油菜工程技术研究中心/甘肃省干旱生境作物学重点实验室/甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070; 2. 山西省农业科学院高寒区作物研究所,山西 大同 037000;3.吉林省农业科学院经济植物开发研究中心,吉林 长春 130124)
植物的抗寒性与其所在的生态环境具有密切关系, Kovi 等[1]对多年生黑麦草的研究表明,同一群体处于不同气候条件选择下其遗传多样性差异增大,同时通过分析其染色体连锁不平衡证实了它们在耐寒性上的差异。低温会使植物抗寒性和适应性变化,特定的低温环境选择可增强抗寒性[2],随着低温选择压力的加大,其抗寒性逐渐增强。Bertrand等[3]对红三叶草进行耐寒性轮回选择发现,与最初的原始品种相比,反复低温选择的群体抗冻性提高了6℃。玉米由热带气候到温带气候的适应性过程中,各种代谢途径及产物等因环境选择而表现出显著的差异[4-5];大豆原本是属于温带地区的作物,但是由于在环境选择下其生育期基因J的等位变异,使原产于温带的大豆品种能够适应热带地区的短日照条件,生育期延长,大豆产量增加[6-7]。
研究表明植物对环境的适应尤其对低温胁迫的适应与其DNA甲基化有密切关系。DNA甲基化是植物中普遍存在的一种表观遗传方式,在不改变DNA序列的情况下调控植物基因表达,调节植物生长发育[8-9]。在非生物胁迫下,植物通过改变甲基化状态调节抗逆相关基因的表达,进而影响表型使其做出适应性改变[10]。盖树鹏等[11]研究发现,随着低温效应积累,牡丹基因组DNA甲基化和总甲基化水平呈现下降的趋势,推测牡丹休眠相关基因的表达由去甲基化和甲基化作用调控。周艳华等[12]研究发现茶树冷驯化过程中同时发生了甲基化和去甲基化。白静等[13]研究发现,甘蓝型冬油菜低温胁迫后,抗寒性强的品种DNA甲基化水平降低,以去甲基化作用为主;抗寒性弱的材料DNA甲基化水平升高。郝梦真[14]研究发现西洋参的DNA甲基化水平随着季节温度的变化呈现周期性可逆的动态变化。华霜[15]研究表明,低温胁迫诱导过程中白灵菇发生了DNA甲基化变异;随着低温胁迫时间的延长DNA甲基化水平升高。
5氮杂胞苷(5-azaC)是在植物上应用最广泛的DNA甲基化抑制剂之一,能够使DNA甲基化水平降低[16-17],是一种去甲基化试剂,在一定程度上能减轻各种非生物胁迫造成的损伤,并具有一定生理调节作用。研究表明适宜浓度的5-azaC处理可显著降低白菜幼苗DNA甲基化水平,减缓白菜在高温胁迫下的生长量及细胞渗透物质的下降幅度,同时增强细胞膜耐损伤能力[18]。5-azaC处理能够有效降低低温胁迫下黄瓜幼苗叶片细胞膜相对透性,促进光合作用,提高黄瓜幼苗的耐冷性[19]。李有芳等[20]研究发现5-azaC会导致小麦植株矮化,显著提高盐胁迫下小麦叶片的抗氧化能力,有效缓解盐胁迫负效应。李梅兰等[21]研究表明,低浓度的5-azaC能够代替低温促进白菜开花。5-azaC在一定程度上能减轻大麦苗期湿害,显著降低湿害胁迫下植株的MDA含量[22]。目前关于DNA甲基化水平降低对低温胁迫下白菜型冬油菜抗寒性影响的探讨还鲜有报道。本试验选用在不同生态环境条件选择的10个白菜型冬油菜材料鉴定其抗寒性,通过DNA甲基化抑制剂处理比较其生长发育以及低温胁迫下生理特性和DNA整体甲基化水平的响应,探究材料间抗寒性差异及DNA甲基化降低对抗寒性的影响机制。
1 材料与方法
1.1 试验材料
CT-2360、CT-2380、CT-2400、CT-2420、CT-2440、CT-2460、MXW-1、2018-FJT、DT-7、DT-9共10份材料。其中,MXW-1是以CT-2360为亲本在兰州上川选育的强抗寒白菜型冬油菜品系,在黑龙江饶河、吉林公主岭、新疆阿勒泰等地能够安全越冬;CT-2380、CT-2400、CT-2420、CT-2440、CT-2460为CT-2360的系选材料,DT-7、DT-9和2018-FJT为在山西大同、吉林公主岭范家屯从MXW-1材料经过4 a选择得到的新品系。材料来源地气候因子见表1。
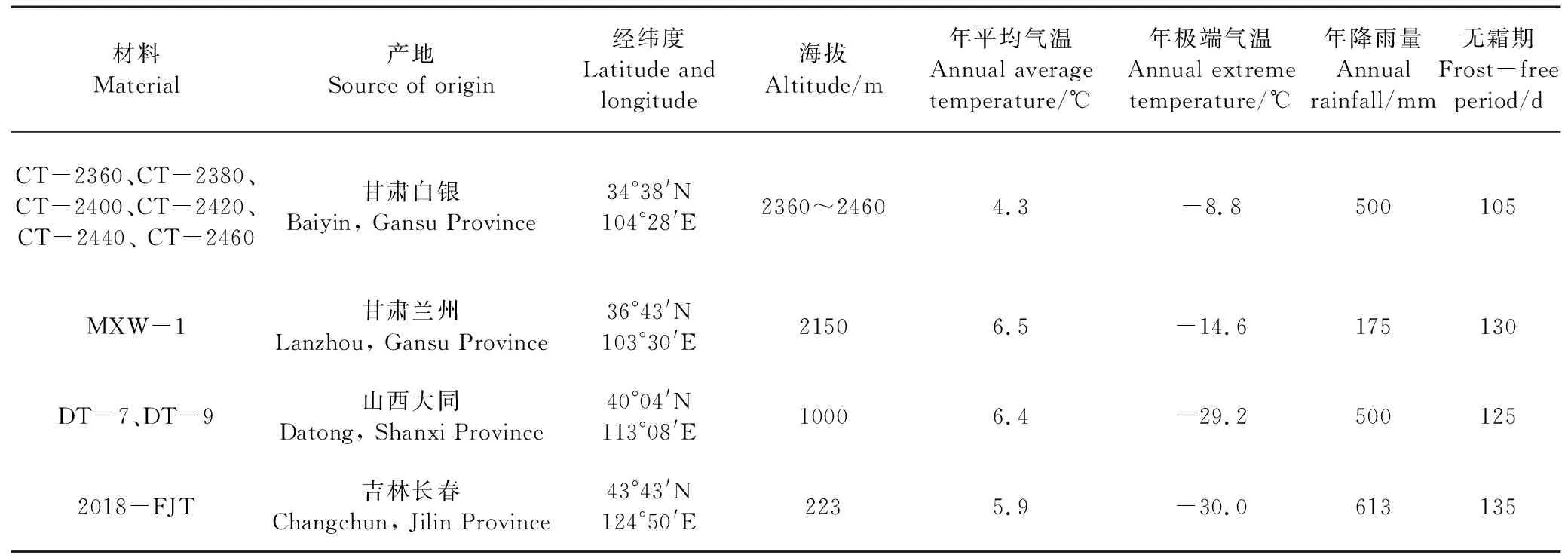
表1 材料及其来源地的地理环境及气候因子Table 1 Geographic environment and climatic factors of the materials and their sources
1.2 主要仪器和试剂
5-氮杂胞苷(5-azaC)购自sigma公司(CAS号:320-67-2 );低温循环仪(MPG-40C;上海一恒科学仪器有限公司);紫外分光光度计(U-5100);电导率仪(DDS-307A;上海雷磁仪器);低温培养箱(LRH-250CA;上海一恒科学仪器有限公司);光照培养箱(SPX-250-GB;上海跃进医疗器械有限公司);四元梯度超快速液相色谱仪(ACQUITY Arc,美国Waters)。
1.3 试验处理
选取籽粒饱满、大小均匀的100粒白菜型冬油菜种子,使用ddH2O冲洗干净,在培养皿中放入光照培养箱中进行抑制剂处理发芽试验,培养条件:温度25℃,湿度50%,光照16 h,黑暗8 h。
抑制剂添加:分别使用0、10、50、100、300、1 000 μmol·L-1浓度的甲基化抑制剂5-azaC溶液处理,每个处理3次重复。处理期间,每隔24 h在培养皿中添加相应浓度的5-azaC溶液5 ml,处理4 d测定发芽势,7 d后测定发芽率、根长。
低温胁迫处理:将甲基化抑制剂预处理7 d后长势一致的幼苗移栽到花盆中,培养条件同发芽试验。重复3次,生长到五叶期后在4℃低温培养箱中(光照16 h,黑暗8h)进行低温胁迫处理:处理时长分别为0.5、1、2、3、5 d和恢复生长2 d(RG2d)。
1.4 测定指标及方法
1.4.1 半致死温度测定及计算 选用未经处理的正常生长材料的五叶期叶片,用去离子水洗净擦干,使用打孔器避开叶片主脉和边缘分别取大小相同的小圆片2~3片,置于10 ml的试管中并加入200 μl去离子水,对照为空白去离子水。于低温循环仪中分别设置6个温度梯度:0、-4、-8、-12、-16、-20℃,每个处理设置3次重复,温度降至所设温度处理1 h后取出,用去离子水定容至10 ml,摇床上摇动2 h后使用电导率仪测定其电导率(C1),设CK电导率为C0,测定完成后高压灭菌20 min,再测定其电导率(C2)。
相对电导率(REC)=(C1-C0)/(C2-C0)×100%
参照王晓辉等[23]的方法对试验数据进行Logistic回归分析,求出低温半致死温度(LT50)。
1.4.2 生长指标和生理指标测定 抑制剂处理4 d后计算发芽势:
发芽势=4 d内总发芽种子数/供试种子数×100%
处理7 d后计算发芽率并测量根长:
发芽率=7 d内总发芽种子数/供试种子数×100%
低温处理以后测定其生理指标[24],包括膜特性指标测定:REC[25],丙二醛(MDA)含量用硫代巴比妥酸(TBA)法;细胞渗透物质指标测定:可溶性蛋白采用考马斯亮蓝比色法,游离脯氨酸含量采用磺基水杨酸法;抗氧化能力指标测定:POD活性的测定方法采用愈创木酚法,SOD活性的测定方法采用NBT法,CAT 活性采用紫外吸收法测定。
1.4.3 基因组DNA甲基化水平的HPLC分析 使用改良的CTAB法提取并纯化参试材料的基因组DNA,参照董亚娟等[26]的方法用HPLC分析白菜型冬油菜总DNA甲基化水平。
1.5 数据处理及分析
生理数据和DNA甲基化水平数据均使用Excel处理,使用Origin 2018进行REC非聚类热图[27]以及其他图表的绘制,使用SPSS 22.0进行方差分析、相关性分析和LSD多重比较(差异显著水平取P<0.05)。
2 结果与分析
2.1 不同环境条件下育成白菜型冬油菜的抗寒性
10个参试白菜型冬油菜材料的叶片REC变化测量结果如图1所示。叶片REC随温度的降低总体上呈不断增加的趋势,其中在0~-8℃增加缓慢,-8~-16℃增加较快,基本符合Logistic曲线的变化趋势。处理温度与REC之间呈显著的负相关,相关系数(见表2)为-0.847~-0.993。温度从0℃降到-20℃的过程中CT-2360、CT-2380、CT-2400、CT-2420、CT-2440、CT-2460的REC一直处于较高的水平(8.74%~75.52%),高于其他的材料(6.66%~62.55%),说明其细胞膜受到的伤害高于其余材料;而DT-7、DT-9、2018-FJT和MXW-1的REC一直处于较低的水平,说明低温对其细胞膜伤害的程度较弱。
根据参试材料叶片在不同低温下的REC求出Logistic方程、低温半致死温度(LT50)、拟合度(R2)以及相关系数(R)(表2)。从Logistic方程拟合结果可见拟合度较高,10个参试材料的半致死温度均低于-10℃,其中2018-FJT的半致死温度为-16.04℃;DT-7、DT-9以及MXW-1的半致死温度分别为-15.98℃、-15.63℃、-15.04℃;而CT-2360的半致死温度为-11.32℃。依据半致死温度,10个白菜型冬油菜抗寒性由强到弱依次为:2018-FJT>DT-7>DT-9>MXW-1>CT-2460>CT-2400>CT-2380>CT-2420>CT-2440>CT-2360。
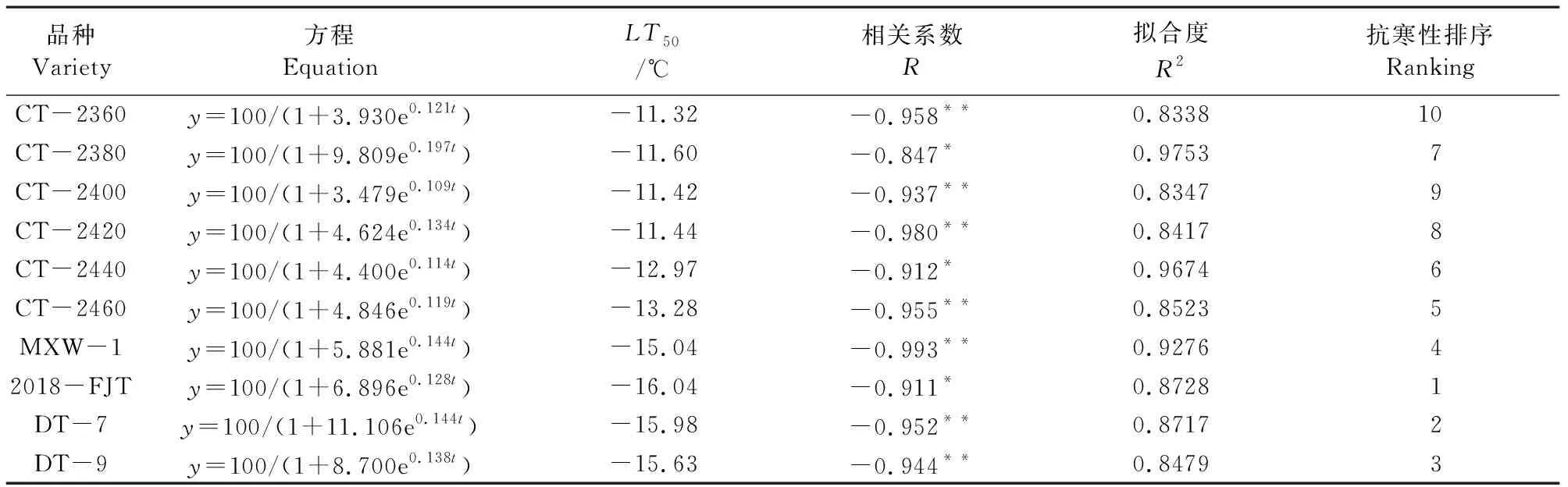
表2 不同抗寒性白菜型冬油菜的Logistic方程及半致死温度Table 2 Logistic equation and semi-lethal temperature of winter rape with different cold resistance
2.2 参试材料半致死温度与其育成环境的气候相关性分析
对参试材料的半致死温度(LT50)与其育成环境因子采用 Pearson Correlation相关性检验结果(表3),半致死温度与纬度和年平均气温有极显著的负相关性,与经度呈显著的负相关,与海拔和年最低气温呈极显著的正相关,和年降雨量相关不显著。半致死温度是判断抗寒性的重要指标,半致死温度越低,抗寒性越高,说明抗寒性的形成与育成环境纬度、年平均气温呈极显著正相关,与海拔和年最低气温呈极显著负相关,和年降雨量关系不显著。

表3 半致死温度与材料育(形)成环境的气候相关性分析Table 3 Analysis of the correlation between semi-lethal temperature and the climate of material breeding environment
2.3 5-azaC处理对不同抗寒性材料种子萌发和生长的影响
测定半致死温度后,根据抗寒性差异及不同选育环境选择CT-2360、MXW-1、2018-FJT、DT-7, 用5-azaC进行处理。经过不同浓度的5-azaC处理白菜型冬油菜种子7 d后发现,10 μmol·L-1处理下MXW-1的发芽势与其他3个材料间差异显著(P<0.05),DT-7的发芽率显著低于CT-2360、MXW-1、2018-FJT,其他浓度处理下4个材料间的种子发芽势和发芽率差异不显著,仅在10 μmol·L-1浓度下MXW-1的发芽率显著降低;在100 μmol·L-1浓度下CT-2360的发芽势和发芽率显著降低。与对照(蒸馏水)相比,1 000 μmol·L-15-azaC处理后CT-2360、2018FJT和MXW-1的种子发芽势显著降低(表4),而DT-7的发芽势下降不显著。随着5-azaC浓度的不断增加,所有参试材料的根长明显缩短(图2),尤其在1 000 μmol·L-1处理下的4个材料的根长较对照分别减少了93.14%、95.11%、95.21%、95.06%。可见DNA去甲基化处理对参试材料的根长具有显著的抑制作用。
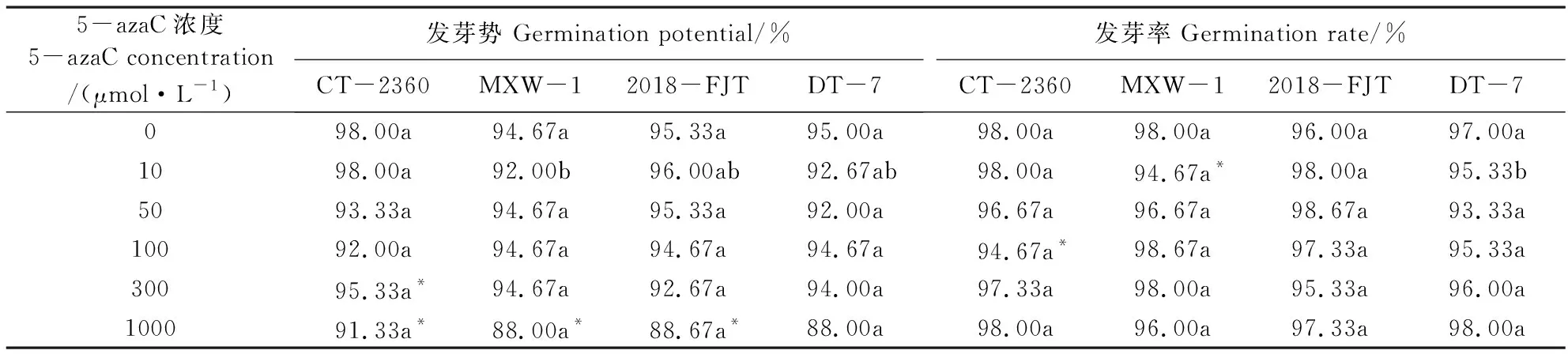
表4 DNA甲基化抑制剂5-azaC处理对不同抗寒性材料种子萌发的影响Table 4 Effects of DNA methylation inhibitor 5-azaC treatment on seed germination of materials with different cold resistance
2.4 5-azaC处理对不同抗寒性材料低温下苗期叶片膜特性的影响
图3为参试材料低温处理下的REC非聚类热图,颜色由紫色到红色代表REC从低到高。由图中可以看出,低温胁迫下CT-2360的REC较对照增加幅度为152.2%~291.7%,低温处理72 h达到最大值,而MXW-1、2018-FJT、DT-7的REC较对照增加幅度分别为111.9%~250.9%、48.4%~206.5%、28.5%~205.5%,在低温处理5 d左右REC才达到最大,说明CT-2360在相同的低温下细胞膜受到的伤害要远高于其余3个材料。而萌发期经过5-azaC处理以后,同一低温胁迫时间内4个材料的REC均显著低于蒸馏水处理的材料;结果表明DNA去甲基化处理显著降低低温胁迫下CT-2360的REC,对MXW-1、2018-FJT、DT-7的影响相对较小。
由图4可以看出,与对照相比,单独低温胁迫后CT-2360、MXW-1、2018-FJT、DT-7的MDA含量均增加且材料间差异显著,其中CT-2360的MDA含量最高,且变化幅度最大,说明低温胁迫下CT-2360的膜脂过氧化伤害最高,其低温耐性弱于其他3个材料;而萌发期5-azaC处理的材料在低温下,MDA含量较蒸馏水处理显著降低,其中抗寒性较弱材料CT-2360的降低幅度最大,强抗寒材料2018-FJT、DT-7的变化幅度最小。由此可见,DNA去甲基化能够缓解低温胁迫对膜脂过氧化的伤害,但缓解程度取决于参试材料抗寒性的强弱,对强抗寒性材料的缓解效果相对较弱。
2.5 5-azaC处理对不同抗寒性材料低温下苗期叶片渗透调节能力的影响
由图5、6可以看出,无抑制剂处理条件下,低温处理5d时CT-2360、MXW-1、2018-FJT、DT-7 Pro含量和SP含量的增加幅度最高,其中强抗寒性材料2018-FJT的Pro含量增幅最大,为239.6% ,而CT-2360的SP含量增幅最大,为172.2%;萌发期低浓度5-azaC处理过的材料,低温胁迫过程中4个材料的Pro含量较蒸馏水处理显著增加,其中强抗寒性DT-7的增幅最大,而高浓度处理时,CT-2360材料的Pro含量较蒸馏水处理明显降低。
萌发期5-azaC处理后,低温过程中4个材料的SP含量较蒸馏水处理明显降低,其中CT-2360的SP含量降幅最大,且低浓度处理与高浓度处理差异不显著且变化趋势基本一致。表明DNA去甲基化处理有利于低温胁迫下强抗寒性材料DT-7 Pro含量的积累和抗寒性较弱材料CT-2360 SP含量的降低以调节细胞渗透压,增强白菜型冬油菜抵御低温的能力。
2.6 5-azaC处理对不同抗寒性材料低温下苗期叶片抗氧化能力的影响
从图7~图9可以看出,CT-2360、MXW-1、2018-FJT、DT-7的SOD活性随着低温胁迫时间的延长呈现逐渐上升的趋势,其中,CT-2360的增幅最低,为12.24%,在不同低温处理间差异均不显著,恢复生长后有所下降,低浓度5-azaC处理后CT-2360材料的SOD活性要低于其他3个抗寒性强的材料,MXW-1材料的SOD活性在低温下显著增加,在高浓度下显著降低;低温处理过程中,4个材料的SOD、POD、CAT活性均上升,其中以低温处理5d最明显,其中4个材料的POD活性较CK的增加幅度非常高,除MXW-1外,CT-2360、2018-FJT、DT-7其他3个材料的POD活性低温处理5d较CK分别显著增加265.38%、174.73%、460%,而低温处理5 d时CT-2360、MXW-1、2018-FJT、DT-7的CAT活性较CK均有显著差异,增幅分别为321.02%、245.64%、221.41%、165.34%;整体上来说,2018-FJT的SOD活性增幅最高,为45.85%,且在POD活性中表现为DT-7的增幅最大,在CAT活性中表现为CT-2360材料增幅最明显。试验结果表明,DNA去甲基化处理能够促进抗氧化酶活性来维持细胞内部在低温胁迫下的代谢平衡,从而影响白菜型冬油菜对低温的适应性,且影响程度与材料本身抗寒性差异有关。
2.7 5-azaC处理对不同抗寒性材料低温下DNA甲基化水平的影响
本研究利用HPLC分析白菜型冬油菜DNA整体甲基化水平,如图10a、图10b中的色谱图所示,标准品和参试材料的胞嘧啶和5甲基胞嘧啶洗脱峰都能有效分离,无混杂。从图10c中可以明显看出所有的参试材料在经过5-azaC处理后发生了去甲基化作用,DNA甲基化水平随5-azaC浓度的增加而减小,不同处理下抗寒性不同的材料DNA甲基化水平也存在差异,并且随着低温胁迫的时间变化呈现动态变化:而DT-7材料在恢复生长2 d时表现为DNA甲基化水平有所增加;无甲基化抑制剂5-azaC处理条件下,低温0.5 d处理时,MXW-1的甲基化水平最高(75.90%),2018-FJT的最小(58.18%);低温1 d时,CT-2360的甲基化水平最高(77.98%),其他3个材料的较低;低温2 d时,MXW-1的甲基化水平最高(76.02%);而低温3、5 d处理时,4个材料的甲基化水平无显著差异。低浓度处理下,只有低温处理1 d时甲基化水平有显著差异,其中,MXW-1的甲基化水平最低(51.14%);高浓度处理下,CT-2360材料的甲基化水平在低温过程中表现出了不规律的变化模式。5-azaC与低温共同处理对降低DNA甲基化水平具有加成作用,比5-azaC单独处理或低温处理的作用更加显著。
3 讨 论
3.1 不同育成环境对参试材料抗寒性的影响
唐季林等[28]和王家源等[29]的研究发现苦楝苗木抗寒能力与纬度呈极显著正相关,与年均气温、无霜期呈极显著负相关,而与经度 、海拔和年降雨量不相关;韩宏伟等[30]在刺槐中研究发现各种源抗寒性与材料所在地纬度呈极显著正相关,与其年均温和年均降水量均呈显著负相关,表明抗寒性主要与所在地纬度相关。本试验研究结果表明白菜型冬油菜的抗寒性与其选育环境纬度、年平均气温呈极显著的正相关,与海拔和年最低气温呈极显著的负相关,和年降雨量没有显著的相关性,这与前人对其他植物的研究结果一致。表明育种环境尤其是低温环境对品种抗寒性的形成具有重要作用。
3.2 5-azaC处理对不同育种环境选育的材料低温下生理生化指标的影响
植物受到低温胁迫时,细胞膜系统快速发生变化,进而最大限度地去适应低温环境[31]。本研究结果表明,随着低温处理时间的延长,与对照相比,低温处理1 d后,参试材料苗期叶片REC开始明显增加、膜脂过氧化产物MDA含量明显增加,说明低温已经对细胞膜产生了伤害,但不同材料受到的低温伤害程度不一致,而50 μmol·L-1的5-azaC处理明显降低了低温对叶片细胞膜系统的伤害,并在一定程度上抑制了膜脂过氧化作用,对增强抗寒能力具有良好作用,这与在黄瓜幼苗上的研究结果是一致的[32]。非生物胁迫条件下,脯氨酸、可溶性蛋白等渗透调节物质显著积累,以调节细胞渗透压,增强植物适应逆境的能力[33-35]。李有芳等[20]研究发现5-azaC处理能显著提高盐胁迫下小麦叶片抗氧化酶SOD、POD、CAT活性,但受品种特性的影响;许会会等[18]发现5-azaC处理能提高热胁迫下白菜幼苗的抗氧化酶活性,本试验结果表明低温胁迫下Pro含量和SP含量均增加,且DNA去甲基化处理能够显著提高低温胁迫下Pro的含量,降低SP含量,与前人在其他植物上的研究是一致的[36]。
3.3 参试材料抗寒性与DNA甲基化水平
本研究发现甲基化抑制剂处理对增强抗寒性有积极作用,5-azaC处理通过造成DNA去甲基化参与白菜型冬油菜对低温胁迫的响应,提高其抗氧化酶的活性来缓解低温造成的影响;但不同抗寒性材料效果不同,DNA甲基化抑制剂处理有利于强抗寒性材料的脯氨酸含量积累,抗氧化物酶活性显著增加,提高抗寒性;抗寒性较弱材料的REC、MDA含量降低幅度最大,有效缓解膜脂损害程度,增强抗寒性。胡巍[37]在拟南芥上的研究表明DNA去甲基化处理增强了材料的低温耐受性,且低温胁迫和抑制剂处理产生的去甲基化作用都能够促进抗寒基因的表达。
研究表明,植物品种抗寒性表现在甲基化特征方面存在较大差异,DNA去甲基化处理能诱导改变参试材料的DNA甲基化水平,参与调节相关抗寒基因表达,进而影响其抗寒性;抗寒材料以去甲基化为主,而抗寒性较弱材料则以甲基化为主[2, 13]。从本试验结果可以明显看出,低温胁迫和抑制剂处理均能使参试材料发生去甲基化作用,随着低温时间的增加以及抑制剂浓度的增大,甲基化水平降低。这与杜丽丽[38]、宋峥等[39]以及朱芹芹[40]在其他植物上的研究结果一致。
4 结 论
本研究结果表明,不同低温环境选育的白菜型冬油菜抗寒性不同,半致死温度差异较大,其中吉林范家屯和山西大同选育的材料2018-FJT、DT-7半致死温度分别为-16.04℃、-15.98℃,抗寒性最强。通过5-azaC处理发现参试材料均发生去甲基化作用,能增强低温胁迫条件下的抗氧化能力,降低膜脂损害程度,增强参试材料对低温的适应能力;高纬度等环境条件育成材料在5-azaC处理后膜特性、抗氧化酶等生理特性较优;常温下抗寒性较弱材料CT-2360的甲基化水平要高于其他3个抗寒性强的材料;由此可见低温环境和DNA去甲基化对提高参试品种抗寒性具有重要作用。

