阿卡地新对冠心病大鼠AMPK/FOXO1信号通路及心功能损害的影响
王书飞,刘蕾,杜林翔,张培培,左艳芳,逯党辉
(1.河南省周口市中心医院心脏及内科重症监护室,周口 466000;2.河南省人民医院血管外科,郑州 450000)
冠心病(coronary heart disease,CHD)是一种常见的心脏病,在世界范围内具有很高的死亡率和致残性。CHD的基本病理生理过程是动脉粥样硬化(atherosclerosis,AS),容易形成斑块并阻塞血管,导致心肌缺血、缺氧或坏死[1]。炎症[2]、氧化应激[3]和血脂代谢异常[4]引起的AS是导致CHD发生、发展的重要原因,对其调控也成为临床治疗CHD的重要干预环节。目前,CHD的治疗方法主要包括冠状动脉介入治疗(percutaneous coronary intervention,PCI)和冠状动脉搭桥术(coronary artery bypass grafting,CABG),然而术后再狭窄和具有广泛病变的患者限制了其在CHD中的应用[5]。因此,迫切需要寻找一种非侵入性的方法来保护缺血性心肌。AMP活化蛋白激酶(adenosine monophosphate protein kinase,AMPK)在内皮细胞(endothelial cell,EC)、肝脏和大脑等多种组织广泛表达,研究发现在局部缺血或缺氧中,AMPK的激活可促进血管生成,抑制心肌细胞凋亡,保护心肌组织[6],但其机制尚未完全了解。阿卡地新是AMPK特异性激动剂[7],可促进AMPK磷酸化,改善心肌能量代谢,减轻体外循环术后心肌缺血再灌注损伤[8];激活AMPK通路可保护冠状动脉血管内皮细胞的正常功能,对大鼠CHD具有一定的治疗作用[9]。故推测阿卡地新作为AMPK特异性激动剂可能对CHD大鼠心功能具有保护作用,本研究通过构建CHD大鼠模型,探究阿卡地对CHD大鼠心功能损害的影响及其潜在的作用机制。
1 材料与方法
1.1 实验动物SPF级健康Sprauge-Dawley(SD)雄性大鼠72只,体重(210±10)g,购自济南朋悦动物繁育有限公司,生产证号为SCXK(鲁)20140007,动物饲养许可证:SYXK(豫),动物批号:20150005。所有动物均严格按照动物饲养规则喂养,温度为(24±2)℃,湿度为50%~60%,12 h明暗交替,自由饮水和摄食。
1.2 药品及试剂 阿卡地新(加拿大StressMarq,货号:SIH-402,纯度:≥98%);盐酸地尔硫卓注射液(山东方明药业集团股份有限公司,国药准字H20070254,10 mL:10 mg);垂体后叶素(南京新百药业有限公司,国药准字H32026638,1 mL:6单位);HE染色试剂、RIPA裂解液和BCA试剂盒(碧云天生物科技公司,批号分别为C0105、P0013B、P0012S);SMT100V便携式全自动动物生化分析仪(江苏南京普朗医疗设备有限公司);超高分辨率小动物彩色多普勒超声实时影像系统(Vevo 2100,加拿大VisualSonics公司);肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶MB(creatine kinase isoenzyme-MB,CK-MB)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)、低密度脂蛋白-胆固醇(low density lipoproteincholesterol,LDL-C)检测试剂盒(南京建成生物工程研究所,批号分别为A032-1、E006-11、A001-3、A003-1、A007-1、A113-1);肿瘤坏死因子-α(TNF-α)(RA20035)、白细胞介素-6(IL-6)(RA20607)ELISA检测试剂盒购自武汉贝茵莱生物科技有限公司;兔抗AMPK抗体(ab207442)、兔抗p-AMPK抗体(ab23875)、兔抗FOXO1抗体(ab179450)、兔抗p-F OXO1抗体(ab131339)、兔抗beta Actin抗体(ab8227)、羊抗兔IgG H&L(HRP)(ab205718),购自英国abcam公司;多功能酶标仪(iMark680,Bio-Rad公司)、荧光显微镜(日本Olympus公司)。
1.3 方法
1.3.1 大鼠分组与CHD模型的制备 采用随机数字表法将72只大鼠随机分为正常组、模型组、地尔硫卓组(1.0 mg/kg)[10]、阿卡地新高、中、低剂量组(2.0、1.0、0.5 mg/kg)[11],每组12只。除正常组外,其余各组大鼠参照文献[12-13]采用高脂饲料喂养+腹腔注射垂体后叶素建立CHD模型,给予高脂饲料喂养8周后腹腔注射垂体后叶素(30 μg/kg),1次/24 h,连续注射3次,构建CHD大鼠模型。正常组给予基础饲料喂养8周后连续3 d腹腔注射等量生理盐水。高脂饲料:基础饲料81.3%、猪油10%、蛋黄粉5%、胆固醇3%、胆酸钠0.5%、丙硫氧嘧啶0.2%。8周后采集大鼠尾静脉血,用自动生化分析仪检测TG、TC、LDL-C验证建模结果:结果显示模型大鼠TG、TC、LDL-C水平均显著升高,模型制备成功。
1.3.2 给药方法 地尔硫卓组、阿卡地新各剂量组在造模完成后,腹腔注射相应剂量的阿卡地新,正常组和模型组大鼠腹腔注射等量生理盐水,1次/d,连续注射14 d。
1.4 检测指标与方法
1.4.1 心功能检测 末次注射阿卡地新2 h后,戊巴比妥钠麻醉大鼠,采用超高分辨率小动物超声影像系统测量大鼠左心室收缩末期内径(left ventricular end-systolic diameter,LVESD)、左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、射血分数(ejection fraction,EF),短轴缩短率(fractional shortening,FS)。
1.4.2 心肌酶及炎性指标检测 心功能检测完成后,腹主动脉取血,静置后以3 000 r/min离心15 min,分离血清,检测血清中CK、CK-MB、TNF-α、IL-6水平,严格按照试剂盒说明书的步骤进行操作。
1.4.3 脂代谢指标检测 生化法检测血清TC、TG、LDL-C水平,溶液的配置及检测步骤严格按照试剂盒说明书进行。
1.4.4 氧化应激指标检测 取血后,取出大鼠完整心脏,于冰上用无菌手术刀片切分为3部分,一部分置于冻存管中,-80℃保存;一部分用4%多聚甲醛固定;另一部分按照1:9加入预冷的生理盐水研磨后,离心,取上清液,制备成10%的组织匀浆,生化法检测匀浆中MDA、SOD、CAT水平。
1.4.5 心肌组织HE染色 取4%多聚甲醛固定的心肌组织,乙醇梯度脱水,石蜡包埋,连续切3 μm薄片,二甲苯脱蜡,梯度乙醇脱苯1 min,蒸馏水冲洗。常规HE染色,光镜下观察心脏组织形态变化。
1.4.6 Western印迹法检测心肌组织中相关蛋白的表达 取-80℃冰箱保存的心肌组织,加入RIPA裂解液研磨后,置于冰上,静置后离心,提取上清液为总蛋白溶液。用BCA法测量蛋白浓度后取等量蛋白质样品(30 μg/孔)上样,SDS-PAGE凝胶电泳,湿转法转膜,5%脱脂奶粉封闭,加入相应一抗(AMPK、p-AMPK、FOXO1、p-FOXO1按照1∶1 000比例进行稀释,β-actin 1∶5 000按比例进行稀释)于4℃下孵育过夜,HRP标记的羊抗兔IgG二抗(1∶5 000)室温孵育1 h,ECL显色,以β-actin为内参,通过与内参的灰度比,得出目的条带的相对表达水平。
1.5 统计学处理 本研究所得数据均采用SPSS22.0软件进行统计,计量资料以±s表示,当符合正态分布和同质性时,两组间比较采用t检验,多组间比较采用单因素方差分析(One-way ANOVA)和Tukey事后检验,组间有差异进一步采用SNK-q检验;P<0.05为差异有统计学意义。
2 结果
2.1 阿卡地新对CHD大鼠心功能的影响 与正常组相比,模型组大鼠LVESD、LVEDD显著增大,EF、FS显著下降(均P<0.05);与模型组相比,地尔硫卓组。阿卡地新高、中剂量组大鼠LVESD、LVEDD明显下降,EF、FS明显升高(均P<0.05);与地尔硫卓组相比,阿卡地新高剂量组LVESD、LVEDD、EF、FS差异均无统计学意义(均P>0.05),见表1。
表1 阿卡地新对CHD大鼠心功能的影响(±s)Tab 1 Effect of Acadixin on cardiac function in CHD rats(±s)

表1 阿卡地新对CHD大鼠心功能的影响(±s)Tab 1 Effect of Acadixin on cardiac function in CHD rats(±s)
注:CHD:冠心病;LVESD:左心室收缩末期内径;LVEDD:左心室舒张末期内径;EF:射血分数;FS:短轴缩短率;与正常组相比,aP<0.05;与模型组相比,bP<0.05;与地尔硫卓组相比,cP<0.05
?
2.2 阿卡地新对CHD大鼠血清心肌酶及炎性相关因子的影响 与正常组相比,模型组大鼠血清CK、CK-MB、TNF-α、IL-6水平显著升高(均P<0.05);与模型组相比,地尔硫卓组、阿卡地新高、中、低剂量组大鼠血清CK、CK-MB、TNF-α、IL-6水平明显下降(均P<0.05);与地尔硫卓组相比,阿卡地新高剂量组CK、CK-MB、TNF-α、IL-6水平差异无统计学意义(均P>0.05),见表2。
表2 阿卡地新对CHD大鼠心肌酶及炎性相关因子的影响(±s)Tab 2 Effect of Acadixin on myocardial enzymes and inflammatory related factors in CHD rats(±s)
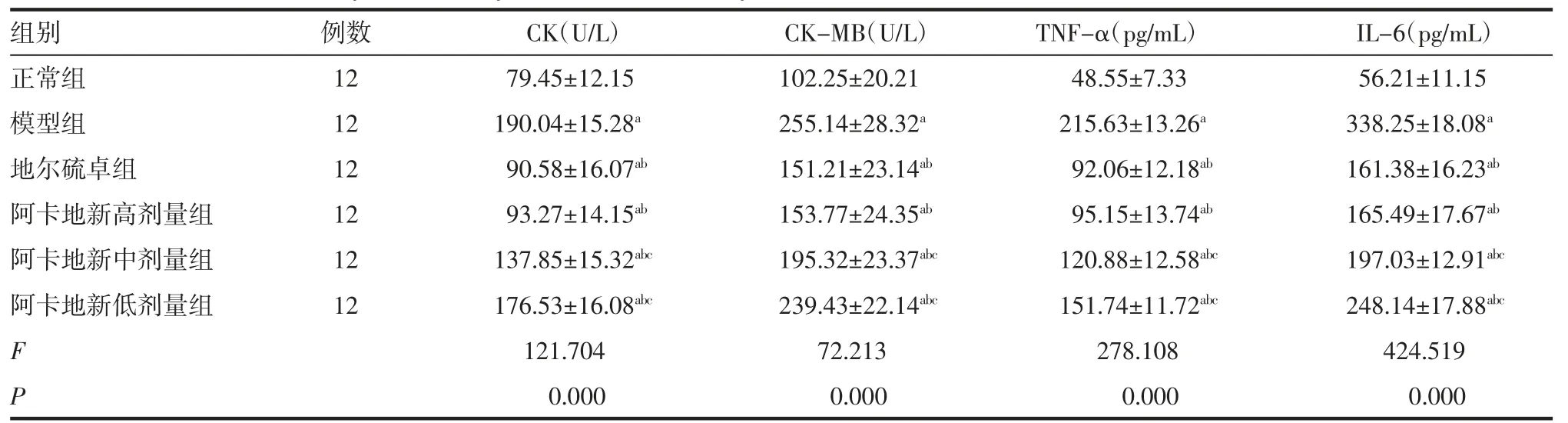
表2 阿卡地新对CHD大鼠心肌酶及炎性相关因子的影响(±s)Tab 2 Effect of Acadixin on myocardial enzymes and inflammatory related factors in CHD rats(±s)
注:CHD:冠心病;CK:肌酸激酶;CK-MB:肌酸激酶同工酶-MB;TNF-α:肿瘤坏死因子-α;IL-6:白细胞介素-6;与正常组相比,aP<0.05;与模型组相比,bP<0.05;与地尔硫卓组相比,cP<0.05
?
2.3 阿卡地新对CHD大鼠脂代谢相关指标的影响 与正常组相比,模型组大鼠血清TC、TG、LDL-C水平显著升高(均P<0.05);与模型组相比,地尔硫卓组和阿卡地新高、中剂量组大鼠血清TC、TG、LDL-C水平明显下降(均P<0.05);与地尔硫卓组相比,阿卡地新高剂量组TC、TG、LDL-C水平差异均无统计学意义(均P>0.05),见表3。
表3 阿卡地新对CHD大鼠脂代谢相关指标的影响(±s)Tab 3 Effect of Acadixin on related indexes of lipid metabolism in CHD rats(±s)

表3 阿卡地新对CHD大鼠脂代谢相关指标的影响(±s)Tab 3 Effect of Acadixin on related indexes of lipid metabolism in CHD rats(±s)
注:CHD:冠心病;TG:甘油三酯;TC:总胆固醇;LDL-C:低密度脂蛋白-胆固醇;与正常组相比,aP<0.05;与模型组相比,bP<0.05;与地尔硫卓组相比,cP<0.05
?
2.4 阿卡地新对CHD大鼠心肌组织氧化应激指标的影响 与正常组相比,模型组大鼠心肌组织SOD、CAT水平显著降低,MDA水平显著升高(均P<0.05);与模型组相比,地尔硫卓组和阿卡地新高、中、低剂量组大鼠心肌组织SOD、CAT水平明显升高,MDA水平明显降低(均P<0.05);与地尔硫卓组相比,阿卡地新高剂量组SOD、CAT、MDA水平差异无统计学意义(均P>0.05),见表4。
表4 阿卡地新对CHD大鼠心肌组织氧化应激指标的影响(±s)Tab 4 Effect of Acadixin on oxidative stress index of myocardial tissue in CHD rats(±s)

表4 阿卡地新对CHD大鼠心肌组织氧化应激指标的影响(±s)Tab 4 Effect of Acadixin on oxidative stress index of myocardial tissue in CHD rats(±s)
注:CHD:冠心病;SOD:超氧化物歧化酶;MDA:丙二醛;CAT:过氧化氢酶;与正常组相比,aP<0.05;与模型组相比,bP<0.05;与地尔硫卓组相比,cP<0.05
?
2.5 阿卡地新对CHD大鼠心肌组织形态学变化的影响HE染色结果显示,正常组大鼠的心肌细胞排列整齐、心肌纤维结构完整清晰,染色均匀,未见心肌细胞水肿、坏死;模型组大鼠心肌组织染色不均,局部肌纤维横纹消失,心肌细胞形态不规则,排列紊乱,可见水肿变性,并伴有大量炎性细胞浸润;与模型组相比,地尔硫卓组和阿卡地新高、中剂量组大鼠心肌细胞水肿减轻,心肌纤维排列较为整齐,纤维断裂减少,少量炎性细胞浸润,见图1。

图1 大鼠心肌组织形态学改变(HE染色,200×)Fig 1 Morphological changes of myocardial tissue in rats(HE staining,200×)
2.6 阿卡地新对CHD大鼠心肌组织中p-AMPK/AMPK、p-FOXO1/FOXO1表达的影响Western印迹结果显示,与正常组相比,模型组大鼠心肌组织p-AMPK/AMPK、FOXO1蛋白表达显著降低,p-FOXO1蛋白表达显著升高(均P<0.05);与模型组相比,地尔硫卓组和阿卡地新高、中剂量组大鼠心肌组织p-AMPK/AMPK、FOXO1蛋白表达明显增加,p-FOXO1蛋白表达明显降低(均P<0.05);与地尔硫卓组相比,阿卡地新高剂量组p-AMPK/AMPK、FOXO1、p-FOXO1蛋白表达差异无统计学意义(均P>0.05),见图2。
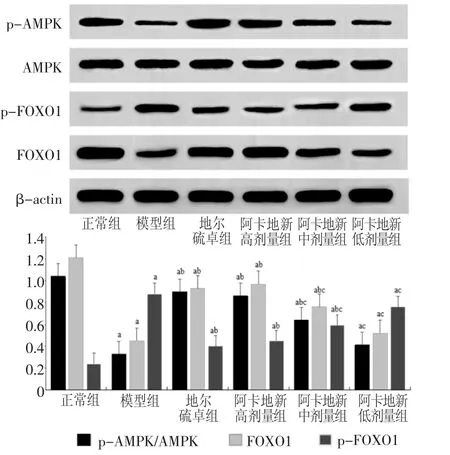
图2 阿卡地新对CHD大鼠心肌组织AMPK、FOXO1蛋白表达的影响Fig 2 The effect of acarbose on the expression of AMPK and FOXO1 protein in myocardium of CHD rats
3 讨论
炎症、氧化应激反应和血脂代谢异常在CHD的发生、发展中发挥至关重要的作用[14]。当心肌缺血时,机体代谢产物不能被及时清除,在体内大量堆积产生毒性作用,诱发心肌发生病变,导致心泵功能减退,血液流变学发生异常,引起血脂代谢异常;同时心肌缺血后会激活氧化应激反应,产生大量的活性氧簇(reactive oxygen species,ROS),生成和释放大量炎性因子(如TNF-α、IL-6),促进CHD的发生、发展。高脂饮食被认为是诱发脂代谢紊乱并导致CHD的必不可少的因素[12]。因此,本研究采用高脂饲料喂养联合腹腔注射垂体后叶素构建CHD大鼠模型,结果发现模型大鼠LVESD、LVEDD显著升高,EF、FS显著下降,提示CHD大鼠心腔扩大,心脏泵血量显著降低,不能满足机体的需要,心脏泵血功能衰竭;CHD大鼠血清CKMB、CK水平显著升高,HE染色结果也显示,心肌组织染色不均,局部肌纤维横纹消失,心肌细胞排列紊乱,并伴有大量炎性细胞浸润;说明CHD大鼠出现严重的心肌损伤;同时血清炎症和脂代谢相关指标水平显著升高,且心肌抗氧化指标(SOD、CAT)水平的显著降低,MDA水平的升高;提示CHD大鼠出现血脂代谢异常、炎症和氧化应激反应。
阿卡地新是一种腺苷类似物,能够模拟AMP功能,特异性激活AMPK。AMPK是一种位于真核生物细胞中广泛表达且高度保守的丝氨酸/苏氨酸蛋白激酶,对炎症和氧化应激具有重要调节作用[15];提高AMPK活性,可降低ROS水平,增加SOD生成,增强机体抗氧化能力[16]。而且AMPK通路可调控脂类代谢,研究发现脂联素可通过激活AMPK通路,抑制脂肪酸合成,增加血脂中脂肪酸的氧化,降低血脂水平,调节脂代谢紊乱,预防冠状动脉粥样硬化发生和发展[17]。阿卡地新能降低心肌细胞中ROS、脑钠肽(brain natriuretic peptide,BNP)水平,调节心肌梗死后心肌功能[18]。本研究结果发现,给予阿卡地新干预后,大鼠LVESD、LVEDD明显降低,EF、FS明显升高,提示CHD模型大鼠心脏泵血功能明显改善;血清CKMB、CK水平明显降低,心肌损伤减轻,同时血清炎症因子(TNF-α、IL-6)、脂代谢相关指标(TC、TG、LDL-C)水平明显降低,心肌组织SOD、CAT水平明显升高,说明阿卡地新可抑制CHD模型大鼠的炎症和氧化应激反应,改善血脂代谢异常。
FOXO1是Fox家族成员之一,大量证据表明FOXO1是心脏代谢调节和维持心脏功能的重要因素,AMPK/FOXO1信号通路的激活具有心脏保护作用。FOXO1主要分布在细胞质中,但FOXO1的核定位是该基因调节功能的前提。在磷酸化状态,FOXO1被排除在细胞核之外,并以泛素依赖性方式在细胞质中降解。而AMPK激活后可直接阻止FOXO1的磷酸化,触发FOXO1蛋白从细胞质到细胞核的重新定位,并使FOXO1活性增加,降低细胞中活性氧的水平[19];还可以增加脂肪酸β氧化,增强脂肪细胞的脂解作用,降低肌管中的脂质蓄积[15]。绞股蓝皂甙A可通过激活AMPK/FOXO1途径,保护心肌缺血/再灌注损伤[20]。作为AMPK的特异性激活剂,阿卡地新对CHD大鼠的保护机制是否与FOXO1有关?本研究采用Western印迹法检测了AMPK、FOXO1及其磷酸化蛋白的表达,结果显示阿卡地新可明显增加心肌组织p-AMPK/AMPK、FOXO1蛋白的表达,降低p-FOXO1蛋白表达;提示阿卡地新对CHD大鼠的心功能的保护作用,可能与激活AMPK/FOXO1信号通路有关。
综上所述,阿卡地新可抑制CHD大鼠的炎症和氧化应激反应,改善血脂代谢异常,保护心功能;其作用机制可能与激活AMPK/FOXO1信号通路有关。本研究为CHD的治疗和阿卡地新的临床应用提供了理论与实验参考,但尚存在一定不足,未设置通路抑制剂组进行验证,此外,由于条件限制,本研究只在动物水平进行了验证,下一步可从细胞水平上进行探讨。

