不同属性特征基质对早稻秧苗耐低温的影响
朱春权 徐青山 曹小闯 朱练峰 孔亚丽 金千瑜 张均华
不同属性特征基质对早稻秧苗耐低温的影响
朱春权#徐青山#曹小闯 朱练峰 孔亚丽 金千瑜 张均华*
(中国水稻研究所 水稻生物学国家重点实验室,杭州 310006;#共同第一作者;*通信联系人,E-mail: zhangjunhua@caas.cn)
【目的】早稻育秧过程中易遭受低温冷害,引起水稻减产。因此,有必要研究不同类型的基质对早稻秧苗耐低温的影响。【方法】以水稻田自然表层土为对照,采用两种代表性基质(无土基质和发酵基质)培育早稻秧苗,在水稻出芽6 d后进行不同低温处理,3 d后测定水稻的基本理化性质指标和基因表达,明确不同基质对早稻秧苗耐低温胁迫的调节作用。【结果】1)无土基质和发酵基质容重均显著低于对照,电导率、通气孔隙、碱解氮、速效磷、速效钾和有机质含量显著高于对照;发酵基质育成的秧苗其根长、百株地上部干质量和百株根部干质量均显著高于对照,无土基质和发酵基质育成的秧苗根系和地上部的氮、磷、钾养分含量显著高于对照。2)随着温度的降低,水稻秧苗的生长和养分吸收均受到抑制。低温对发酵基质上生长的秧苗抑制作用较弱,无土基质次之,对照受抑制较强。3)在低温条件下(白天8℃/晚上4℃),无土基质和发酵基质中育成的秧苗丙二醛含量显著低于对照,说明在寒冷条件下的细胞氧化损伤较少。其中,无土基质和发酵基质育成的秧苗超氧化物歧化酶、过氧化氢酶活性,脯氨酸含量和可溶性蛋白含量均高于对照,发酵基质育成的秧苗过氧化物酶活性高于对照,无土基质育成的秧苗谷胱甘肽转移酶活性高于对照。同时,无土基质和发酵基质育成的秧苗、、和四个基因表达水平均显著高于对照,提高了水稻耐低温能力。【结论】以上结果表明,无土基质和发酵基质通过调控水稻秧苗的生理生化反应和相关基因表达,提高秧苗耐低温胁迫能力。
基质;水稻;低温胁迫;理化性质;抗氧化酶;基因表达
水稻在粮食生产中占有重要地位,是全世界主要粮食作物之一[1]。在温带和高海拔地区,低温胁迫是水稻生产中的重要障碍因素。据统计,全世界每年约有0.15亿hm2的水稻生产遭受低温胁迫,因低温冷害引起的稻谷损失约在30亿~50亿kg[2]。在旱育苗床上,持续低温阴雨导致的立枯死苗,特别是双季早稻旱育秧死苗已成为育秧过程中的一种毁灭性病害[3]。我国每年约有478.7万hm2早稻[4],如何有效减轻低温胁迫对早稻生产的影响,尤其是育秧阶段对秧苗的损伤,对提高早稻产量至关重要。
早稻生产中秧苗的耐冷性直接影响水稻成苗和稻谷产量。提高水稻苗期的耐低温胁迫能力不仅提高水稻的成苗率,还进一步提高水稻分蘖期和孕穗期的耐低温胁迫能力,从而最终稳定稻谷产量[5]。水稻在苗期遭受低温胁迫后,根、茎、叶的生长显著受抑,分蘖数降低,分蘖时间和抽穗时间延迟,而通过外源调控,比如添加外源钙以后,可以显著提高水稻苗期耐低温胁迫能力,从而使遭受低温胁迫的水稻秧苗生育期恢复正常,穗抽出度良好,最终提高冷害胁迫后水稻的产量[5-6]。水稻植株内多种激素和信号分子参与抵抗低温胁迫,比如ABA和油菜素内酯。外源喷施ABA显著提高水稻幼苗在低温胁迫下的生物量和根系活力[7],外源喷施2,4-表油菜素内酯显著提高水稻种子在低温条件下的萌发率,降低水稻根系的氧化损伤[8]。水稻耐低温胁迫受遗传控制,但是属于多基因还是单基因控制还未有定论。目前已发现37个与水稻耐冷相关的QTL和21个涉及水稻耐冷的基因[9]。比如过表达()基因显著提高水稻脯氨酸含量和水稻的耐冷胁迫能力[10]。
不同属性的基质显著影响水稻秧苗的生长。比如,不同生物炭和秸秆含量的基质培养的水稻秧苗茎粗、根长、植株干质量等存在显著差异,合适的配比下(40%秸秆+20%生物炭)水稻秧苗综合素质最好[11]。添加淀粉芽孢杆菌的基质中生长的水稻秧苗素质显著高于添加其余根际促生菌的基质[12]。用不同基质培养的秧苗移入大田测产后发现,不同基质培育的水稻秧苗产量存在显著差异,分别为草炭土>淤泥>营养土[13]。随着水稻全程机械化发展,水稻机械化育插秧已成为我国水稻现代农艺生产一个重要环节[14-15]。设计生产用土少,甚至不用土的水稻育秧基质成为当前机插育秧中的热点[16]。前人虽然已经研究了不同基质配比对寒地水稻秧苗素质的影响[17],但是并未研究不同的基质配比对南方早稻秧苗耐低温冷害的调节作用。本研究拟以自主设计的两款育秧基质作为实验对象,以水稻田表层土作为对照,研究不同属性的基质对秧苗耐低温能力的影响,从而解决早稻机插育秧过程中倒春寒等低温胁迫对秧苗造成的伤害,最终提高早稻产量。
1 材料与方法
1.1 试验设计
供试材料“中早39”为籼型常规水稻品种,由中国水稻研究所育成。该品种于长江中下游作双季早稻种植,全生育期112.2 d。
本研究所用秧盘为7寸秧盘,育秧基质分别为自己研制的无土基质、发酵基质和稻田土。其中无土基质以农作物秸秆为主要原料,添加不同比例的生物质材料、营养元素、保水剂、促根剂等制成。发酵基质以水洗草炭为原料,利用微生物发酵以后,添加不同的生物质材料、营养元素、保水剂和促根剂等制成。水稻土取浙江杭州富阳中国水稻研究所试验田表层0―20 cm土壤风干研磨,过5 mm筛后使用。将水稻种子催芽至露白后,每个秧盘播种90 g谷芽,2020年4月30日播种后在中国水稻研究所温室大棚中正常培养,发芽率无土基质为65.57%,发酵基质为69.87%,水稻土为60.25%。5月6日在培养箱中进行不同温度处理,至5月9日取苗测定不同指标。试验设4个生物学重复,每个处理重复3次。不同温度试验设计见表1。
1.2 基质理化性质测定
育秧基质pH值采用梅特勒SG8便携式pH计测定;基质的电导率采用雷磁电导率仪测定;基质含水量、容重、总孔隙度、通气孔隙、持水孔隙、有机质、全氮、速效氮、速效磷和速效钾含量均参照常规方法测定[18-19]。
1.3 秧苗素质和养分含量测定
处理后第3天(5月9日)选择代表性秧苗4盘,每盘取代表性秧苗20株,测定秧苗叶龄、株高、根长、根数、茎基宽(距秧苗生根处1 cm),每盘另取100株秧测定百株地上部干质量、百株根质量[20]。
处理后第3天选择代表性秧苗4盘,分别收集水稻地上部鲜样,用液氮研磨后保存至−80℃冰箱,用于后续测定水稻生理指标。同时取水稻地上部和根部,烘干至恒重后研磨,利用浓硫酸和过氧化氢消煮后测定总氮、总磷和总钾含量[19]。
1.4 水稻生理指标的测定
可溶性蛋白含量的测定采用BCA法[21];脯氨酸含量的测定采用茚三酮法[22];MDA含量的测定采用硫代巴比妥酸法[23];SOD酶活的测定采用氮蓝四唑(NBT)光化还原法[24];CAT酶活根据单位时间内H2O2的消耗进行测定[25];POD酶活采用愈创木酚法进行测定[26];谷胱甘肽S-转移酶根据单位时间内还原型谷胱甘肽的减少量进行测定[27]。
1.5 水稻耐冷基因表达测定
将水稻根系吸干水分后剪下,立即在液氮中研磨。利用TRizol法提取总RNA。在NanoDrop上测定RNA的含量,用琼脂糖凝胶电泳法检测RNA的完整性。运用PrimeScript反转录试剂盒将RNA反转成cDNA并用Sybgreen(TaKaRa,日本)进行实时荧光定量PCR。文中目的基因和内参基因的引物序列见参考文献[10, 28-29]。
1.6 统计学分析
试验数据采用SPSS 21.0.0软件进行统计分析(单因素方差分析),均数采用图基(Tukey)检验统计学差异。图表中不同字母表示处理间均值在< 0.05水平上有统计学差异。
2 结果与分析
2.1 基质理化性质
基质的速效养分含量决定了其对秧苗养分的供应能力,影响秧苗生长速率。本研究中,无土基质和发酵基质的速效养分含量均显著高于对照,其中无土基质的碱解氮、速效磷和速效钾含量分别高于对照1144.63%、72.78%和280.20%,发酵基质的碱解氮、速效磷和速效钾含量分别比对照高440.39%、629.66%和718.86%。无土基质和发酵基质的总氮和有机质含量,发酵基质的总磷含量均显著高于对照(表2)。
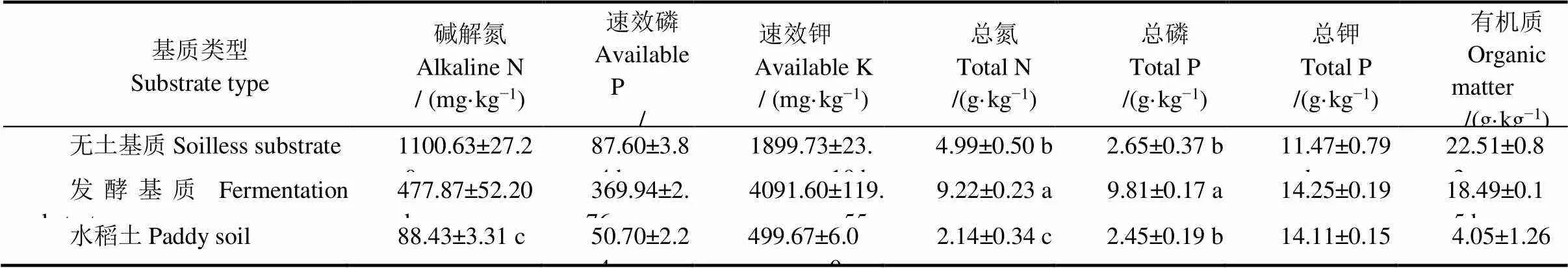
表2 育秧基质养分含量
基质的理化性质同样决定水稻秧苗的长势。本研究中的两种基质和对照的pH值都小于7.0,适宜水稻正常生长。电导率在一定范围内体现了基质中养分含量。在本研究中,无土基质的电导率为3.57 mS/cm,显著高于发酵基质的2.50 mS/cm和对照的0.13 mS/cm。容重代表一定体积的基质的质量,本研究中无土基质的容重从小到大依次为无土基质(0.29 g/cm3)、发酵基质(0.61 g/cm3)和对照(0.92 g/cm3)。通气孔隙代表基质中的通气程度,本研究中发酵基质的通气孔隙度最大(23.70%),无土基质次之(7.33%),对照最小(6.13%)(表3)。
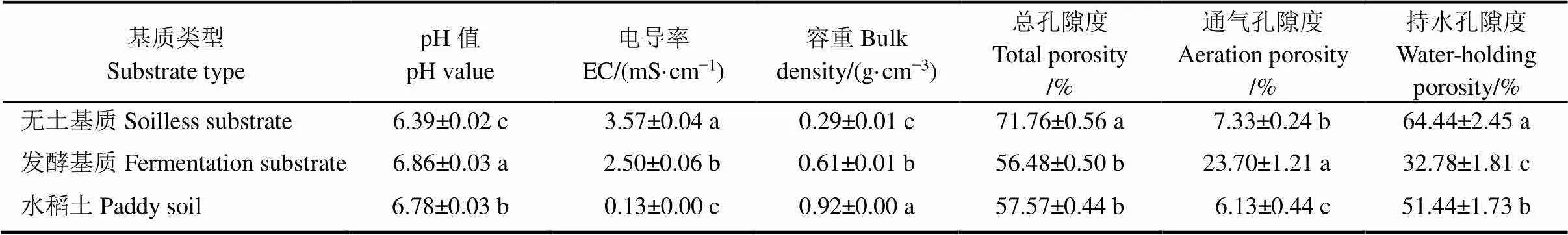
表3 育秧基质理化性质
2.2 秧苗生长和养分含量
在不同温度处理3 d后,水稻的株高、根长、干物质量以及茎基宽等指标展现了不同的变化趋势(表4)。在正常温度下(白天18℃/晚上10℃),无土基质培育的水稻秧苗株高显著高于发酵基质和对照,分别高出5.82%和8.01%。发酵基质培育的水稻秧苗根长分别较无土基质和对照高54.67%与42.43%。无土基质上生长的水稻百株地上部干质量比发酵基质和对照分别高15.56%和31.65%;发酵基质培育的水稻秧苗,百株根系干质量比无土基质和对照分别高52.38%和18.52%。在本研究中,无土基质和发酵基质培育的秧苗与对照的茎基宽无显著差异(表4)。
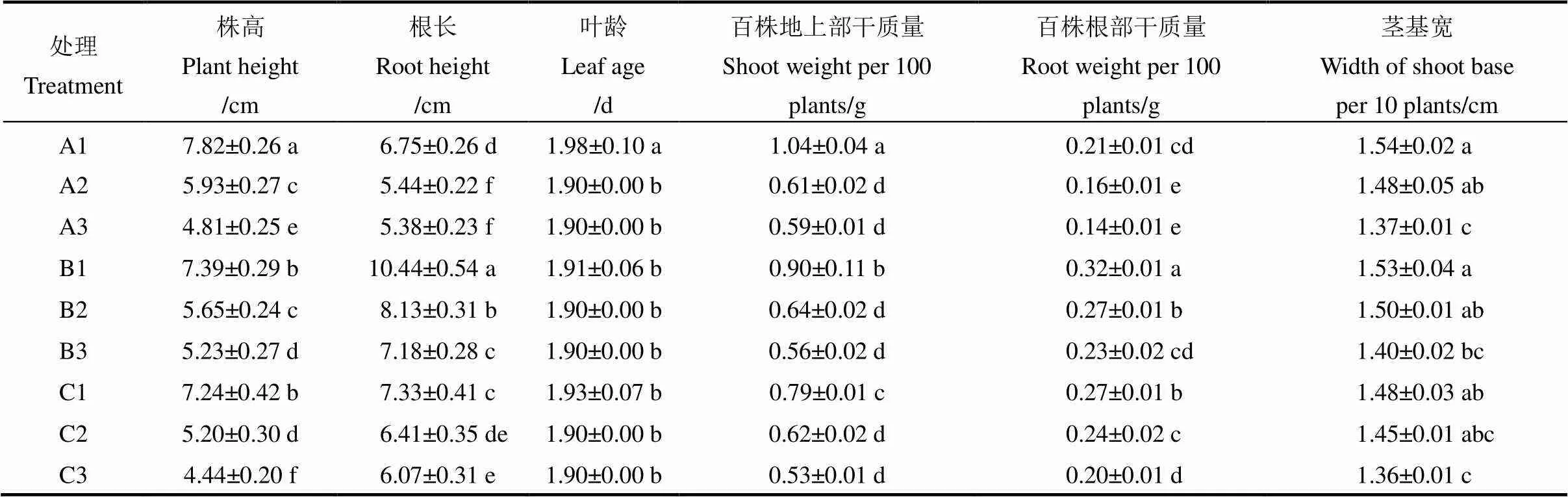
表4 不同温度处理对水稻根系和地上部生长特征的影响
处理代号与表1相同。
Treatment symbols are listed in Table 1.
随着培养温度降低,水稻秧苗除叶龄指标外,其余各指标值均显著下降。在较低温处理(白天13℃/晚上7℃)下,发酵基质培育的水稻秧苗株高、根长、百株地上部干质量、百株根部干质量和茎基宽均显著高于对照,分别高出8.65%、26.83%、3.22%、12.50%以及3.45%。在最低温处理下(白天8℃/晚上4℃),发酵基质下生长的水稻株高、根长、百株地上部干质量、百株根部干质量和茎基宽分别高于对照17.79%、18.29%、5.66%、15.00%以及2.94%。无土基质的地上部表现较好,株高和地上部百株质量在最低温条件下(白天8℃/晚上4℃)分别高于对照8.33%和11.32%,然而根系长度却低于对照(表4)。
水稻秧苗养分含量测定结果表明,在正常温度条件(白天18℃/晚上10℃)下,水稻地上部和根系的氮、磷、钾含量与基质中的速效养分含量呈显著正相关(表6)。其中,无土基质培养的水稻秧苗地上部和根系的氮含量最高(分别为47.93 g/kg和30.56 g/kg),发酵基质次之(分别为34.60 g/kg和16.89 g/kg),对照最低(分别为29.09 g/kg和14.69 g/kg)。发酵基质培育的水稻秧苗地上部和根系的磷含量显著高于无土基质和对照,分别高于无土基质5.63%和17.84%,高于对照21.85%和45.20%。发酵基质培育的秧苗地上部和根系的钾含量同样显著高于无土基质和对照,分别高于无土基质36.51%和44.90%,高于对照31.46%和76.20%(表5)。
不同类型基质培育的水稻秧苗,其植株氮、磷、钾养分含量均随着温度的下降而下降,当培养温度从白天18℃/晚上10℃下降至白天8℃/晚上4℃后,养分含量均呈现显著下降趋势(对照组的根系磷含量除外)。但是不同类型基质之间水稻秧苗的氮、磷、钾含量总体趋势与常温条件下没有差异,仍然是无土基质处理组水稻氮含量最高,发酵基质处理组的水稻磷和钾含量最高(表5)。

表5 不同温度处理后水稻植株养分含量
2.3 秧苗抗氧化酶活性和渗透调节物质含量
脯氨酸参与植物渗透调节,与植物抗逆相关。本研究中随着温度的降低,水稻秧苗脯氨酸含量显著上升,在最低处理温度(白天8℃/晚上4℃)下水稻的脯氨酸含量达到最高值。相比正常温度(白天18℃/晚上10℃)下的脯氨酸含量,在最低处理温度(白天8℃/晚上4℃)下无土基质和发酵基质处理组的水稻秧苗体内脯氨酸含量分别增加了214.28%和280.65%,显著高于对照处理组的增加量78.43%。同时,编码参与脯氨酸的合成酶的基因表达量与脯氨酸含量表现出类似的趋势,在最低处理温度(白天8℃/晚上4℃)下,无土基质和发酵基质培育的水稻秧苗的基因表达量分别增加了4.62和11.36倍,显著高于对照处理组的2.20倍(图1~2)。
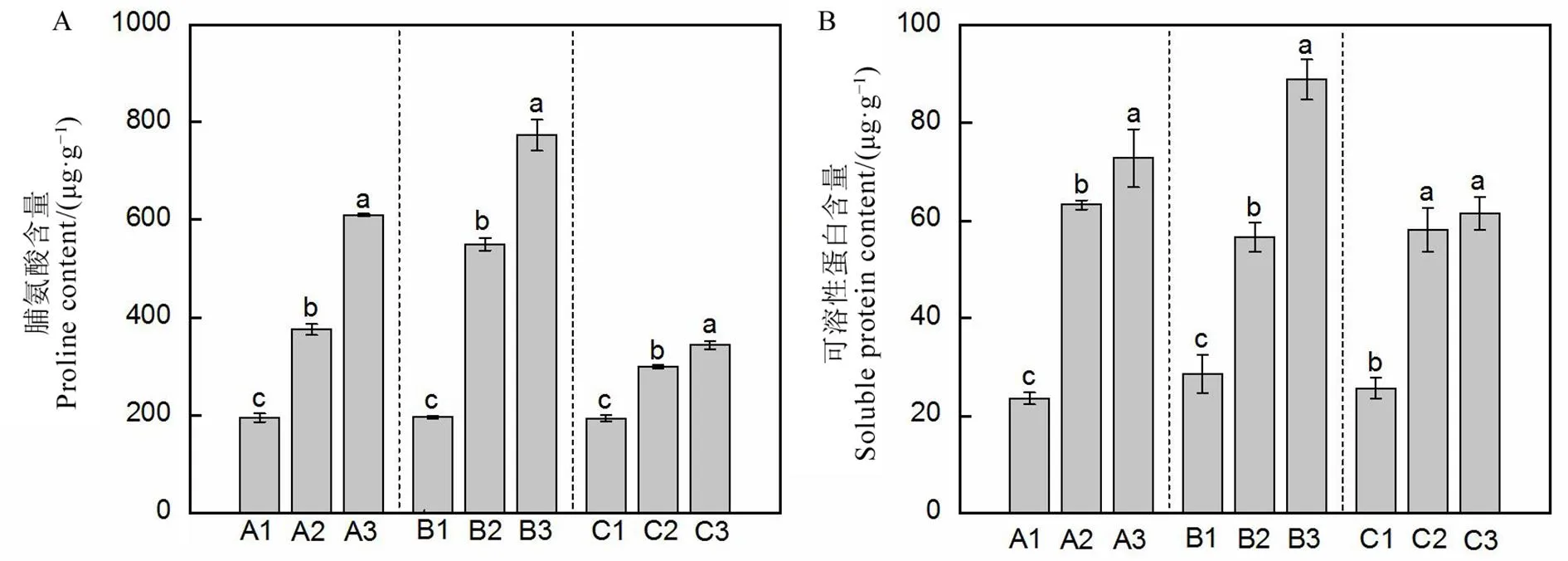
柱上不同字母表示处理间在P<0.05水平上差异显著。
Fig.1.Proline content (A) and soluble protein contents (B) in rice under different temperature treatments.

表6 基质速效养分与水稻植株内养分含量的相关性分析
**表示在0.01水平具有显著性意义。
**Significantly correlated at 0.01 level.
可溶性蛋白含量同样与植物抵抗低温胁迫密切相关。相较于正常温度(白天18℃/晚上10℃),在最低处理温度(白天8℃/晚上4℃)下无土基质和发酵基质处理组水稻植株内的可溶性蛋白含量分别增加了210.09%和211.77%,显著高于对照处理组的增幅(140.96%)(图1)。
在低温胁迫下,水稻植株内的抗氧化酶活性发生变化,帮助植物清除因低温胁迫产生的过氧化物。本研究下,相较于正常温度条件(白天18℃/晚上10℃),最低温胁迫(白天8℃/晚上4℃)时无土基质和发酵基质处理组水稻秧苗的超氧化物歧化酶活性分别增加了8.80%和11.11%,显著高于对照处理组(3.06%)(表7)。同时,研究超氧化物歧化酶基因的表达展示出相同的规律。无土基质和发酵基质培育的水稻秧苗,低温胁迫(白天8℃/晚上4℃)下基因表达量分别增加了16.76和22.45倍,显著高于对照处理组(4.04倍)(图2)。实验结果显示,相较于正常温度条件(白天18℃/晚上10℃),低温胁迫(白天8℃/晚上4℃)下无土基质和发酵基质处理组水稻秧苗体内的过氧化氢酶活性分别增加了521.01%和529.73%,显著高于对照处理组的284.86%(表7)。本研究中,在最低温度胁迫下,无土基质、发酵基质和对照处理组水稻植株内的过氧化物酶活性均显著增加,分别增加了80.93%,93.43%和99.17%(表7)。本研究发现,低温胁迫可在一定程度上提高水稻体内GST酶的活性,特别是发酵基质处理组的水稻秧苗在最低温(白天8℃/晚上4℃)胁迫时,GST活性从1020.68 nmol/(g·min)提高到了1404.21 nmol/(g·min) (表7)。低温胁迫下(白天8℃/晚上4℃),无土基质和发酵基质处理组的水稻秧苗丙二醛含量分别增加了21.50%和9.87%,显著低于对照处理组(37.25%)(表7)。
2.4 秧苗耐冷基因表达
植物体内已经鉴定到多个与植物耐冷胁迫相关的基因,其中包括和基因。本研究结果显示,在最低温胁迫时(白天8℃/晚上4℃),无土基质和发酵基质处理组水稻秧苗的基因的表达量分别增加了2.79倍和3.09倍,高于对照处理组水稻秧苗的增幅(2.49倍)。耐冷基因的表达量在最低温(白天8℃/晚上4℃)胁迫时表现出同样的变化规律,其中发酵基质处理组的增加倍数最高,为94.58倍,无土基质处理组次之,为2.78倍,对照处理组的基因表达变化最小,为2.05倍(图2)。

图2 不同温度处理后水稻耐冷基因表达水平
Fig.2.Expression levels of chilling tolerance genes in rice under different temperature treatments.
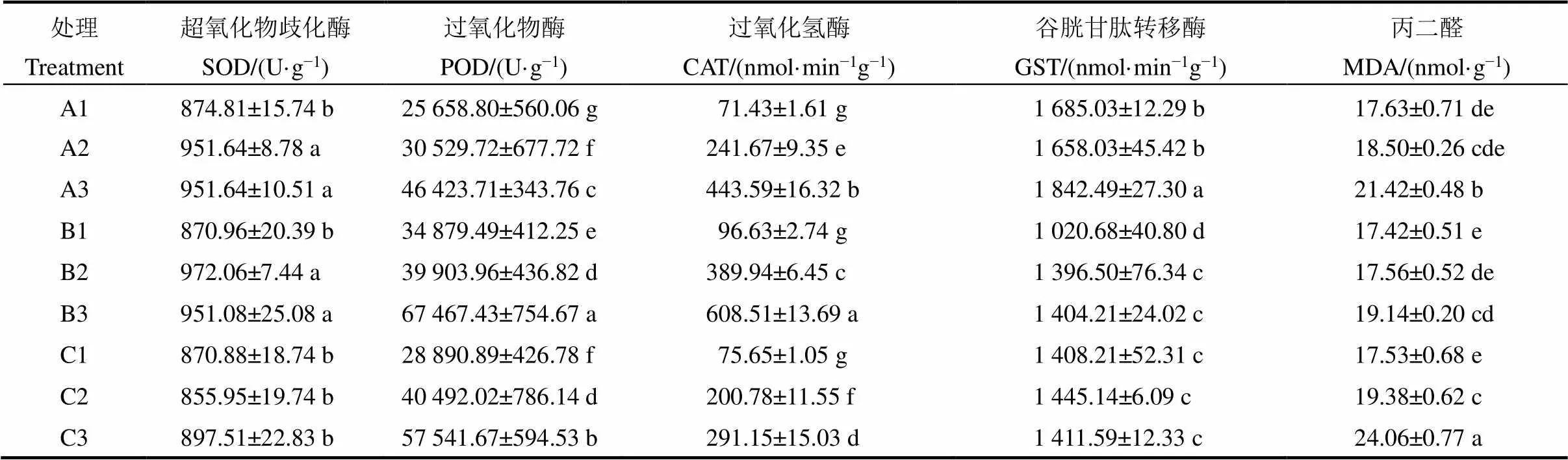
表7 不同温度处理后水稻体内抗氧化酶活性
3 讨论
3.1 基质类型对秧苗素质的影响
水稻育秧基质的物理化学性质与秧苗生长密切相关,比如适宜水稻秧苗生长的最适pH为弱酸性;基质的电导率反映其养分供应潜力并且适宜范围为0.75~3.00 mS/cm[30];水稻育秧基质的合理容重为0.1~0.8 mg/L,在此容重区间既能固定水稻根系又适宜于长途运输[31];基质的总孔隙度中,空气占比25%~40%、水分占比60%~75%对秧苗根系生长较好[31-32]。在本研究中,两种基质的酸碱度均小于7.0,符合水稻生长的最适条件。无土基质和发酵基质的容重均处于最适范围,而对照的容重超出最适范围,不方便运输(表2)。无土基质的总孔隙度处于理想的范围(70%~90%),发酵基质的通气孔隙度优于无土基质和对照,利于根系氧气吸收(表2)。此外,良好的基质还应有合适的养分供应能力。其中,速效氮含量需大于100 mg/kg才能保证秧苗的正常生长。本研究中,无土基质和发酵基质碱解氮的含量显著高于100 mg/kg,对照的碱解氮含量显著低于100 mg/kg,限制了水稻秧苗的正常生长(表3和表4)。同时,无土基质和发酵基质中的速效磷和速效钾含量显著高于对照,从而保证水稻在正常温度条件下的生长(表3和表4)。
水稻不耐低温,低温冷害显著抑制水稻的生长和发育[33-36]。在本研究中,随着培养温度的降低,不同类型基质培育的水稻秧苗生长受到显著抑制(表4),其中,株高、根长、地上部和根部干物质量以及茎基宽均显著下降,但是不同基质培育的水稻秧苗,受低温的抑制作用不尽相同(表4)。在最低温处理(白天8℃/晚上4℃)下,发酵基质培育的水稻秧苗表现最优,其次是无土基质,对照表现最差(表4)。说明不同基质类型显著影响水稻秧苗耐低温能力。
3.2 养分对秧苗抵抗低温胁迫的影响
培养基质中养分含量的差异与水稻耐低温胁迫能力相关,比如外源施加磷肥,可以显著提高低温条件下水稻幼苗的光合速率,最终提高其耐低温能力[37]。本研究中不同基质上秧苗的氮、磷、钾含量存在显著差异(表5),并且与培养基质中的速效养分含量呈显著正相关(表6),说明基质中原始速效养分含量越高越有利于水稻对其的吸收。虽然低温胁迫显著降低水稻对养分的吸收,但发酵基质和无土基质培育的秧苗其体内养分含量仍然大于对照(表5)。在不同温度条件下,发酵基质培育的水稻秧苗其根系和地上部的磷含量显著高于无土基质,并进一步高于对照(表5),水稻磷含量的差异与秧苗长势表现一致,进一步验证了磷对秧苗抵抗低温胁迫的作用。
3.3 渗透调节物质对秧苗抵抗低温胁迫的影响
可溶性蛋白的含量与水稻的抗寒性呈显著正相关,其含量越高,水稻抗寒性越强[38]。其作用机理在于可溶性蛋白具有较强的亲水性,在低温条件下增加植株可溶性蛋白含量一方面可以增加细胞的持水能力,使原生质体不至于过度失水;另一方面,可溶性蛋白还能和可溶性糖一起聚集在重要的细胞器(比如叶绿体)周围保护其免受冷害[38]。本研究中,在最低温条件(白天8℃/晚上4℃)下,发酵基质培育的秧苗可溶性蛋白含量最高,其次为无土基质,对照最低(图1)。这种结果与低温条件下水稻在不同基质上的生长表现基本一致(表4),说明可溶性蛋白参与调控水稻耐低温胁迫能力。
脯氨酸作为一种渗透调节物质,除了可以维持细胞的正常pH值,稳定细胞膜外,还可以增加抗氧化酶活性,保护线粒体电子传递链和清除活性氧,从而保护植物并抵抗外界胁迫[39]。在低温条件下,植物体内的脯氨酸含量显著上升[40]。本研究中,在最低温胁迫(白天8℃/晚上4℃)下,发酵基质培育的水稻秧苗其体内脯氨酸含量最高,其次为无土基质,对照最低(图1),说明不同类型基质调控水稻秧苗脯氨酸的合成,从而调控水稻响应低温胁迫。脯氨酸合成相关基因(负责编码一个Δ-1-吡咯啉-5-羧酸盐,参与脯氨酸的合成[40])的表达呈现相同的规律,即在最低温条件(白天8℃/晚上4℃)下,发酵基质培育的秧苗其表达量大于无土基质和对照(图2),进一步验证了不同育秧基质通过调控秧苗脯氨酸含量调节其耐低温胁迫能力。
3.4 抗氧化酶系统对秧苗抵抗低温胁迫的影响
低温胁迫降低细胞膜的流动性,引起脂膜过氧化损伤,产生MDA[39, 41]。植物体内存在不同类型的抗氧化物酶,通过不同分工维持较低水平的超氧阴离子和过氧化物含量。比如SOD催化植物体内的超氧阴离子发生歧化反应,将其转化成氧化性较弱的过氧化氢;CAT则负责分解植物体内多余的过氧化氢;POD参与植物体内过氧化物的分解。逆境条件下,水稻通过以上三种酶的共同作用可以将植株内自由基维持在正常水平[42]。本研究结果显示,最低温条件(白天8℃/晚上4℃)下,以上三种酶的活性在发酵基质培育的水稻秧苗中均最大,其次为无土基质,对照中的活性最低。相应地,丙二醛含量变化趋势则正好相反(表7)。说明发酵基质中的水稻通过调控三种抗氧化酶的活性使水稻在低温条件下维持正常水平的超氧阴离子和过氧化物含量,从而免受过氧化损伤。基因编码超氧化物歧化酶B,缓解植物逆境胁迫下超氧化物带来的损伤,维持细胞膜的稳定性[43]。最低温条件下,其在水稻秧苗体内的表达也为发酵基质>无土基质>对照,进一步说明了超氧化物歧化酶在三种基质调控水稻耐冷胁迫过程中的作用。
除此之外,通过谷胱甘肽-S-转移酶(GST)调控植物体内的谷胱甘肽含量同样可以降低植物在胁迫条件下遭受氧化损伤[44]。本研究中,发酵基质和无土基质培育的水稻秧苗GST活性均在低温胁迫下显著增加,然而对照中GST活性没有显著变化(表7),说明发酵基质和无土基质还通过调控水稻体内的谷胱甘肽含量降低低温胁迫对水稻带来的过氧化损伤。
3.5 耐低温基因表达对秧苗抵抗低温胁迫的影响
目前已经鉴定到一些与水稻耐冷相关的基因,提高相应基因的表达可以显著增强水稻的耐冷胁迫能力。基因编码一个位于细胞膜和内质网上的G蛋白信号调节子与G蛋白互作激活钙离子通道,从而激活GTP酶提高水稻耐低温能力。过表达基因显著提高水稻在低温条件下存活率[28]。()基因编码一个位于细胞核和细胞膜上的锌指蛋白,该基因在低温条件下表达显著上升,通过调控脯氨酸的合成帮助水稻提高冷胁迫抵抗能力[10]。本研究中,在最低温胁迫下,以上两个基因在水稻秧苗中的表达均为发酵基质>无土基质>对照(图2),说明发酵基质和无土基质还通过调控水稻秧苗体内耐冷基因的表达调控其耐低温胁迫能力。
4 结论
在水稻生产全程机械化背景下,水稻育秧基质的研发至关重要。适用早稻生产的育秧基质,在低温条件下不仅能提高水稻秧苗的素质,还能保障我国的粮食安全。通过设置不同的低温条件,我们自主研制的发酵基质和无土基质均能通过调控水稻养分吸收、过氧化酶活性系统、渗透物质含量以及耐冷基因表达等促进水稻秧苗在低温条件下的生长,其中,发酵基质的总体表现优于无土基质。本研究结果初步奠定了早稻生产中耐低温基质研制的方向,后期可通过进一步优化原料挑选和合理组配,满足我国早稻育秧对优质基质的需求,提高粮食产量。
[1] Sasaki T, Burr B.International rice genome sequencing project: The effort to completely sequence the rice genome[J]., 2000, 3(2): 138-141.
[2] 万春光.不同引发处理对水稻苗期耐冷性及老化水稻种子萌发的影响[D].哈尔滨: 黑龙江大学, 2011.
Wan C G.Effects of different initiation treatments on cold tolerance and germination of aged rice seeds in seedling stage[D].Harbin: Heilongjiang University, 2011.(in Chinese with English abstract)
[3] 程式华.2019年中国水稻产业发展报告[M].北京: 中国农业科学技术出版社, 2019: 147.
Chen S H.China Rice Industry Development Report in 2019[M].Beijing: China Agricultural Science and Technology Press, 2019: 147.(in Chinese)
[4] 王一帆, 赵海岩.北方粳稻高产新技术[M].北京: 中国农业科学技术出版社, 2006: 1-10.
Wang Y F, Zhao H Y.New Technology for High Yield of japonica Rice in North China[M].Beijing: China Agricultural Science and Technology Press, 2006: 1-10.(in Chinese with English abstract)
[5] Cruz R, Duarte I, Cabreira C.Inheritance of rice cold tolerance at the seedling stage[J]., 2010, 67(6): 669-674.
[6] 赵利辉, 刘友良.冷胁迫对水稻幼苗根系液泡膜质子泵的伤害及钙的调节作用[J].南京农业大学学报, 2000, 23(3): 5-8.
Zhao L H, Liu Y L.Injury of chilling stress to vacuolar proton pumps in roots of rice seedlings and Ca2+regulation[J]., 2000, 23(3): 5-8.(in Chinese with English abstract)
[7] 郭确, 潘瑞炽.ABA对水稻幼苗抗冷性的影响[J].植物生理学报, 1984, 10(4): 295-303.
Guo Q, Pan R C.Effects of ABA on cold resistance of rice seedlings[J]., 1984, 10(4): 295-303.(in Chinese with English abstract)
[8] 吴旺嫔, 周伟江, 唐才宝, 刘坤, 曾红丽, 王悦.2, 4- 表油菜素内酯对低温胁迫下水稻种子萌发及生理特性的影响[J].分子植物育种, 2020, 18(13): 4427-4434.
Wu W P, Zhou W J, Tang C B, Liu K, Zeng H L, Wang Y.Effects of exogenous 2, 4-epibrassinolide on germination and physiological characteristics of rice seeds under chilling stress[J]., 2020, 18(13): 4427-4434.(in Chinese with English abstract)
[9] 饶玉春, 杨窑龙, 黄李超, 潘建伟, 马伯军, 钱前, 曾大力.水稻耐冷胁迫的研究进展[J].分子植物育种, 2013, 11(3): 443-450.
Rao Y C, Yang Y L, Huang L C, Pan J W, Ma B J, Qian Q, Zeng D L.Research progress on cold stress in rice[J]., 2013, 11(3): 443-450.(in Chinese with English abstract)
[10] Liu K M, Wang L, Xu Y Y, Chen N, Ma Q B, Li F, Chong K.Overexpression of, a putative cold inducible zinc finger protein, increased tolerance to chilling, salt and drought, and enhanced proline level in rice[J]., 2007, 226: 1007-1016.
[11] 文中华, 刘喜雨, 孟军, 刘遵奇, 史国宏.生物炭和腐熟秸秆组配基质对水稻幼苗生长的影响[J].沈阳农业大学学报, 2020, 51(1): 10-17.
Wen Z H, Liu X Y, Meng J, Liu Z Q, Shi G H.Research on biochar and rotten straw-based matrix on the growth of rice seedlings[J]., 2020, 51(1): 10-17.(in Chinese with English abstract)
[12] 戚秀秀, 魏畅, 刘晓丹, 张林利, 姜瑛, 张登晓.根际促生菌应用于基质对水稻幼苗生长的影响[J].土壤, 2020, 52(5): 1025-1032.
Qi X X, Wei C, Liu X D, Zhang L L, Jiang Y, Zhang D X.Effects of plant growth-promoting rhizobacteria added in seedling substrate on rice growth[J]., 2020, 52(5): 1025-1032.(in Chinese with English abstract)
[13] 王德伟.工厂化大棚水稻育苗不同基质对比[J].农技服务, 2019, 36(7): 23-24.
Wang D W.Comparison of different substrates of rice seedling in factory greenhouse[J]., 2019, 36(7): 23-24.(in Chinese)
[14] 钱银飞, 张洪程, 钱宗华, 刘艳阳, 李杰, 郭振华, 陈烨, 张强.我国水稻机插秧发展问题的探讨[J].农机化研究, 2009, 31(10): 1-5.
Qian Y F, Zhang H C, Qian Z H, Liu Y Y, Li J, Guo Z H, Chen Y, Zhang Q.Discussion on development of mechanical-transplanting rice in China[J]., 2009, 31(10): 1-5.(in Chinese with English abstract)
[15] 徐安平.新常态下中国农业机械化发展问题探讨[J].北京农业, 2015(20): 130-131.
Xu A P.Discussion on the development of agricultural mechanization in China under the new normal conditions[J]., 2015(20): 130-131.(in Chinese)
[16] 丁桂珍, 王显, 李亚伟.姜堰市水稻基质育秧存在的问题及对策[J].中国稻米, 2013, 19(6): 96-97.
Ding G Z, Wang X, Li Y W.Problems and countermeasures of rice matric seedling raising in Jiangyan City [J]., 2013, 19(6): 96-97.(in Chinese)
[17] 张楠, 孙彬, 于洪久, 钟鹏, 郭炜, 刘杰.不同育秧基质对寒地水稻秧苗素质的影响[J].安徽农业科学, 2018, 46(1): 39-41.
Zhang N, Sun B, Yu H J, Zhong P, Guo Y W, Liu J.Influence of different raising substrate on quality of rice seedling in cold region [J]., 2018, 46(1): 39-41.(in Chinese with English abstract)
[18] 郭世荣.无土栽培学[M].北京: 中国农业出版社, 2003.
Guo S R.Soilless Culture[M].Beijing: China Agricultural Press, 2003.(in Chinese)
[19] 鲁如坤.土壤农业化学分析方法[M].南京: 河海大学出版社, 2000.
Lu R K.Methods of Soil Agricultural Chemical Analysis[M].Nanjing: Hehai University Press, 2000.(in Chinese)
[20] 林育炯, 张均华, 胡继杰, 朱练峰, 曹小闯, 禹盛苗, 金千瑜.不同类型基质对机插水稻秧苗生理特征及产量的影响[J].农业工程学报, 2016(8): 18-26.
Lin Y J, Zhang J H, Hu J J, Zhu L F, Cao X C, Yu S M, Jin Q Y.Effects of different seedling substrates on physiological characters and grain yield of mechanized-transplanted rice[J]., 2016(8): 18-26.(in Chinese with English abstract)
[21] Stoscheck C M.Quantitation of protein[J]., 1990, 182: 50-68.
[22] Bates L S, Waldren R P, Teare I D.Rapid determination of free proline for water-stress studies[J]., 1973, 39(1): 205-207.
[23] Wang H H, Hou J J, Li Y, Zhang Y Y, Huang J J, Liang W H.Nitric oxide-mediated cytosolic glucose-6 -phosphate dehydrogenase is involved in aluminum toxicity of soybean under high aluminum concentration[J]., 2017, 416(1-2): 39-52.
[24] Beauchamp C, Fridovich I.Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels[J]., 1971, 44(1): 276-287.
[25] Dhindsa R S, Plumbdhindsa P, Thorpe T A.Leaf senescence: Correlated with increased levels of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase[J]., 1981, 32(126): 93-101.
[26] Chen J, Wang W H, Wu F H, You C Y, Liu T W, Dong X J, He J X, Zheng H L.Hydrogen sulfide alleviates aluminum toxicity in barley seedlings[J]., 2013, 362(1-2): 301-318.
[27] Chen J, Duan R X, Hu W J, Zhang N N, Lin X Y, Zhang J H, Zheng H L.Unravelling calcium-alleviated aluminium toxicity in: Insights into regulatory mechanisms using proteomics[J]., 2019, 199: 15-30.
[28] Ma Y, Dai X Y, Xu Y Y, Luo W, Zheng X M, Zeng D, Pan Y J, Lin X L, Liu H H, Zhang D J, Xiao J, Guo X Y, Xu S J, Niu Y D, Jin J B, Zhang H, Xu X, Li L G, Wang W, Qian Q, Ge S, Chong K.confers chilling tolerance in rice[J]., 2015, 6(160): 1209-1221.
[29] Tian Y, Zhang H W, Pan X W, Chen X L, Zhang Z J, Lu X Y, Huang R F.Overexpression of ethylene response factorconfers cold tolerance in rice seedlings[J]., 2011, 20(4): 857-866.
[30] 周跃华, 聂艳丽, 赵永红,李永梅, 何飞飞.国内外固体基质研究概况[J].中国生态农业学报, 2005(4): 46-49.
Zhou Y H, Nie Y L, Zhao Y H, Li Y M, He F F.Research on solid substrate in the whole world[J]., 2005(4): 46-49.(in Chinese with English abstract)
[31] 田曦.几种有机物料堆肥的腐熟度评价及复配基质的筛选[D].兰州: 甘肃农业大学, 2012.
Tian X.Study on evaluating the rotten degree of several organic decomposing matter and choosing the complex medium [D].Lanzhou: Gansu Agricultural University, 2012.(in Chinese with English abstract)
[32] 仲海洲.利用废弃生物质开发水稻育秧基质及其应用效果研究[D].杭州: 浙江大学, 2013.
Zhong H Z.Study on utilization of biomass waste to develop rice seedling substrate[D].Hangzhou: Zhejiang University, 2013.(in Chinese with English abstract)
[33] Bahuguna R N, Jagadish K S V.Temperature regulation of plant phenological development[J]., 2015, 111: 83-90.
[34] Farrell T C, Fox K M, Williams R L, Fukai S.Genotypic variation for cold tolerance during reproductive development in rice: Screening with cold air and cold water[J]., 2006, 98(2-3): 178-194.
[35] Shimono H, Hasegawa T, Fujimura S, Iwama K.Responses of leaf photosynthesis and plant water status in rice to low water temperature at different growth stages[J]., 2004, 89(1): 70-83.
[36] 曲辉辉, 姜丽霞, 朱海霞, 闫平, 宫丽娟, 吕佳佳, 王晾晾, 纪仰慧.孕穗期低温对黑龙江省主栽水稻品种空壳率的影响[J].生态学杂志, 2011, 30(3): 489-493.
Qu H H, Jiang L X, Zhu H X, Yan P, Gong L J, Lü J J, Wang L L, Ji Y H.Effects of low temperature at booting stage on the percentage of unfilled grains of major rice varieties in Heilongjiang Province[J]., 2011, 30(3): 489-493.(in Chinese with English abstract)
[37] 王国莉, 郭振飞.低温对水稻不同耐冷品种幼苗光合速率和叶绿素荧光参数的影响[J].中国水稻科学, 2005, 19(4): 381-383.
Wang G L, Guo Z F.Effects of chilling stress on photosynthetic rate and the parameters of chlorophyll fluorescence in two rice varieties differing in sensitivity[J]., 2005, 19(4): 381-383.(in Chinese with English abstract)
[38] 丁彦.水稻材料WDl的抗寒研究[D].长沙: 湖南农业大学, 2006.
Ding Y.Research on cold tolerance in WD1 of rice[D].Changsha: Hunan Agricultural University, 2006.(in Chinese with English abstract)
[39] 王淼.不同基因型水稻苗期耐冷性与硅的关系[D].哈尔滨: 黑龙江大学, 2012.
Wang M.Relationship between cold tolerance and silicon in rice seedling with different genotypes[D].Harbin: Heilongjiang University, 2012.(in Chinese with English abstract)
[40] Igarashi Y, Yoshiba Y, Sanada Y, Yamaguchi-shinozaki K, Wada K, Shinozaki K.Characterization of the gene for Δ1 -pyrroline-5-carboxylate synthetase and correlation between the expression of the gene and salt tolerance inL[J]., 1997, 33(5): 857-865.
[41] 宋广树, 孙忠富, 王夏, 刘妍.不同生育时期低温处理对水稻品质的影响[J].中国农学通报, 2011, 27(18): 174-179.
Song G S, Sun Z F, Wang X, Liu Y.Effect of low temperature on rice quality in different growth period[J]., 2011, 27(18): 174-179.(in Chinese with English abstract)
[42] 陈思思.苗期和拔节期低温胁迫对扬麦16产量和生理特性的影响[D].扬州: 扬州大学, 2010.
Chen S S.Effects of low temperature at seedling stage and jointing stage on grain yield and physiological parameters in wheat Yangmai 16[D].Yangzhou: Yangzhou University, 2010.(in Chinese with English abstract)
[43] Apel K, Hirt H.Reactive oxygen species: Metabolism, oxidative stress, and signal transduction[J]., 2004, 55: 373-399.
[44] 祝涛, 杨美英.低温处理对不同品种水稻苗期保护酶活性的影响[J].吉林农业, 2010(7): 95.
Zhu T, Yang M Y.Effect of low temperature treatment on protective enzyme activity of different rice varieties at seedling stage [J]., 2010(7): 95.(in Chinese)
Effects of Substrates with Different Properties on Chilling Tolerance of Early Rice Seedlings
ZHU Chunquan#, XU Qingshan#, CAO Xiaochuang, ZHU Lianfeng, KONG Yali, JIN Qianyu, ZHANG Junhua*
(,,,;These authors contributed equally to this work; Corresponding author,:)
【Objective】Early rice is easy to suffer from chilling damage during seedling raising, resulting in yield reduction.Therefore, it is necessary to reveal the effects of different types of substrates on early rice chilling tolerance.【Method】To clarify the regulatory effect of different substrates on the tolerance of early rice seedlings to chilling stress, two representative substrates (soilless substrate and fermentation substrate) and paddy soil (as control) were used in present study.Six-day-old rice seedlings were subjected to different low temperature treatments, and the basic physicochemical properties and gene expression levels of rice were determined after 3 days of treatment.【Result】1) The bulk density of soilless and fermentation substrates was significantly lower than that of the control, however, the electrical conductivity, aeration porosity, and the contents of alkali hydrolyzable nitrogen (N), available phosphorus (P), available potassium (K) and organic matter were significantly higher than those of the control.The root length, shoot and root dry weight per 100 rice seedlings grown in the fermentation substrate exceeded those of the control group, and the nutrient contents (shoot and root N, P, K contents) of seedlings grown in the soilless substrate and fermentation substrate were significantly higher than those of the control group.2) With the decreasing temperature, the growth and nutrient uptake of rice seedlings were both inhibited.The low temperature exerted a slight influence on the growth of seedlings on the fermentation substrate, followed by soilless substrate, and the control was strongly inhibited.3) The MDA content in the seedlings grown in soilless substrate and fermentation substrate was significantly lower than that in the control under low temperature (day 8℃/ night 4℃) treatment, indicating the lower oxidative damage induced by low temperature.The activities of superoxide dismutase (SOD), catalase (CAT), proline content and soluble protein content were higher in the seedlings grown in soilless substrate and fermentation substrate than those in the control.The peroxidase (POD) activity in the seedlings grown in fermentation substrate was higher than that of the control, and the activity of glutathione transferase (GST) was higher in the seedlings grown in soilless substrate than that in control.At the same time, the expression levels of,,andwere significantly higher in the seedlings grown in soilless and fermentation substrate than those of the control, which improved the tolerance to low temperature.【Conclusion】The above results showed that the physiological and biochemical reactions and related gene expression were regulated by fermentation substrate and soilless substrate, leading to improved tolerance of rice seedlings to low temperature stress.
substrate; rice; cold stress; physical and chemical properties; antioxidant enzymes; gene expression
10.16819/j.1001-7216.2021.200909
2020-09-14;
2020-12-31。
国家自然科学基金青年项目(31901452);国家自然科学基金面上项目(31872857,31771733);浙江省自然科学基金资助项目(LQ19C020007)。

