多巴胺引发对盐胁迫下水稻种子萌发及幼苗生长的影响
李玉祥 林海荣 梁倩 王国栋
多巴胺引发对盐胁迫下水稻种子萌发及幼苗生长的影响
李玉祥1林海荣1梁倩1王国栋2,*
(1石河子大学 农学院/新疆生产建设兵团绿洲生态农业重点实验室,石河子 832003;2新疆农垦科学院 农田水利与土壤肥料研究所,石河子 832000;*通信联系人,E-mail: 664812734@qq.com)
【目的】探讨多巴胺(Dopamine,DA)引发对盐胁迫下水稻种子萌发及幼苗生长的影响。【方法】以新疆自育水稻品种新稻17号为研究对象,分别用0(纯水)、0.1、0.5、1、1.5 mg/L的DA溶液(分别用S0、S0.1、S0.5、S1、S1.5表示)引发种子,采用浓度为100 mmol/L的NaCl溶液模拟盐胁迫,以未引发无盐胁迫处理作为对照1(CK),未引发有盐胁迫处理作为对照2(S-CK),研究多巴胺引发对盐胁迫下水稻种子萌发、幼苗生长及生理特性的影响。【结果】与CK相比,盐胁迫下(S-CK)水稻种子的萌发受到明显抑制且萌发速率降低,幼苗长势弱。引发处理不同程度缓解了盐胁迫对种子萌发的抑制,提高发芽率(13.3%~25.8%)和发芽速率,促进幼苗生长;可溶性糖和脯氨酸含量增加(16.4%~51.8%和6.5%~31.2%),超氧化物歧化酶(28.9%~72.7%)、过氧化物酶(15.0%~60.1%)和过氧化氢酶(35.1%~133.0%)活性显著提高,丙二醛(7.1%~26.8%)含量明显降低。表明对种子进行引发处理,通过增强盐胁迫下水稻种子活力,提高幼苗渗透调节物质含量和抗氧化酶活性,降低丙二醛含量,增强了水稻种子及幼苗的耐盐性,其中1.0 mg/L的多巴胺溶液(S1)引发效果优于水引发(S0)。【结论】对于新疆自育水稻品种新稻17而言,1.0 mg/L多巴胺溶液引发能够有效提高其对盐胁迫的抵抗能力,促进种子萌发和幼苗生长。
水稻;种子引发;盐胁迫;多巴胺;萌发;幼苗生长
种子引发(seed priming)又称渗透调节,由Heydecker 等[1]在1973年提出,是一项控制种子缓慢吸水和后期回干的技术,通常是将种子浸在低水势溶液中使之缓慢吸水,再将吸胀种子脱水回干至初始状态,引发过程中种子内部会发生一系列形态和生理生化变化[2-5]。这些变化可以保护细胞中蛋白质和膜结构免遭破坏,同时可促进细胞膜修复、提高膜的完整性,修复因老化等原因引起的染色体损伤,减少染色体畸变频率,维持细胞正常的生理活动,进而提高植物抗逆性[6-8]。用引发剂处理多数植物的种子不仅能提高其出苗速率,使出苗率高而整齐[9-10],而且能提高种子抗寒性[11]、耐旱性[12]、耐盐性[13-14]等,对种子的萌发和抗渗透胁迫等都具有明显的作用[15]。
研究表明,种子引发可以促进直播稻干湿交替管理时水稻生长、分蘖发生,优化产量构成,提高水分利用效率(引发剂为CaCl2)[16],促进直播稻种子萌发且萌发整齐均匀(引发剂为KNO3[17]、KCl和CaCl2[18]),减轻干旱胁迫时过氧化氢的伤害,促进种子萌发(引发剂为PEG[19]、水、KNO3、PEG、SPD[20]和亚精胺[9]),促进淹水条件下种子萌发、物质积累(引发剂为阎浮树叶片分泌物和水)[21],提高种子遇冷后的萌发能力(引发剂为壳聚糖)[22]。此外,也有研究用硒[23]、硼[24]作为引发剂处理水稻种子,能促进种子萌发和秧苗生长。以上研究均表明,采用种子引发处理,能增强水稻抵抗外界逆境胁迫的能力,促进种子萌发和幼苗生长。在种子引发技术在提高水稻种子耐盐方面,Wei等[25]用脱落酸引发水稻种子,发现经引发处理的水稻种子与对照相比叶片枯萎数、幼苗死亡率显著降低,植株后期生长有优势,最终产量显著增加;阮松林等[13]研究表明,引发处理促进种子已有果糖的利用,降低种子内部果糖水平,提高脯氨酸水平,并提高后期盐胁迫下幼苗的果糖水平,从而增强杂交水稻幼苗的耐盐性。可见,种子引发对提高水稻耐盐性也具有较好的应用效果。
盐渍土是世界陆地普遍分布的一类土壤,严重影响植株的生长和作物的产量。统计表明,新疆盐碱土总面积为2181.4万hm2,如何改良及利用盐碱地,是维护新疆绿洲农业稳定发展急需要解决的关键问题。为此,本研究以新疆自育水稻品种新稻17为材料,研究多巴胺引发对盐胁迫下水稻种子萌发及幼苗生长特性的影响,旨在探讨引发处理增强水稻种子及幼苗耐盐性的机理,解决盐渍地种植水稻出苗差、保苗难的问题,为种子引发技术在水稻生产上的应用提供理论依据。
1 材料与方法
1.1 材料
选用新稻17(早粳中晚熟品种,株型紧凑,叶片直立,分蘖力强,株高91.5 cm,千粒重24.6 g,全生育期150 d左右)为供试材料,由新疆农业科学院粮食作物研究所提供。
1.2 试验设计
1.2.1 种子引发处理
选取粒大饱满、大小一致的水稻种子,用0.2% HgCl2消毒 8 min,蒸馏水冲洗干净后置于烧杯中,分别加入浓度为0(纯水)、0.1、0.5、1、1.5 mg/L(分别用S0、S0.1、S0.5、S1、S1.5表示)的多巴胺溶液进行引发,种子质量(g)与溶液体积(mL)比为1∶3,在 25℃的发芽箱内于黑暗条件下引发培养 24 h,引发结束后将种子用蒸馏水快速冲洗干净,用滤纸吸干表面水分后置于25℃的鼓风干燥箱中回干至原含水量。
1.2.2 种子发芽试验
将经引发处理和未引发处理(对照)的水稻种子置于铺有蛭石的标准发芽皿(10 cm×10 cm×5 cm)中,分别加入90 mL 的100 mmol/L的NaCl盐溶液;未经引发且无盐胁迫处理记为CK,未引发但有盐胁迫处理记为S-CK,每个处理重复10次,每个重复播种30粒种子。发芽盒放置在28℃的光照培养箱中,待种子出土后,设定光照4000 lx,每天光照时长12 h,昼夜温度28℃/20℃。
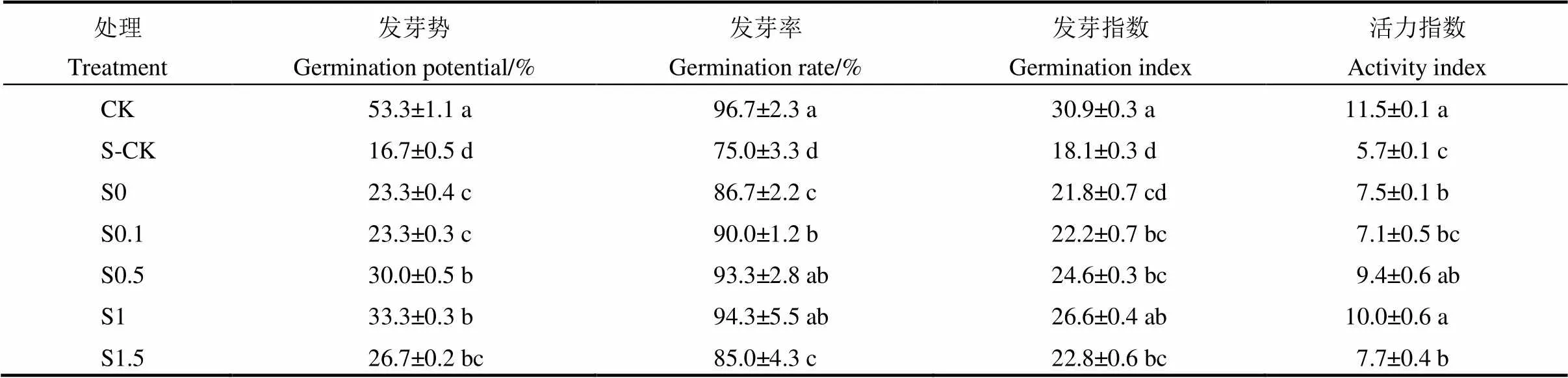
表1 多巴胺引发对NaCl胁迫下稻种萌发的影响
同列数据(平均值±标准差)后相同字母表示在5%水平上差异不显著(=3,最小差异显著法)。S0、S0.1、S0.5、S1、S1.5分别表示用0(纯水)、0.1、0.5、1.0、1.5 mg/L的多巴胺溶液引发种子,并用100mmol/L NaCl溶液模拟盐胁迫;CK表示未引发+无盐胁迫处理,S-CK表示未引发+有盐胁迫处理。下同。
Values (mean±SD) followed by common letters are not significantly different at<0.05 (=3, LSD).S0, S0.1, S0.5, S1, S1.5 indicate that seeds were primed with 0(H2O), 0.1, 0.5, 1 and 1.5 mg/L dopamine solution, respectively, and subjected to 100 mmol/L NaCl solution; CK, No-priming and no-salt stress treatment; S-CK, No-priming plus salt stress.The same below.
1.3 取样及测定方法
1)发芽率及发芽势。播种后第1天开始,每天调查种子发芽数,计算以下各参数:
发芽势(%)=(3 d 内发芽数/供试种子数)×100;
发芽率(%)=(7 d内发芽总数/供试种子数) ×100;
发芽指数(GI)=∑G/D(G为第天的发芽数,D为相应发芽的天数);
活力指数(Vi)=·∑G/D[,幼苗生长势(胚根和胚芽的平均鲜质量)]。
2)幼苗形态指标。播种后第12天,选取长势一致的幼苗测定叶龄、株高、根数、根长,将幼苗分为地上部和地下部,分别称取鲜质量。水稻幼苗根系用扫描仪(Epson V500,美国)将获取根系扫描成黑白对照的TIF格式图像文件,扫描好的TIF 文件用图像分析软件(WinRHIZO,加拿大)分析计算。
3)可溶性糖含量和脯氨酸含量测定采用李合生的方法[26]。
4)丙二醛含量及保护酶活性。参照王学奎[27]的方法测定幼苗叶片超氧化物歧化酶(SOD) 、过氧化物酶(POD) 和过氧化氢酶(CAT) 活性及丙二醛(MDA)含量。
1.4 数据统计与分析方法
在Excel 2007软件中进行数据常规处理和作图,在SPSS 20.0中进行方差分析。

图1 多巴胺引发对NaCl胁迫下稻种发芽率的影响
Fig.1.Effect of dopamine priming on seed germination rate under NaCl stress.
2 结果与分析
2.1 多巴胺引发对NaCl胁迫下稻种萌发的影响
与CK相比,盐胁迫(S-CK)下水稻种子萌发明显受到抑制,种子发芽势、发芽率、发芽指数和活力指数显著下降(表1)。与S-CK相比,种子引发均能不同程度地促进种子萌发,且整体表现为随着引发剂浓度的增加呈先升高后下降趋势,其中S1处理表现最优,发芽势、发芽率、发芽指数和活力指数分别提高99.9%、25.8%、47.5%和74.8%,其次为S0.5处理。
由图1可见,与CK相比,盐胁迫(S-CK)下水稻种子萌发明显受到抑制且发芽速度减慢;与S-CK相比,种子引发均有效促进了水稻种子萌发并提高了发芽速率,且整体表现为随着引发剂浓度的增加呈先升高后下降趋势,其中S1处理表现最优。
2.2 多巴胺引发对NaCl胁迫下水稻幼苗生长的影响
由图2可知,与 CK 相比,盐胁迫(S-CK)显著降低了水稻幼苗叶龄(11.8%)、单株叶面积(28.1%)、地上部鲜质量(31.6%)、根系鲜质量(21.1%)、苗高(24.2%)和根长(28.4%)。与S-CK相比,适宜浓度的引发剂处理显著促进了水稻植株生长,且整体表现为随着引发浓度的增加呈先升高后下降趋势,其中叶龄、单株叶面积、地上部鲜质量和根系鲜质量均以S0.5和S1处理表现较好;苗高以S1处理最优、其次为S1.5和S0.5;根长以S0.5最优,其次为S0.1和S1处理。此外,当引发剂浓度过高时(S1.5),地上部鲜质量和根系鲜质量与S-CK无显著差异,根长显著降低。
2.3 多巴胺引发对NaCl胁迫下水稻幼苗根系形态特征的影响
由表2可知,与 CK 相比,盐胁迫(S-CK)均不同程度降低了水稻幼苗根数(9.1%)、根投影面积(23.1%)和根体积(16.7%),根直径有一定程度的增加(8.0%),其中,根投影面积达到显著水平。与S-CK相比,适宜浓度的引发剂对水稻幼苗根系生长有一定的促进作用。其中,S0、S0.5、S1和S1.5根数分别比S-CK增加1.1%、3.9%、6.4%、3.9%,S0.5处理根投影面积比S-CK增加10.0%,S0.5处理根表面积比S-CK增加10.0%,S0.5处理根系直径比S-CK增加0.7%,S0.5处理根系体积比S-CK增加6.7%,处理间无显著差异。
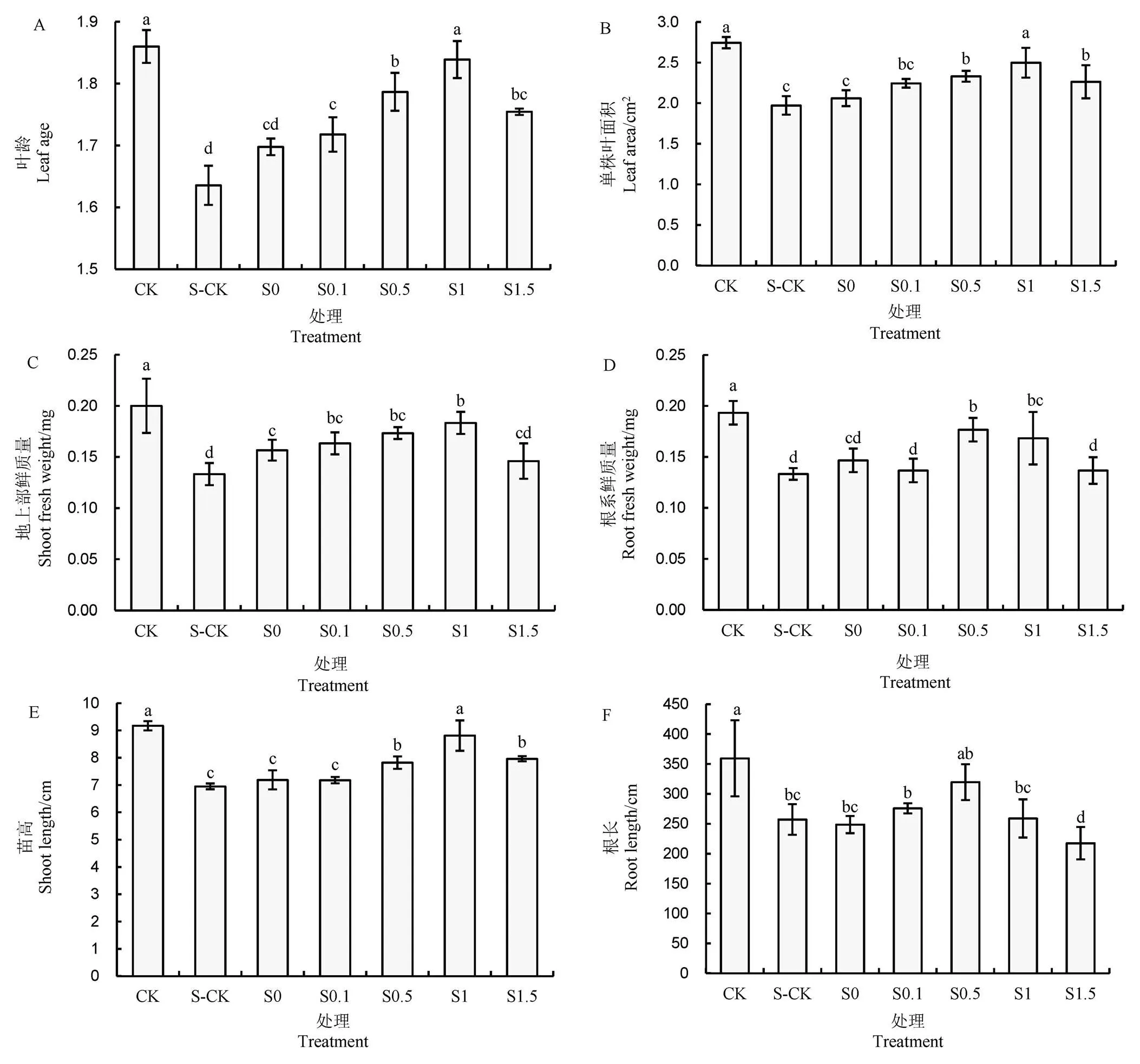
柱上相同小写字母表示在5%水平上差异不显著(n=3,最小显著差数法)。下同。
Fig.2.Effect of dopamine priming on growth of rice seedlings under NaCl stress.
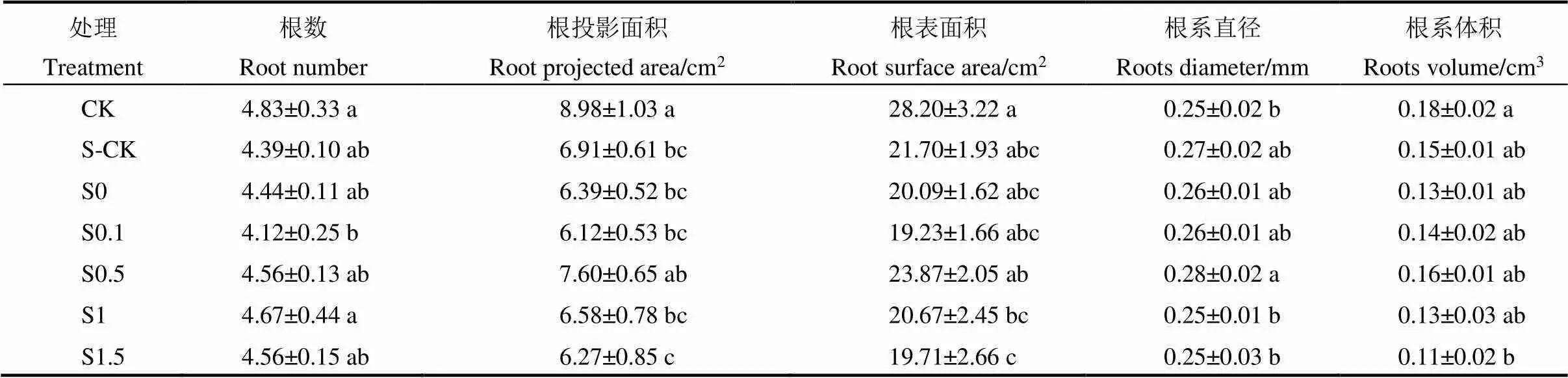
表2 多巴胺引发对NaCl胁迫下水稻根系形态特征的影响

图3 多巴胺引发对NaCl胁迫下水稻叶片可溶性糖及脯氨酸含量的影响
Fig.3.Effect of DA priming on soluble sugar and free proline contents of rice seedling leaves under NaCl stress.
2.4 多巴胺引发对NaCl胁迫下水稻叶片可溶性糖及脯氨酸含量的影响
由图3-A可知,与 CK 相比,盐胁迫(S-CK)显著增加了水稻幼苗叶片可溶性糖含量(22.2%);与S-CK相比,种子引发处理均不同程度提高了叶片中可溶性糖含量,随着引发浓度的增加,可溶糖含量呈先增后降趋势;其中,S1处理最高,其次为S0.5处理,二者间无显著差异,均显著高于其他引发处理。与S-CK相比,S0、S0.1、S0.5、S1、S1.5叶片可溶性糖含量分别增加16.4%、20.0%、49.1%、51.8%、27.3%。与可溶糖含量表现一致,盐胁迫显著增加了叶片脯氨酸含量(图3-B),水及适宜浓度的多巴胺引发(S0、S0.1、S0.5、S1)均显著提高了叶片脯氨酸含量,过高浓度的多巴胺引发(S1.5)对叶片脯氨酸含量无显著影响。
2.5 多巴胺引发对NaCl胁迫下水稻叶片MDA含量及酶活性的影响
由图4-A可知,与 CK 相比,盐胁迫(S-CK)显著增加了水稻幼苗叶片中MDA含量(64.1%);与S-CK相比,种子引发处理均不同程度地降低了叶片中MDA含量,其中,水引发处理(S0)与S-CK处理间无显著差异,多巴胺引发各处理(S0.1、S0.5、S1、S1.5)均显著低于S-CK,S1处理MDA含量最低,与S0.5和S1.5处理间无显著差异。与S-CK相比,S0、S0.1、S0.5、S1、S1.5叶片中MDA含量分别下降7.1%、12.6%、26.9%、29.4%、24.7%。
由图4-B可知,水稻叶片SOD活性表现趋势与MDA相反。与CK相比,盐胁迫(S-CK)显著降低了叶片SOD活性;与S-CK相比,种子引发处理均显著提高了叶片中SOD活性,随着多巴胺引发浓度的增加,叶片SOD活性呈先升高后降低趋势,其中S0.5处理最高,其次为S1、S1.5处理,三者间无显著差异,均显著高于S0处理。同样地,盐胁迫显著降低了叶片POD活性(图4-C);与S-CK相比,引发处理均显著提高了POD活性,其中S1处理最高,达到了CK的水平(S1与CK无显著差异),其次为S0.5、S0.1、S1.5,处理间差异均达到显著水平。叶片CAT活性变化趋势与SOD和POD基本一致(图4-D),为S1最高,其次为S0.5处理,二者均高于CK,但无显著差异。
2.6 水稻幼苗长势与相关生理指标的相关性分析
由表3可知,水稻幼苗叶龄、地上部鲜质量及根系鲜质量与SOD、POD、CAT均呈显著或极显著正相关,与MDA含量呈显著或极显著负相关;单株叶面积和苗高与SOD、POD呈显著或极显著正相关,与MDA含量呈极显著负相关,与CAT相关未达显著;根数与MDA呈显著正相关,与其他指标无显著相关;根长、根投影面积、根表面积、根直径、根体积与SOD、POD、CAT、MDA均无显著相关;水稻幼苗生长参数与可溶性糖和脯氨酸含量均无显著相关。
3 讨论
盐胁迫通常会严重影响植物种子萌发,影响植株碳同化和生长发育,使植株生长量和干物质积累量减少[28]。种子引发在一些发达国家已作为某些蔬菜、花卉作物种子的常用播前处理技术,而其实质是在限制种子吸水速率的条件下,使种子膜系统得到较好修复,并提前启动萌发所需的物质代谢[29],进而明显提高种子萌发和抗逆能力。本研究中盐(NaCl)胁迫显著抑制了水稻种子萌发,降低了萌发速度,影响水稻幼苗生长,而水和多巴胺引发均不同程度地促进了种子萌发且加快了萌发速率,整体上增加了水稻幼苗叶龄、单株叶面积、地上部鲜质量、根系鲜质量、苗高和根长,其中以1.0 mg/L多巴胺引发效果较好,表明采用适宜浓度的引发剂能增强水稻抵抗外界逆境胁迫的能力,促进种子萌发和幼苗生长,这与前人研究结果一致[16-25]。此外,刘慧霞等[30]研究表明,水引发不仅能够加快紫花苜蓿种子萌发速率,提高萌发一致性,而且能够增强抗逆性,但对最终的发芽率无显著影响。这表明引发对不同植物的效果存在差异,可能与植物自身的生物学特性和种子质量有关[31]。
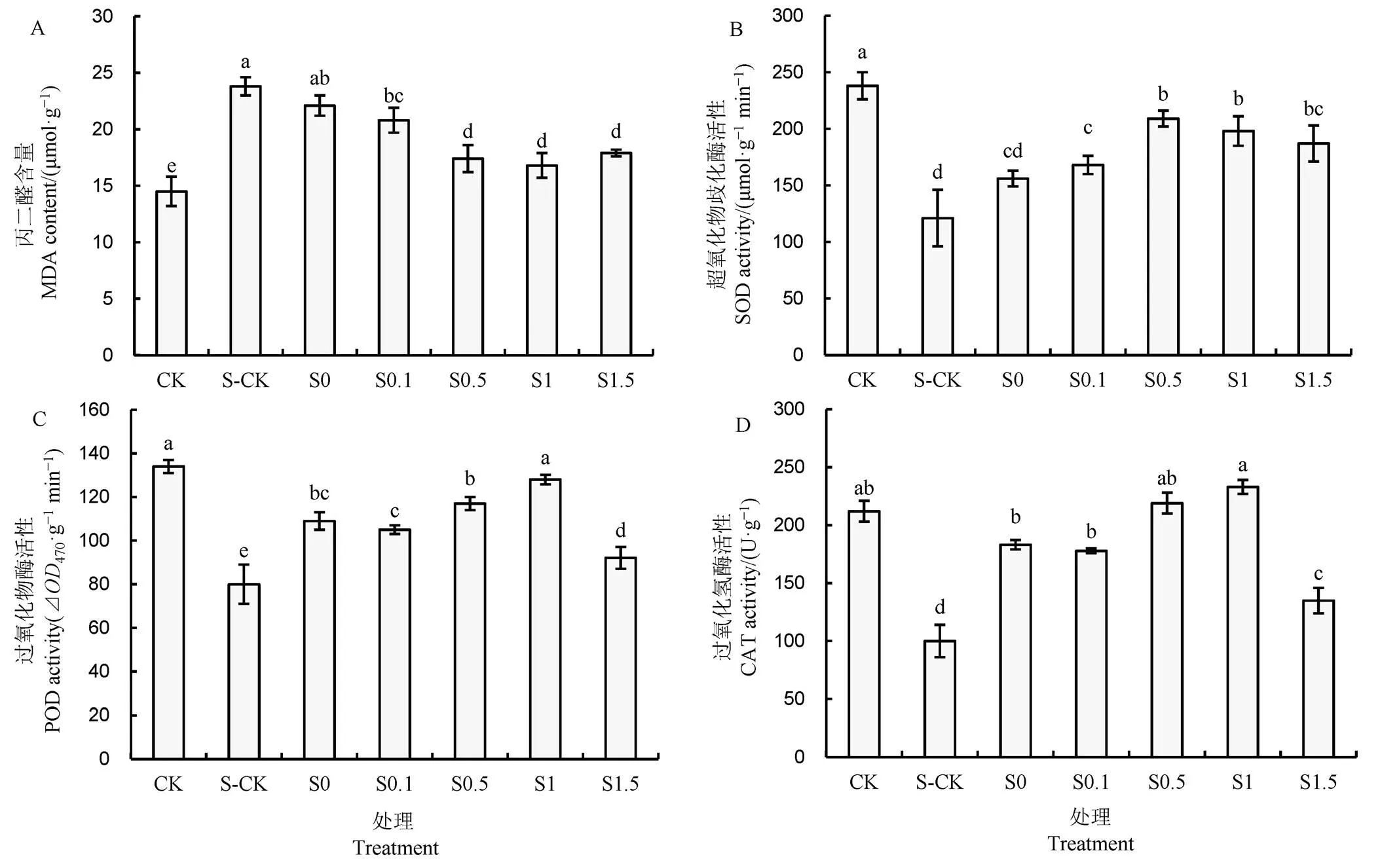
图4 多巴胺引发对NaCl胁迫下水稻叶片MDA含量及抗氧化酶活性的影响
Fig.4.Effect of DA priming on MDA content and antioxidant enzyme activities of rice seedling leaves under NaCl stress.
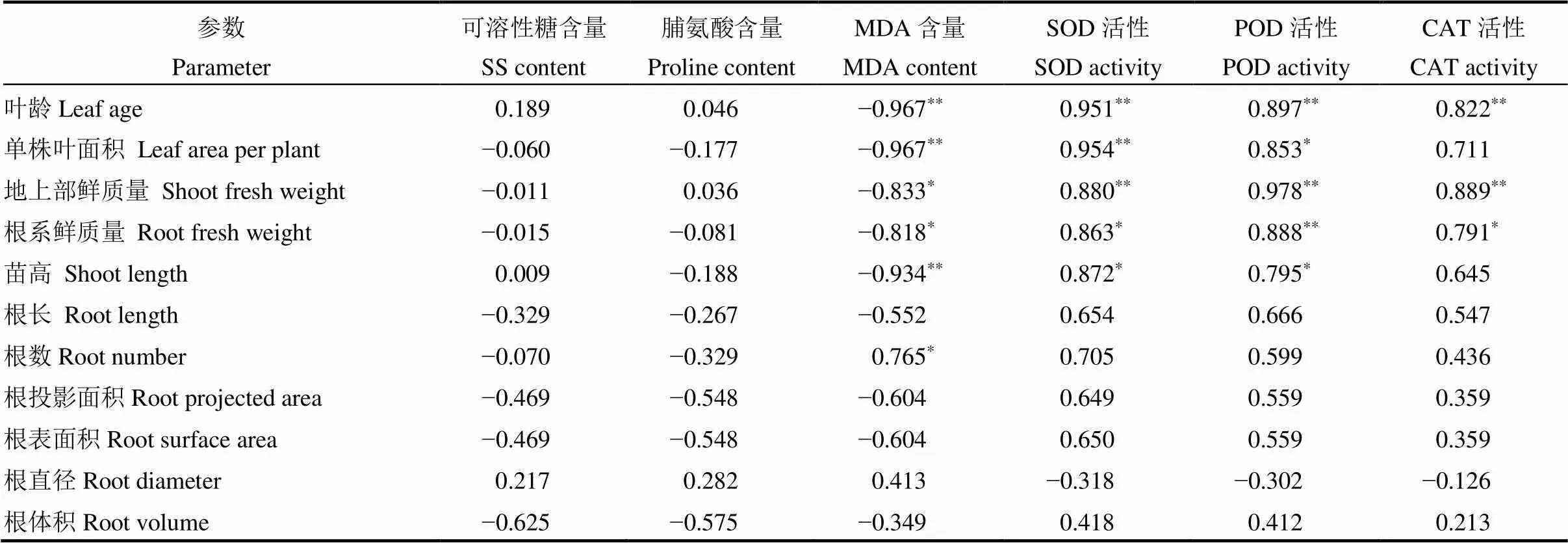
表3 水稻幼苗长势与生理指标的相关性分析
*,**分别表示在0.05, 0.01水平上显著相关。
*,**Significantly correlated at the 0.05 and 0.01 probability levels, respectively.
可溶性糖和脯氨酸作为有效渗透调节物质,其含量的增加对于调节渗透平衡、防止渗透胁迫对植物造成伤害等具有重要意义。本研究结果表明,盐胁迫下水稻幼苗叶片可溶性糖和游离脯氨酸含量增加,引发处理后幼苗叶片中可溶性糖和游离脯氨酸含量进一步显著增加,能够维持盐胁迫下水稻种子及幼苗渗透平衡,保持功能大分子结构的稳定性,增强其抗氧化胁迫能力,抑制膜脂过氧化发生,促进种子萌发及幼苗生长[32],这与Zheng等[20]及孙园园等[33]研究结果基本一致;本研究中以0.5~1.0 mg/L多巴胺引发效果较好,优于水引发和其他多巴胺浓度处理。说明种子引发可以通过对水稻幼苗叶片可溶性糖和游离脯氨酸的提升来增强幼苗的渗透调节能力,有效缓解盐胁迫对细胞膜透性造成的破坏,从而增强水稻的抗逆性。
引发能促进细胞膜的修复和膜完整性的提高,降低种子内容物的外渗[34],促进与抗劣变相关酶活性的提高[35]。在本研究中,盐胁迫显著增加了幼苗叶片MDA含量,降低了SOD、POD和CAT活性,而引发处理后的幼苗叶片MDA含量均有不同程度的降低,SOD、POD和CAT活性显著升高,且以0.5~1.0 mg/L多巴胺引发效果较好。相关性分析也表明,水稻幼苗叶龄、地上部鲜质量及根系鲜质量与SOD、POD、CAT均呈显著或极显著正相关,与MDA含量呈显著或极显著负相关关系。表明引发处理能够增加幼苗叶片SOD、POD和CAT活性,通过清除植物体内积累的活性氧,增强植株抗氧化能力,降低盐胁迫膜脂的过氧化作用,保持了细胞膜的完整性。此外,Chen和Arora[36]认为引发本身就是一种适度的胁迫,如水引发,在一些研究中,种子水合作用也可看作是一种胁迫,因为一些种子在吸水过程中会造成吸胀损伤和产生活性氧[37],溶液引发则是将种子置于低水势的环境中使其缓慢吸水。本研究中,水和多巴胺引发均能在一定程度上提高盐胁迫逆境下水稻幼苗叶片的抗氧化酶活性,降低MDA含量,增强幼苗的耐盐行,可能是因为在引发过程中这种适度的胁迫刺激了保护酶系统,当种子发芽和和幼苗生长阶段再次遇到逆境的时候,经引发的种子较未引发的种子具有更强的应激胁迫的能力,从而有更强的胁迫耐性[38]。
[1] Heydecker W.Germination of an Idea: The priming of seeds[R].School of Agriculture, University of Nottingham, 1974: 50-67.
[2] Heydecker W, Coolbear P.Seed treatments for improved performance survey and attempted prognosis[J]., 1977(5): 353-425.
[3] Bailly C, Benamar A, Corbineau F, Come D.Antioxidant systems in sunflower (L.) seed as affected by priming[J]., 2000 (10): 35-42.
[4] Jisha K C, Vijayakumari K, Puthur J T.Seed priming for abiotic stress tolerance: An overview[J]., 2013, 35: 1381-1396.
[5] Ehab A I.Seed priming to alleviate salinity stress in germinating seeds[J]., 2016, 192: 38-46.
[6] Sivritepe H O, Dourado A M.The effete of priming treatments on the viability and accumulation of chromosomal damage in aged pea seeds[J].,1995, 75: 165-171.
[7] Siri B, Vichitphan K, Kaewnaree P, Vichitphan S, Klanrit P.Improvement of quality, membrane integrity and antioxidant systems in sweet pepper (Linn) seeds affected by osmopriming[J].2013(7): 2068-2073.
[8] 赵玥, 辛霞, 王宗礼, 卢新雄.种子引发机理研究进展及牧草种子引发研究展望[J].中国草地学报, 2012, 34(3): 102-108.
Zhao Y, Xin X, Wang Z L, Lu X X.Research progress and prospects in the mechanism of seed priming[J]., 2012, 34(3): 102-108.(in Chinese with English abstract)
[9] 周小梅, 赵运林, 文彤, 李小湘.亚精胺引发对水分胁迫下水稻种子活力及幼苗生理特性的影响[J].核农学报, 2013, 27(2): 247-252.
Zhou X M, Zhao Y L, Wen T, Li X X.Effects of spd priming on seed vigor and seedling physiological characteristics of rice under water stress[J]., 2013, 27(2): 247-252.(in Chinese with English abstract)
[10] Harris D, Joshi A, Khan P A, Gothkar P, Sodhi P S.On-farm seed priming in semi-arid agriculture- development and evaluation in maize, rice and chickpea in India using participatory methods[J]., 1999, 35(1): 15-29.
[11] Imran M, Mahmood A, Romheld V, Neumann G.Nutrient seed priming improves seedling development of maize exposed to low root zone temperatures during early growth[J]., 2013, 49: 141-148.
[12] Shafiq F, Batool H, Raza S H.Effect of Potassium nitrate seed priming on allometry of drought-stressed cotton (L.) [J]., 2015, 18(3): 195-204.
[13] 阮松林, 薛庆中, 王清华.种子引发对杂交水稻幼苗耐盐性的生理效应[J].中国农业科学, 2003, 36(4): 463-468.
Ruan S L, Xue Q Z, Wang Q H.Physiological effects of seed priming on salt-tolerance of seedlings in hybrid rice (L.) [J]., 2003, 36(4): 463-468.(in Chinese with English abstract)
[14] Salama K, Mansour M M F.Choline priming-induced plasma membrane lipid alterations contributed to improved wheat salt tolerance[J].2015, 37: 1-7.
[15] Yan K, Xu H L, Cao W, Chen X B.Salt priming improved salt tolerance in sweet sorghum by enhancing osmotic resistance and reducing root Na+uptake[J].2015, 203(37): 1-10
[16] Rehman H U, Kamran M, Basra S M A, Afzal I, Farooq M.Influence of seed priming on performance and water productivity of direct seeded rice in alternating wetting and drying[J]., 2015, 22(4): 189-196.
[17] Ruttanaruangboworn A, Chanprasert W, Tobunluepop P, Onwimol D.Effect of seed priming with different concentrations of potassium nitrate on the pattern of seed imbibition and germination of rice (L.) [J]., 2017, 16(3): 605-613.
[18] Farooq M, Basre S M A, Tabassum R, Afzal I.Enhancing the performance for direct seeded fine rice by seed priming[J]., 2006, 9(4): 446-456.
[19] Goswami A, Banerjee R, Sangh A R.Drought resistance in rice seedlings conferred by seed priming[J]., 2013, 250: 1115-1129.
[20] Zheng M M, Tao Y, Hussain S, Jiang Q W, Peng S B, Huang J L, Cui K H, Nie L X.Seed priming in dry direct-seeded rice: Consequences for emergence, seedling growth and associated metabolic events under drought stress[J]., 2016, 78: 167-178.
[21] Sarkar R K.Seed priming improves agronomic trait performance under flooded and non-flooded conditions in rice with SUB1 QTL[J]., 2012 (4): 286-294.
[22] 万春光.不同引发处理对水稻苗期耐冷性及老化水稻种子萌发的影响[D].哈尔滨: 黑龙江大学, 2011
Wang C G.Effects of different priming treatments on cold tolerance of rice seedlings and germination of aged rice seeds[D].Haerbin: Heilongjiang University, 2011.(in Chinese)
[23] Khaliq A, Aslam F, Hussain A M S, Geng M, Wahid A, Rehman H.Seed priming with selenium: Consequences for emergence, seedling growth, and biochemical attributes of rice[J]., 2015, 166: 236-244.
[24] Rehman A U, Farooq M, Cheema Z A, Wahid A.Seed priming with boron improves growth and yield of fine grain aromatic rice[J]., 2012, 68: 189-201.
[25] Wei L X, Lv B S, Xiao W, Li M M, Wang H Y, Ma H Y, Yang R F, Yang Z Z, Piao Z H, Wang J H, Lou C J, Jiang Z, Liang W.Priming of rice (L.) seedlings with abscisic acid enhances seedling survival, plant growth, and grain yield in saline-alkaline paddy fields[J]., 2017, 203: 86-93.
[26] 李合生.植物生理生化实验原理和技术[M].北京: 高等教育出版社, 2000.
Li H S.Principles and Technology of Plant Physiology and Biochemistry[M].Beijing: Higher Education Press, 2000.
[27] 王学奎.植物生理生化实验原理和技术[M].北京: 高等教育出版社, 2006.
Wang X K.The Principle and Technology of Plant Physiology and Biochemistry Experiment[M].Beijing: Higher Education Press, 2006.
[28] 王素平, 李娟, 郭世荣, 胡晓辉, 李璟, 汪天.NaCl 胁迫对黄瓜幼苗植株生长和光合特性的影响[J].西北植物学报, 2006, 26(3): 455-461.
Wand S P, Li J, Guo, S R, Hu X H, Li J, Wang T.Effects of NaCl stress on growth and photosynthetic characteristics of cucumber (L.) seedlings[J]., 2006, 26(3): 455-461.(in Chinese with English abstract)
[29] Bohnert H J, Shen B.Transformation and compatible solutes[J]., 1999, 78: 237-260.
[30] 刘慧霞, 王彦荣.水引发对紫花苜蓿种子萌发及其生理活动的影响[J].草业学报, 2008, 17(4): 78-84.
Liu H X, Wang Y R.Effect of hydro-priming on seed germination and physiological activities in medicago sativa[J]., 2008, 17(4): 78-84.(in Chinese with English abstract)
[31] Ellis R H, Butcher P D.The effect of priming and‘natural’difference in quality amongst onion seed lots on the response the rate of germination to temperature and the identification of the characteristics under genotypic control[J]., 1988, 39: 935-950.
[32] Sami F, Yusuf M, Faizan M, Faraz A, Hayat S.Role of sugars under abiotic stress[J]., 2016, 109(12): 54-61.
[33] 孙园园, 孙永健, 王明田, 李旭毅, 郭翔, 胡蓉, 马均.种子引发对水分胁迫下水稻发芽及幼苗生理性状的影响[J].作物学报, 2010, 36(11): 1931-1940.
Sun Y Y, Sun Y J, Wang M T, Li X Y, Guo X, Hu R, Ma J.Effects of seed priming on germination and seedling growth of rice under water stress[J]., 2010, 36(11): 1931-1940.(in Chinese with English abstract)
[34] 郑光华, 燕义唐, 张庆昌.大豆种子吸胀冷害与“修补”过程的探讨[J].中国科学: B辑, 1988(4): 395-402.
Zheng G H, Tan Y T, Zhang Q C.Discussion on Soybean Seed Imbibition and Chilling Damage and "Mending" Process[J].:, 1988(4): 395-402.(in Chinese)
[35] Bailly C, Benamar A, Corbineau F.Antioxidant systems in sunflower (L.) seeds as affected by priming[J]., 2000, 10: 35-42.
[36] Chen K, Arora R.Priming memory invokes seed stress-tolerance[J]., 2013, 94: 33-45.
[37] Bailly C.Active oxygen species and antioxidants in seed biology[J]., 2004, 14: 93-107.
[38] 李洁, 徐军桂, 林程, 关亚静, 胡晋.引发对低温胁迫下不同类型玉米种子萌发及幼苗生理特性的影响[J].植物生理学报, 2016, 52(2): 157-166.
LI J, Xu J G, Lin C, Guan Y J, Hu J.Effect of priming on germination and physiological characteristics of different types of corn seeds under low-temperature stress[J]., 2016, 52(2): 157-166.(in Chinese with English abstract)
Effects of Dopamine Priming on Seed Germination and Seedling Growth of Rice Under Salt Stress
LI Yuxiang1, LIN Hairong1, LIANG Qian1, WANG Guodong2,*
(Key Laboratory of Oasis Eco-agriculture of Xinjiang Production Construction Group / Agricultural College, Shihezi University, Shihezi 832003, China; Institute of Farmland Water Conservancy and Soil-fertilizer, Xinjiang Academy of Agricultural Reclamation Science, Shihezi 832000, China; Corresponding author, E-mail: 664812734@qq.com)
【Objective】It is of significance to clarify the effects of dopaminepriming on rice seed germination and seedling growth under salt stress.【Method】The effects of seed priming on seed germination, seedling growth and physiological characteristics under salt stress were analyzed.Rice (Variety: Xindao 17) seeds were primed with 0(H2O), 0.1, 0.5, 1 and 1.5 mg/L dopamine solution, respectively.Salt stress was simulated with 100 mmol/L NaCl solution.The no-priming and no-salt stress treatment was kept as control 1(CK), and the no-priming with salt stress was kept as control 2(S-CK).【Result】Compared with CK, salt stress (S-CK) obviously slowed down or stopped the germination of rice seeds, and the rice seedlings grew weakly.The priming treatment relieved the inhibitory effect of salt stress on rice seeds germination, speeded up the germination (13.3%-25.8%), promoted seedling growth, increased the contents of soluble sugar(16.4%-51.8%), proline(6.5%-31.2%), and enhanced the activities of SOD(28.9%-72.7%), POD(15.0%-60.1%) and CAT(35.1%-133.0%), decreased the content of MDA(7.1%-26.8%).The results indicated that seed priming could enhance salt tolerance of rice seeds and seedlings by improving the vigor of rice seeds, the activities of antioxidant enzymes and the contents of osmotic regulatory substances, and decreasing the content of MDA.The medium concentration of dopamine solution (S1) was better than water(S0).【Conclusion】The suitable priming solution for Xindao 17 was 1.0 mg/Ldopamine, which could effectively enhance salt tolerance of rice seeds, and promote seed germination and seedling growth.
rice (); seed priming; salt stress; dopamine; seed germination; seedling growth
10.16819/j.1001-7216.2021.200808
2020-08-11;
2021-01-01。
国家自然科学基金资助项目(31860345);石河子大学高层次人才资助项目(RCSX201724);石河子大学绿洲生态重点实验室开放基金资助项目(201702)。

