4种血清型沙门氏菌多重PCR检测方法建立及应用
蒋玥 衣服德 许华 李贵阳 卜仕金

摘要:为检测鉴别鸡白痢、肠炎、鼠伤寒、伤寒4种养禽业中常见的沙门氏菌血清型,利用每种血清型的特异基因位点,建立多重PCR(polymerase chain reaction)检测方法,并通过试验对多重PCR法的特异性、灵敏度进行验证。结果显示,所建立的检测方法特异性强,与非沙门氏菌无交叉反应,灵敏度高。鸡白痢沙门氏菌的最低检测限度13.1 pg/mL,肠炎沙门氏菌最低检测限度达12.5 pg/mL,鼠伤寒沙门氏菌、伤寒沙门氏菌的最低检测限度13.7 pg/mL,伤寒沙门氏菌最低检测限度12.3 pg/mL。结果表明,此方法准确可靠、特异性强、灵敏度高,有望成为以后检测沙门氏菌的有效工具。
关键词:鸡白痢沙门氏菌;肠炎沙门氏菌;鼠伤寒沙门氏菌;伤寒沙门氏菌;多重PCR
中图分类号: S852.61 文献标志码: A 文章编号:1002-1302(2021)13-0059-05
目前,已发现的沙门氏菌血清型有2 000多种[1]。其中,鸡白痢沙门氏菌、肠炎沙门氏菌、鼠伤寒沙门氏菌、伤寒沙门氏菌这几种血清型的沙门氏菌在我国部分地区感染率较高[2]。有资料显示这几种血清型的沙门氏菌基因组相近[3],想要检测鉴别这几种沙门氏菌血清型,可通过培养为前提的传统检测方法和分子生物学检测方法[4]。传统检测方法包括平板上鉴别培养[5],生化检测以及血清分型等[3]。这些方法虽然结果清晰、准确,但是存在检测时间长[5]、特异性差、操作过程繁琐等缺点,不适用于大批量的临床样本检测[6]。分子生物学检测技术包括聚合酶链反应技术PCR(polymeraze chain reaction)、恒温核酸扩增技术、脉冲场凝胶电泳、基因探针技术等,本试验用到的检测技术是聚合酶反应技术PCR中的多重PCR检测技术[6]。
多重PCR检测技术可以同时扩增多个目的片段,实现多通量的目的基因检测。本研究用多重PCR检测技术检测鉴别鸡白痢沙门氏菌、肠炎沙门氏菌、鼠伤寒沙门氏菌、伤寒沙门氏菌4种养禽业中常见的沙门氏菌血清型。这个技术相比沙门氏菌传统的检测方法既快速、高效,也简单易操作[3-7],并适用于规模化养殖中大量的样本检测。因此这个方法的建立能及时发现生产养殖中出现的沙门氏菌感染,为沙门氏菌的防控奠定基础。
1 材料与方法
1.1 试验材料
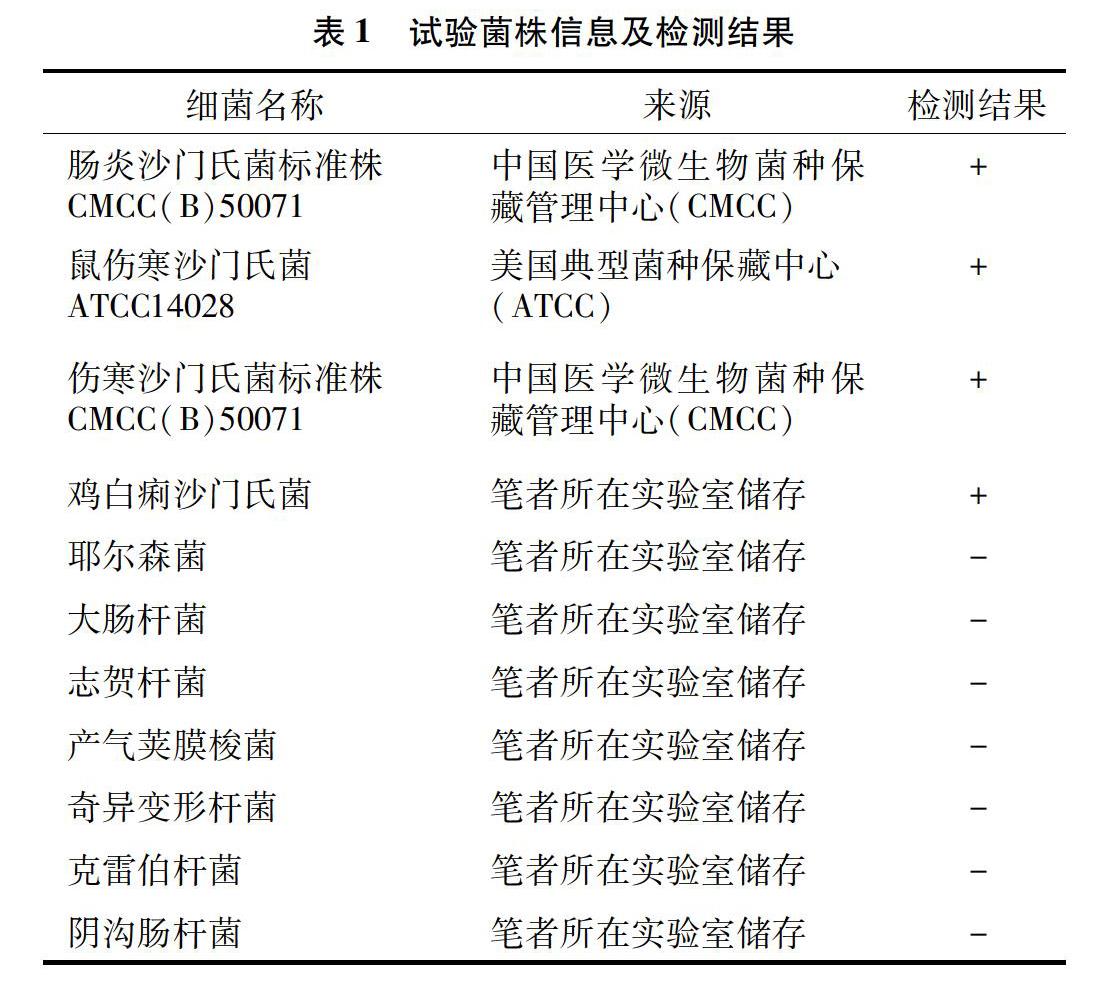
细菌基因组核酸提取试剂盒(GB50)及试验中所需的酶(IE-PME),均购自青岛英赛特生物科技有限公司,引物由青岛生工生物科技有限公司合成。样本主要包括:肠炎沙门氏菌标准株CMCC(B)50071、鼠伤寒沙门氏菌标准菌株ATCC14028、伤寒沙门氏菌标准菌株CMCC(B)50071、鸡白痢沙门氏菌阳性菌等(表1)。临床样品在2017年5月至2019年11月从山东各地采集,采集的沙门氏菌临床样品数为128份。
1.2 核酸模板提取
沙门氏菌的液体样本用MH肉汤培养[8]。取 1 mL 菌液,按照基因组提取试剂盒的说明书,完成试验所需不同沙门氏菌基因组DNA提取。
1.3 试验方法
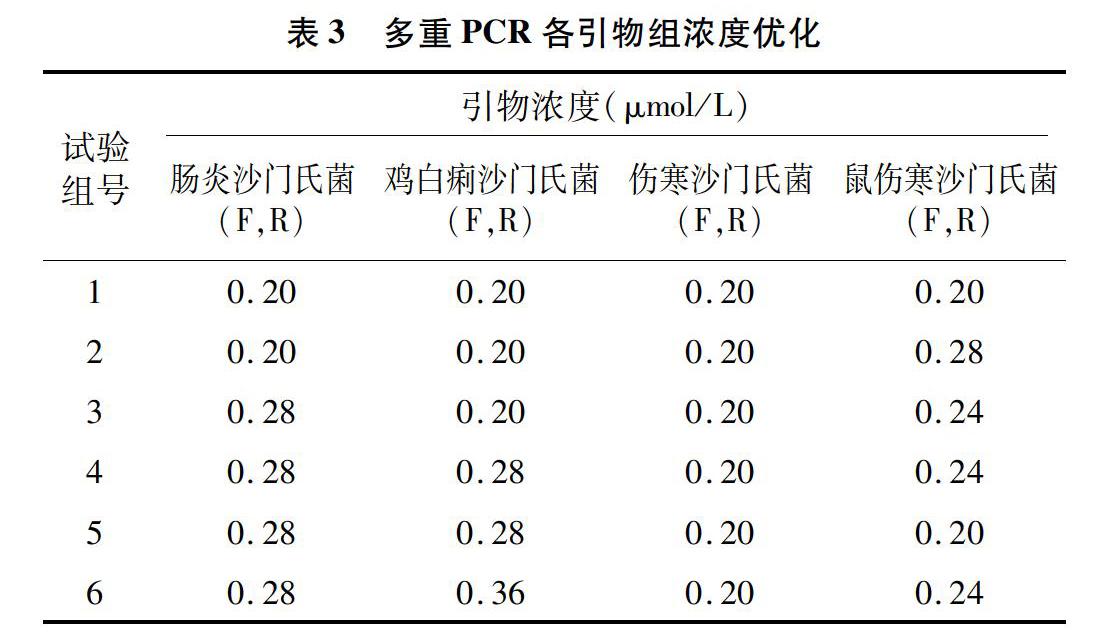
1.3.1 引物设计与条件优化 从GenBank获取沙门氏菌的基因序列,利用Bioedit软件对序列进行比对,具体的引物序列信息见表2。由表2可知,以提取的肠炎沙门氏菌、鼠伤寒沙门氏菌、伤寒沙门氏菌和鸡白痢沙门氏菌的基因组DNA作为模板,用对应的引物检测。首先用每对引物分别对每个目的基因进行扩增,反应体系为MIX 12.5 μL,每对引物上下游各0.5 μL,模板各1.0 μL,ddH2O 4.5 μL(总体系25.0 μL)。反应条件为:94 ℃预变性2 min;98 ℃ 变性10 s,64 ℃退火90 s,循环30次。根据目的基因扩增结果,由表3可知,优化多重反应的引物浓度比例和温度等条件,最终PCR产物经2%琼脂糖凝胶电泳检测(121 V,20 min),每组试验重复3次。
1.3.2 多重PCR特异性验证 用肠炎沙门氏菌、鼠伤寒沙门氏菌、伤寒沙门氏菌标准株、鸡白痢沙门氏菌的阳性菌和金黄色葡萄球菌、大肠杆菌、志贺杆菌、产气荚膜梭菌、奇异变形杆菌、云南微球菌、副溶血弧菌基因组作为DNA模板,多重PCR反应体系分别扩增这几种菌。PCR的反应体系为:MIX 12.5 μL,肠炎沙门氏菌上下游引物各0.7 μL;鸡白痢沙门氏菌上下游引物各0.7 μL;伤寒沙门氏菌上下游引物各 0.5 μL,鼠伤寒沙门氏菌上下游引物各0.6 μL,H2O 3.0 μL(总体系25.0 μL);反应条件为:94 ℃预变性2 min;98 ℃变性10 s,64 ℃退火90 s,扩增循环数为30个循环。
1.3.3 多重PCR灵敏性检测 对涉及的核酸基因组DNA,分别进行10~106倍的梯度稀释,将稀释的核酸基因DNA放入配制好的多重PCR反应体系,分析扩增出的多重敏感性试验结果图,并分析得出方法的最低检测限。
1.4 临床样本的应用
将山东各地采集的128份沙门氏菌临床样本,接种到蛋白胨缓冲水中37 ℃培养24 h[5]。利用建好的多重PCR方法对128份沙门氏菌临床样本进行检测。
1.5 多重PCR方法准确性验证
采用单一PCR法对沙门氏菌临床样本进行检测,将得到的检测结果与多重PCR法的检测结果进行比较,从而验证本试驗方法的准确性。
2 结果与分析
2.1 单重模板PCR扩增结果
使用相对应的引物分别对4种沙门氏菌进行扩增。由图1可知,扩增后的DNA片段大小和预期结果完全一致,证明了各组引物对靶基因检测的可行性。
2.2 多重PCR方法建立及条件优化
在单重模板扩增试验结果的的基础上,对多重PCR方法可行性进行验证。由图2可知,试验条带与目的条带大小一致,由此证明该方法对4种目的基因检测的可行性。为实现各个目的条带检测效率最佳,本试验对各组引物浓度和温度的条件进行优化,由图3和图4可分析得出,肠炎沙门氏菌、鸡白痢沙门氏菌、伤寒沙门氏菌、鼠伤寒沙门氏菌最佳的上下游引物浓度分别是0.28、0.28、0.20、0.24 μmol/L。最终的反应条件为:94 ℃预变性 2 min;98 ℃变性10 s,64 ℃退火90 s,扩增循环数为30个循环。
2.3 多重PCR特异性和敏感性试验结果
在最佳的引物比例条件下,对本试验所建多重PCR方法的特异性进行验证。由图5可知, 只有鼠伤寒沙门氏菌+肠炎沙门氏菌+伤寒沙门氏菌+鸡白痢沙门氏菌的混合模板DNA及鼠伤寒沙门氏菌DNA、肠炎沙门氏菌DNA、伤寒沙门氏菌DNA、鸡白痢沙门氏菌DNA出现条带,而非沙门氏菌的基因DNA不发生扩增反应,证明了该方法具有较强的特异性,可以实现沙门氏菌复杂血清型的分离分辨。由图6可知,多重PCR反应体系对混合模板DNA的最低检测限分别是:鸡白痢沙门氏菌 13.1 pg/mL;肠炎沙门氏菌 12.5 pg/mL;鼠伤寒沙门氏菌13.7 pg/mL;伤寒沙门氏菌12.3 pg/mL。因此,在检测过程中只需要少量的临床组织病料样品即可检测出是否感染相关的沙门氏菌血清型。
2.4 临床样本检测结果
利用建好的多重PCR法对128份沙门氏菌阳性样本进行鉴定,部分临床样本检测结果见图7,检测出肠炎沙门氏菌78.0%,鸡白痢沙门氏菌3.9%,伤寒沙门氏菌0.8%,鼠伤寒沙门氏菌1.6%,其他占15.7%。
2.5 多重PCR准确性验证结果
单重PCR法对沙门氏菌临床样本进行扩增,结果见图8至图11。对2种方法的检测结果进行比较(表4),可以看出2种检测方法的结果完全一致。因此,本试验所用的多重PCR检测法准确性较高。
3 讨论
沙门氏菌可导致人畜共患的细菌性疾病。禽类感染沙门氏菌后不但对自身健康造成影响,使得生产力下降;还会通过禽类食品传播给人[9],要想控制沙门氏菌,建立有效检测方法是很关键的环节。有研究报道,鸡白痢、肠炎、伤寒及鼠伤寒这4种沙门氏菌血清型不但常见多发且对养殖业危害较大[2]。因此,建立相关沙门氏菌的检测鉴别方法具有实际应用意义。
PCR检测沙门氏菌具有简单、快速、灵敏等优点,特别是多重PCR检测技术,相比普通的单重PCR,可实现多通量的靶基因检测[10]。目前,沙门氏菌血清型的检测大多数是基于三重PCR检测技术,而四重PCR法鉴别沙门氏菌血清型的报道却相对较少。龚建森在禽源沙门氏菌的分析筛选研究报道中,利用三重PCR法鉴别肠炎、伤寒、鼠伤寒沙门氏菌[11]。而本研究则是采用四重PCR法鉴别鸡白痢、肠炎、伤寒以及鼠伤寒这4种沙门氏菌。
在李红等关于禽沙门氏菌多重PCR检测方法的建立与应用的研究过程中,证实了多重PCR检测技术具有特异性好、准确性高、灵敏度强的特点[5]。本试验的结果也同样验证了此方法具备这些优点。因而,本试验的检测方法可完成实验室和规模化养殖场对沙门氏菌的检测鉴别。
但多重PCR技术也有不足之处,如会对试验结果产生消极影响的引物二聚体、各组引物扩增效率不一样[12]等问题。想要解决这些问题,让多重PCR检测技术更好地应用于各种病原体的检测,是日后试验研究的重点。
4 结论
本研究建立了一种检测鉴别鸡白痢、肠炎、鼠伤寒、伤寒这4种沙门氏菌的多重PCR检测方法,用于筛查实际生产中出现的这4种沙门氏菌。通过试验表明,此方法具备准确可靠、特异性强、灵敏度高等优点,可完成实际生产中相关沙门氏菌的监测。
参考文献:
[1]Lim H,Lee K H,Hong C H,et al. Comparison of four molecular typing methods for the differentiation of Salmonella spp.[J]. International Journal of Food Microbiology,2005,105(3):411-418.
[2]Wang X,Wang H,Li T,et al. Characterization of Salmonella spp. isolated from chickens in central China[J]. BMC Veterinary Research,2020,16(1):299.
[3]李劲锋,罗 铭,张耀平. 沙门氏菌检测技术现状及进展[J]. 医学动物防制,2020,36(10):953-956.
[4]Davies R,Breslin M,Corry J E,et al. Observations on the distribution and control of Salmonella species in two integrated broiler companies[J]. The Veterinary Record,2001,149(8):227-232.
[5]李 红,刘成倩,孙凤萍,等. 禽沙门菌多重PCR检测方法的建立与应用[J]. 上海畜牧兽医通讯,2019(4):18-21.
[6]董 蕾,黄晓波,刘静璇. 多重PCR技术在食品检测中的应用与展望[J]. 安徽农业科学,2020,48(11):15-18.
[7]Salvat G,Guyot M,Salmonella P M,et al. Escherichia coli and Staphylococcus aureus in traditional free-range‘Abel rougebroiler production:a 23-year survey programme[J]. Journal of Applied Microbiology,2016,122(1):248.
[8]Threlfall E J. Antimicrobial drug resistance in Salmonella:problems and perspectives in food-and water-borne infections[J]. FEMS Microbiology Reviews,2002,26(2):141-148.
[9]劉红云,许世富,张 莉,等. 饲料中沙门氏菌的快速检测方法及预防措施[J]. 现代农业科技,2020(14):205,207.
[10]钟泽澄,王进,张师音. 多重PCR技术研究进展[J]. 生物工程学报,2020,36(2):171-179.
[11]龚建森,庄林林,陆光武,等. 禽源沙门菌多重PCR检测方法的建立与应用[J]. 中国家禽,2016,38(4):14-18.
[12]郑玉玺,韩 明,李崇高,等. 3种血清型沙门氏菌多重PCR检测方法的建立[J]. 食品安全质量检测学报,2020,11(3):866-874.

