复合氨基酸锌、铁螯合物的制备及抗菌和抗氧化性研究
苏永成,丁志雯,武波飞,陈静雯,张唯,张弘彧,房耀维 ,2,刘姝,2*
(1.江苏海洋大学食品科学与工程学院,江苏 连云港 222005;2.江苏省海洋资源开发研究院,江苏 连云港 222000)
氨基酸是生物体内大量存在的,同时具有氨基和羧基的双官能团生命小分子配体,是构成生物体内蛋白质、酶的基本结构单元,能够为生物体提供生长发育所需要的养分[1-2]。同时氨基酸也是一种具有氨基与羧基的天然小分子有机酸,具有多种特殊官能基团和多样的结构,因此氨基酸在精细化工、医药、食品等领域有着广泛的应用。锌主要参与生物的生长、繁殖、免疫、发育、激素合成及机体的新陈代谢等,是保证组织、器官和系统正常功能的重要的微量元素[3-4]。铁是血红蛋白合成和维持机体正常生理机能所必需的微量元素。人体内缺乏锌和铁元素,会影响脑垂体和肾上腺的内分泌平衡,导致发育停滞、智力发育不良、贫血等病症[5]。氨基酸螯合物是指利用金属阳离子与氨基酸进行反应并形成配位键,并且金属阳离子与氨基端和羧基端形成五元环或六元环等特殊的环状分子结构,使得整个环状分子内趋于电中性[6]。氨基酸锌和氨基酸铁作为人和动物的锌、铁补充剂,生物利用率高,在补充的锌、铁的同时还能补充氨基酸,因此,广泛用于人体的锌、铁营养强化剂和饲料添加剂[7]。另外,氨基酸锌和氨基酸铁具有抗氧化和抗菌活性,用于食品的保鲜,延长食品的货架期[8]。
水果和蔬菜采收后,由于微生物导致的腐败而造成了巨大损失。目前,我国果蔬的腐烂损失率在20%左右[9]。使用抗生素和化学保鲜剂可显著延长果蔬货架期,但是存在高残留、不易降解、导致细菌耐药增加、危害公共卫生安全等问题[10]。氨基酸锌和氨基酸铁绿色安全,在具有食品保鲜功能的同时,又具有营养强化功能,在果蔬保鲜方面极具应用潜力[11]。目前果蔬保鲜常采用涂膜保鲜,在果蔬表面形成一层薄膜,可以阻止微生物对果蔬的侵害,降低果蔬呼吸强度,延缓果蔬的生理代谢活动和营养的损失,达到延长果蔬货架期的目的。但是,目前对复合氨基酸锌和氨基酸铁的抗菌活性和抗氧化活性的系统研究尚鲜有报道。
本研究以人体必需8种氨基酸作为配体,采用水体系合成法制备复合氨基酸锌和复合氨基酸铁,水体系合成法是螯合方法中最常用的一种方法,其螯合工艺一般为:氨基酸+金属盐→溶解→调节pH值→螯合→过滤→滤渣干燥→产品。并测定复合氨基酸锌和复合氨基酸铁对引起果蔬腐败中常见细菌、酵母菌和霉菌的抗菌活性和DPPH·、O2-·、·OH的清除能力,为复合氨基酸锌和复合氨基酸铁作为果蔬保鲜剂的应用研究奠定基础。
1 材料与方法
1.1 材料与试剂
蜡样芽孢杆菌(Bacillus cereus AS1.1846)、金黄色葡萄球菌(Staphylococcus aureus AS1.2465)、大肠杆菌(Escherichia coli AS1.487)、黑曲霉(Aspergillus niger AS3.350)、酿酒酵母(Sacc haromyces cerevisiaeAS2.114)、扩展青霉(Penicillium expansum AS3.3703):中国普通微生物菌种保藏中心;黄曲霉(Asper-gillus flavus)、枯草芽孢杆菌(Bacillus subtilis AS1.140):南京农业大学食品科技学院实验室保藏;长形赖氨酸芽孢杆菌(Lysinibacillus macroides)、铜绿假单胞菌(Pseudomonas aeruginosa)、鲁氏结合酵母(Zygosaccharomyces rouxii):江苏海洋大学海洋微生物酶工程研究室分离保藏。
复合氨基酸(L-赖氨酸、L-色氨酸、L-苯丙氨酸、L-甲硫氨酸、L-苏氨酸、L-异亮氨酸、L-亮氨酸、L-缬氨酸):上海易恩化学技术有限公司;七水合硫酸锌、七水合硫酸亚铁、氢氧化钠、无水乙醇、冰乙酸(均为分析纯):南京化学试剂股份有限公司;DPPH试剂:上海阿拉丁生化科技股份有限公司;抗坏血酸:国药集团化学试剂有限公司;羟基自由基试剂盒、超氧阴离子自由基试剂盒:南京建成生物工程研究所。
LB 培养基(1 L):蛋白胨 10 g,酵母粉 5 g,氯化钠10 g,蒸馏水 1000 mL,pH 7.0,121 ℃ 灭菌 20 min;PD 培养基(1 L):马铃薯 200 g,葡萄糖 20 g,蒸馏水1 000 mL,自然pH值,121℃灭菌30 min。
1.2 仪器与设备
DHG-9245A型鼓风干燥箱:上海易研实验设备有限公司;iMark型酶标仪:伯乐生命医学产品(上海)有限公司;DK-80型电热恒温水槽、THZ-103B型恒温培养摇床:上海一恒科学仪器有限公司;T6新世纪紫外分光光度计:北京普析通用仪器有限责任公司;AA240FS原子吸收分光光度计:美国瓦里安公司。
1.3 方法
1.3.1 复合氨基酸锌和复合氨基酸铁的制备
复合氨基酸锌和复合氨基酸铁制备工艺参考文献[12-14]等报道的制备方法并加以改进。分别称取适量复合氨基酸(L-赖氨酸、L-色氨酸、L-苯丙氨酸、L-甲硫氨酸、L-苏氨酸、L-异亮氨酸、L-亮氨酸、L-缬氨酸,复合氨基酸浓度为0.1 mol/L),加入到蒸馏水中,加热搅拌使其完全溶解,得到饱和溶液。按照摩尔比2∶1与硫酸锌或者硫酸铁(浓度为0.05 mol/L)混合,用6 mol/L氢氧化钠或1 mol/L硫酸调节溶液酸碱度,pH7.0~7.5,在75℃水浴下螯合1 h。5 000 r/min离心10 min后,收集沉淀。采用有机溶剂沉淀法分离螯合物,按照螯合浓缩液∶有机溶剂1∶10的体积比加入无水乙醇,5 000 r/min离心10 min后收集沉淀,在60℃干燥箱中烘干,得到复合氨基酸锌和复合氨基酸铁。
1.3.2 锌、铁元素的测定
配制不同浓度的锌和铁标准溶液,将锌和铁标准溶液按照质量浓度由低到高的顺序分别导入火焰原子化器,制作标准曲线;将复合氨基酸锌和复合氨基酸铁溶解,将空白溶液、复合氨基酸锌溶液和复合氨基酸铁溶液分别导入火焰原子化器,测得金属离子的含量[15]。螯合率计算公式如下。
螯合率/%=(螯合态金属离子含量/金属离子总含量)×100
1.3.3 菌悬液的制备
将受试菌进行斜面活化后,用接种环挑取菌体,通过无菌生理盐水稀释,调整菌液浓度为1×107cfu/mL。
1.3.4 复合氨基酸锌和复合氨基酸铁抗菌活性的测定
参照Dubey等[16]所述的试管二倍稀释法,稍作修改,进行各受试样品最小抑菌浓度(minimum inhibitory concentration,MIC)的测定。样品为复合氨基酸、复合氨基酸锌和复合氨基酸铁,在无菌操作台中对试管按1~8号依次编号,首先在每支试管中加入3 mL无菌LB或PD液体培养基,在1号管加入3 mL样品溶液,充分混匀后吸取3 mL加入2号管中混匀,按照此法依次稀释到6号管,弃去6号管溶液3 mL,此时各试管中样品浓度依次为 2.5、1.25、0.625、0.312 5、0.156 25、0.078 125 mg/mL,接下来每个试管依次加入菌悬液0.1 mL。7号管加入0.1 mL菌悬液,不加样品液作为阳性对照管。8号管不加样品液也不加菌悬液作为阴性对照管。细菌37℃振荡培养1 d,酵母菌30℃振荡培养1 d,霉菌28℃振荡培养2 d。每一浓度梯度做3组平行试验,以阳性对照管液体浑浊、阴性对照管液体澄清为标准,观察试管液体是否为透明。再利用酶标仪在600 nm波长下检测细菌和酵母菌在不同浓度梯度样品中的生长情况,综合肉眼观察得到的结果,最终判定MIC。
1.3.5 复合氨基酸锌和复合氨基酸铁抗氧化性的测定
1.3.5.1 DPPH自由基清除能力测定
采用DPPH比色法进行测定[17-18]。样品为复合氨基酸锌和复合氨基酸铁,取离心管3支,编号1~3,1号管加2 mL样品溶液和2 mL 0.1 mmol/L DPPH溶液,振荡混匀后,暗处、室温25℃条件下静置反应30 min,测OD517,记作A1;2号管加2 mL样品溶液和2 mL无水乙醇混匀,测OD517,记作A2;3号管加2 mL无水乙醇和2 mL 0.1 mmol/L DPPH 溶液混匀,测OD517,记作A3。以不同质量浓度的VC水溶液作阳性对照,吸取不同浓度样品溶液均按以上操作分别测定DPPH自由基清除能力。自由基清除率/%=[1-(A1-A2)/A3]×100。
1.3.5.2 超氧阴离子自由基(O2-·)和羟基自由基(·OH)的清除能力测定
吸取不同质量浓度的复合氨基酸锌和复合氨基酸铁溶液,采用羟基自由基试剂盒和超氧阴离子自由基试剂盒的方法,分别测定其自由基清除能力。计算自由基清除率[19]。
1.4 数据处理
使用SPSS 24.0软件进行差异性显著分析,利用Origin 2018软件进行数据处理及绘图。
2 结果与分析
2.1 复合氨基酸锌和复合氨基酸铁螯合率的测定
复合氨基酸锌、复合氨基酸铁的螯合率见表1。

表1 复合氨基酸锌、复合氨基酸铁的螯合率Table 1 Chelation rates of compound amino acid zinc and compound amino acid iron
由表1可知,复合氨基酸锌中锌含量占12.83%,螯合率为81.27%。复合氨基酸铁中铁含量为11.29%,螯合率为68.19%。周燕芳等[20]报道使用中性蛋白酶对鱼蛋白粉进行酶解,以酶解后得到的氨基酸与锌离子标准溶液螯合制备复合氨基酸锌,所得螯合率为83.58%。也有报道以花生粕为原料制备复合氨基酸螯合锌,螯合率83.46%[21]。廉宜君等[22]利用棉籽粕复合氨基酸与氯化亚铁进行螯合制备复合氨基酸铁螯合物,螯合率为73.76%。螯合率的不同可能是因为氨基酸与金属离子配位比、体系pH值、螯合反应温度及时间等因素有关。
2.2 复合氨基酸锌和复合氨基酸铁抗菌活性的测定分析
通过试管二倍稀释法测定了复合氨基酸、复合氨基酸锌、复合氨基酸铁对细菌、酵母菌和霉菌的MIC,结果见表2。
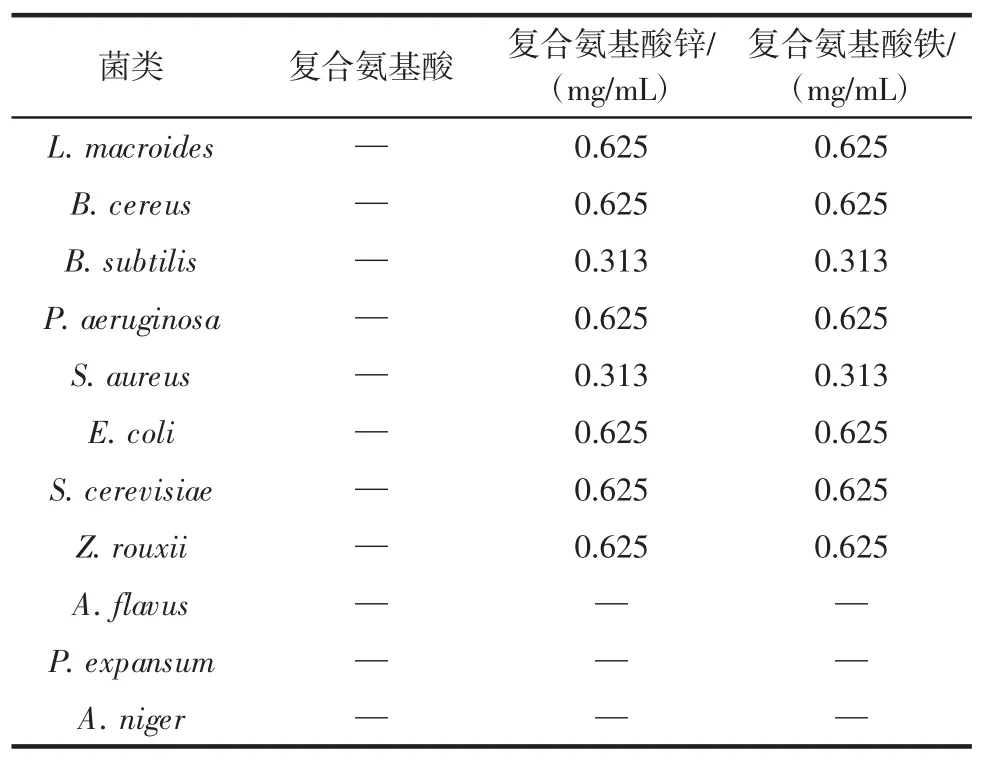
表2 复合氨基酸、复合氨基酸锌、复合氨基酸铁的MIC值Table 2 MIC values of compound amino acid,compound amino acid zinc and compound amino acid iron
由表2可知,复合氨基酸对供试菌无显著抗菌作用。复合氨基酸锌和复合氨基酸铁对B.subtilis、S.aureus均有较好的抗菌效果,MIC均为0.313 mg/mL,二者 对 L.macroides、B.cereus、P.aeruginosa、E.coli、Z.rouxii、S.cerevisiae的 MIC均为 0.625 mg/mL。对 A.flavus、P.expansum、A.niger无显著抗菌作用。吴菁[23]研究发现复合氨基酸铁、复合氨基酸锌对S.aureus、E.coli的生长有抑制作用,对S.aureus的MIC分别为0.25、0.25 mg/mL,对E.coli的 MIC分别为0.5、0.5 mg/mL。对S.aureus、E.coli的MIC与本文研究结果相比略低,这可能是因为不同螯合物中锌、铁含量不同导致的结果。龚毅等[24]研究报道甘氨酸锌、苏氨酸锌、蛋氨酸锌和赖氨酸锌对E.coli、B.subtilis、S.aureus具有抗菌活性。甘氨酸锌、苏氨酸锌、蛋氨酸锌和赖氨酸锌对E.coli的MIC 分别为 0.176、0.253、0.272、0.373 mg/mL,对B.subtilis的 MIC 分别为 0.176、0.253、0.272、0.373 mg/mL,对S.aureus的MIC分别为0.176、0.253、0.272、0.373mg/mL。
2.3 复合氨基酸锌和复合氨基酸铁对DPPH自由基清除能力
复合氨基酸锌和复合氨基酸铁对DPPH自由基清除能力结果见图1。
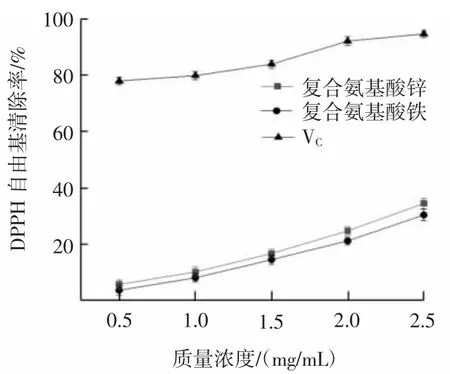
图1 复合氨基酸锌、复合氨基酸铁对DPPH自由基的清除率Fig.1 Scavenging rates of compound amino acid zinc and iron on DPPH radical
由图1可以看出,复合氨基酸锌和复合氨基酸铁对DPPH自由基清除率随着浓度的增加而增大。质量浓度在0.5 mg/mL~2.5 mg/mL时,复合氨基酸锌对DPPH自由基清除率由5.79%提高到34.52%,复合氨基酸铁对DPPH自由基的清除率由3.75%提高到30.46%。
2.4 复合氨基酸锌、复合氨基酸铁对超氧阴离子自由基和羟基自由基的清除能力
复合氨基酸锌、复合氨基酸铁对超氧阴离子自由基和羟基自由基的清除能力结果见图2和图3。
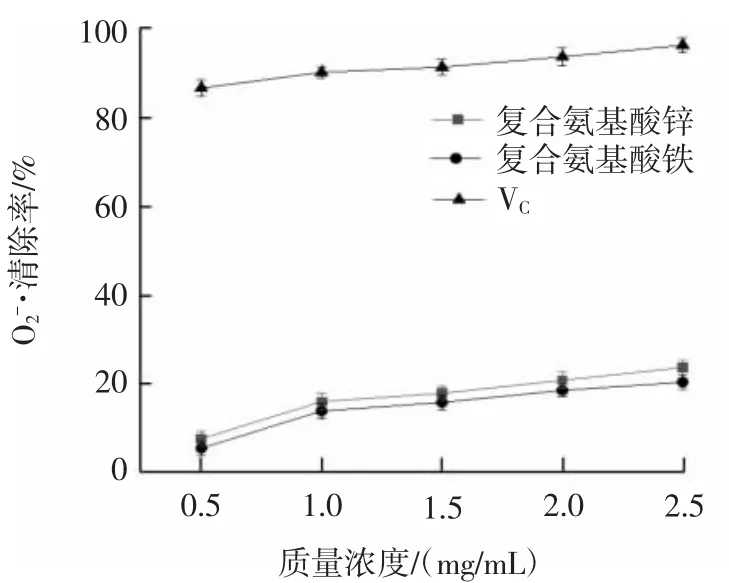
图2 复合氨基酸锌、复合氨基酸铁对超氧阴离子自由基的清除率Fig.2 Scavenging rates of compound amino acid zinc and iron on superoxide radical
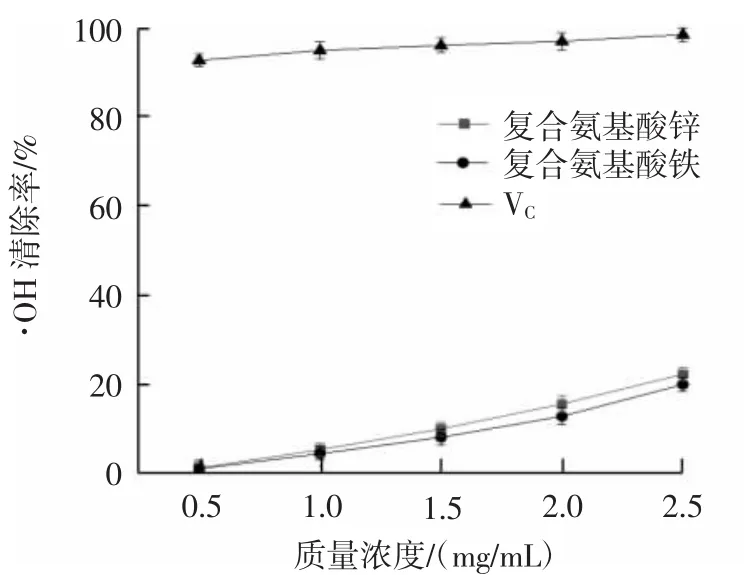
图3 复合氨基酸锌、复合氨基酸铁对羟基自由基的清除率Fig.3 Scavenging rates of compound amino acid zinc and iron on hydroxyl radical
由图2和图3可知,复合氨基酸锌、复合氨基酸铁对超氧阴离子自由基和羟基自由基有一定的清除能力,质量浓度在0.5 mg/mL~2.5 mg/mL范围内,其清除能力逐渐增强。质量浓度为2.5 mg/mL时,复合氨基酸锌对超氧阴离子自由基和羟基自由基清除率达到23.93%和22.36%,复合氨基酸铁对超氧阴离子自由基和羟基自由基清除率达到20.63%和20.05%,与VC比较而言,复合氨基酸锌、复合氨基酸铁对超氧阴离子自由基和羟基自由基清除能力相对较弱。
3 结论
本研究制备了复合氨基酸锌和复合氨基酸铁,螯合率分别达到81.27%和68.19%。测定了复合氨基酸锌和复合氨基酸铁对供试细菌、酵母菌和霉菌的抗菌活性,复合氨基酸锌和复合氨基酸铁对细菌和酵母菌具有抗菌活性,其中对B.subtilis、S.aureus的抑制作用最明显,MIC均为0.313 mg/mL,而对霉菌的抗菌作用不显著。复合氨基酸锌和复合氨基酸铁对DPPH自由基、超氧阴离子自由基和羟基自由基均具清除作用,对DPPH自由基的清除作用最好,复合氨基酸锌和复合氨基酸铁的抗氧化能力弱于VC。

