气相色谱-质谱法测定葛根和丹参提取回收乙醇中5种挥发性杂质含量
辜俊鑫,史谢飞,李 斌,张学霞
(1.北京同仁堂科技发展成都有限公司,四川 成都610100;2.中国测试技术研究院,四川 成都610021)
药品和药用溶剂中有机挥发性杂质的潜在危害已逐渐被重视,控制其含量是目前国内新药研发的关键制约因素[1]。药用乙醇为常见溶剂,常用于药品有效成分的提取。使用新乙醇提取时,用量大,药材提取成本高;连续使用回收乙醇又可能致残留的挥发性杂质对提取产品造成污染风险。药品及药用辅料中挥发性杂质多采用溶解后直接进样分析[2-5]或顶空进样分析[6-10]。回收乙醇中挥发性杂质的种类及含量受影响因素较多,存在较多不确定性,气相色谱-质谱联用(GC-MS)[11-12]法更有利于成分定性和定量分析。本研究中建立了测定葛根和丹参提取回收乙醇中挥发性杂质甲醇、苯、乙醛、乙缩醛、4-甲基-2-戊醇含量的方法,以期为确定回收乙醇的使用周期或循环使用次数提供客观依据,达到既降低成本又能确保药品质量的目的。现报道如下。
1 仪器与试药
1.1 仪器
R501型旋转蒸发器(巩义市英峪仪器厂);6890N-5973inert型气相色谱质谱联用仪(美国安捷伦公司);BP211D型电子天平(德国赛多利斯公司,精度为十万分之一);XW-80A型涡旋混合仪(上海驰唐电子公司)。
1.2 试药
乙醇(药用级,新乡市先丰医药新材料有限公司,批号为F-01-190301);乙醛对照品(美国Fluka公司,纯度为99.5%);苯对照品(天津市化学试剂研究厂,纯度为99.9%);乙缩醛对照品(天津市光复精细化工研究所,纯 度 为98.0%);乙 腈、甲 醇 对 照 品(Sigma-ALDRICH,纯度为99.9%);4-甲基-2-戊醇对照品(北京坛墨质检科技有限公司,纯度为99.5%);丹参(批 号 为Z-24-190201),葛 根(批 号 为Y-01-190301),均购于北京同仁堂科技发展成都有限公司。
2 方法与结果
2.1 色谱条件
色谱柱:AgilentDB-624UI柱(60m×250μm,1.4μm);载气:氦气(纯度≥99.999%);流速:1.0 mL/min;分流比:10∶1;进样口温度:230℃;检测器:质谱仪;离子化能量:70 eV;溶剂延迟时间:4.4 min;柱温:程序升温,40℃保持10 min,以5℃/min的速率升至120℃,再以40℃/min的速率升至220℃并保持3 min;扫描方式:离子监测,乙醛选择离子比(丰度比)为44∶42∶43(100∶20∶52),苯选择离子比(丰度比)为78∶51∶77(100∶14∶22),乙缩醛选择离子比(丰度比)为45∶73∶103(100∶79∶28),甲醇选择离子比(丰度比)为31∶30∶32(100∶20∶52),4-甲基-2-戊醇选择离子比(丰度比)为45∶69∶87(100∶33∶10)。
2.2 样品及溶液制备
样品制备:实验室分别用药用乙醇模拟提取葛根和丹参药材,提取溶剂倍数、提取时间、提取温度、提取乙醇浓度均与生产工艺一致,只是同比例缩小提取量。提取完全后过滤、减压浓缩得回收乙醇,再使用回收乙醇作为下次药材的提取溶剂,回收乙醇在回收过程会有损失,在提取下次的药材时按回收乙醇的体积同比例缩小,如此反复操作至回收乙醇体积过少无法进行提取为止。
对照品单标贮备液:取乙醛、苯、乙缩醛、甲醇、4-甲基-2-戊醇对照品各适量,精密称定,分别置10 mL容量瓶中,用乙腈定容至刻度,保存于-4℃冰箱中备用。
对照品混标贮备液:分别移取适量乙醛、苯、乙缩醛、甲醇、4-甲基-2-戊醇单标贮备液,置10 mL容量瓶中,制成乙醛质量浓度为200 mg/L,苯质量浓度为40 mg/L,乙缩醛质量浓度为200 mg/L,甲醇质量浓度为4 000 mg/L,4-甲基-2-戊醇对照品质量浓度为6 000 mg/L的对照品混标贮备液,保存于-4℃冰箱中备用。
供试品溶液:取5 mL回收乙醇样品,置10 mL容量瓶中,加乙腈定容,混匀,即得。
混合对照品溶液:取对照品混标贮备液250 μL,加乙腈定容,混匀,作为对照品溶液,即乙醛质量浓度为5 mg/L,苯质量浓度为1 mg/L,乙缩醛质量浓度为5 mg/L,甲醇质量浓度为100 mg/L,4-甲基-2-戊醇质量浓度为150 mg/L。
对照品加供试品溶液:准确移取5 mL回收乙醇样品,置10 mL容量瓶中,加上述对照品混标贮备液250 μL,再加乙腈定容,混匀,即得。
2.3 方法学考察
系统适用性试验:分别取乙腈(作为空白溶剂),2.2项下供试品溶液、混合对照品溶液、对照品加供试品溶液适量,按2.1项下色谱条件进样分析。结果空白溶剂和供试品溶液中其他化合物均不干扰待测物的测定,且混合对照品溶液和对照品加供试品溶液中待测物的保留时间一致,定量离子对比例和定性离子对的丰度比例一致,表明方法专属性符合要求。详见图1。

图1 气相色谱-质谱图1.acetaldehyde 2.methanol 3.benzene 4.acetal 5.4-methyl-2-pentanolA.Blank solvent B.Test solution C.Mixed reference solution D.Reference and test solutionFig.1 GC-MS spectrum
线性关系考察:分别移取乙醛、苯、乙缩醛、甲醇、4-甲基-2-戊醇单标贮备液适量,用乙腈配制成乙醛质量浓度分别为10.0,7.5,6.0,5.0,4.0,2.5,1.0 mg/L,苯 质 量 浓 度 分 别 为2.0,1.5,1.2,1.0,0.8,0.5,0.2 mg/L,乙缩醛质量浓度分别为10.0,7.5,6.0,5.0,4.0,2.5,1.0 mg/L,甲醇质量浓度分别为40,30,24,20,16,10,4 mg/L,4-甲基-2-戊醇质量浓度分别为60,45,36,30,24,15,6 mg/L的系列对照品标准溶液。取溶液适量,注入GC-MS分析仪,每个质量浓度进样1次,共进7个点。以目标化合物的质量浓度(X,mg/L)为横坐标、定量离子峰面积(Y)为纵坐标进行性回归,并计算相关系数(r)。结果见表1。

表1 线性关系考察、检测限、定量限试验结果Tab.1 Results of linear relation test,LOD and LOQ
检测限和定量限确定:将不同质量浓度的对照品标准溶液注入GC-MS仪分析,以信噪比(S/N)为3时对应的质量浓度为检测限,S/N为10时对应的质量浓度为定量限。结果见表1。
精密度试验:取2.2项下混合对照品溶液适量,按2.1项下色谱条件连续进样6次。结果乙醛、苯、乙缩醛、甲醇、4-甲基-2-戊醇的RSD分别为3.35%,3.43%,4.02%,2.85%,2.19%(n=6),表明仪器精密度良好。
重复性试验:取2.2项下对照品加供试品溶液6份,分别注入GC-MS仪测定。结果乙醛、苯、乙缩醛、甲醇、4-甲基-2-戊醇的RSD分别为3.46%,4.97%,4.66%,2.17%,0.55%(n=6),表明方法重复性良好。
稳定性试验:取2.2项下对照品加供试品溶液,分别于0,2,5,8,16,24 h时注入GC-MS仪测定。结果对照品加供试品溶液冷藏放置24 h内无其他杂质峰生成,乙醛、苯、乙缩醛的RSD均小于6%(n=6),甲醇、4-甲基-2-戊醇的RSD均小于3%(n=6),表明对照品加供试品溶液在24 h内稳定性较好。
加样回收试验:取已知各化合物含量的回收乙醇,加入2.2项下混合对照品溶液,各化合物均平行6份,分别注入GC-MS仪测定,计算回收率。结果乙醛、苯、乙缩醛、甲醇、4-甲基-2-戊醇的平均回收率分别为89.56%,94.71%,94.85%,95.20%,91.41%,RSD分别为4.25%,5.08%,4.45%,2.18%,0.76%(n=6)。
2.4 样品含量测定
取样品适量,依法制备供试品溶液,按拟订色谱条件进样测定各杂质的含量。结果见表2。
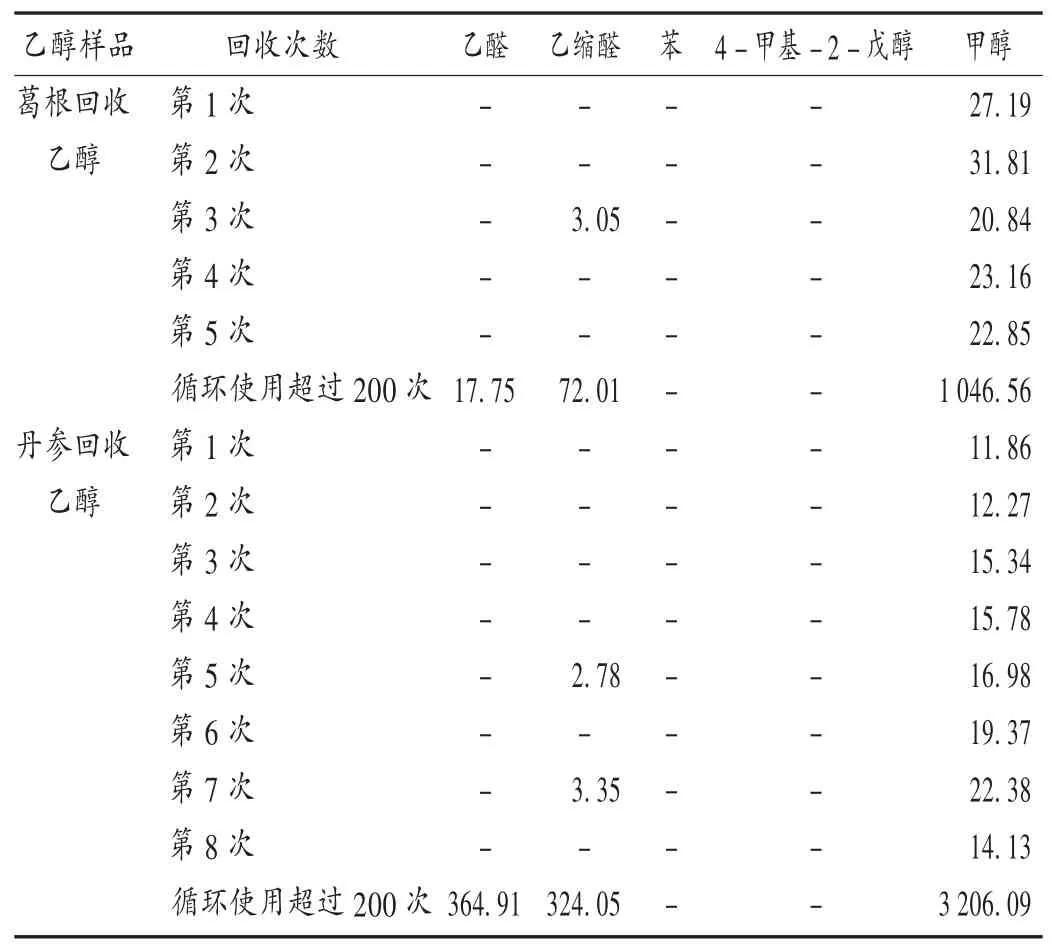
表2 回收乙醇样品中各挥发性杂质含量测定结果(%)Tab.2 Determination of volatile impurities in recyeled ethanol samples(%)
3 讨论
由表2可知,回收乙醇中未检出苯和4-甲基-2-戊醇;检出乙醛、乙缩醛和甲醇,且随回收乙醇使用次数的增加而增加,呈富集趋势。循环使用超过200次的回收乙醇中乙醛、乙缩醛、甲醇均已超过药典对药品溶剂残留限度的规定,不符合药品质量要求,可能会给药品质量造成风险。
本研究采用GC-MS法分析,发现除甲醇、乙醛、乙缩醛、苯、4-甲基-2-戊醇5种挥发性杂质外,还有其他多种挥发性杂质。挥发性杂质种类多少和含量高低除与药材直接相关外,也受生产过程中提取时间、提取温度、回收温度等环节影响。因此,回收乙醇中挥发性杂质的种类及含量复杂多变,具有不确定性。为确保药品质量,应制订回收乙醇的使用周期或循环使用次数。可先暂定一个使用周期或循环使用次数,期间多次检测挥发性杂质,收集和积累数据,分析回收乙醇中挥发性杂质的含量和变化趋势,并结合挥发性杂质在产品中的残留情况,综合考虑并最终确定该品种回收乙醇的使用周期或循环使用次数。
方法学考察结果表明,所建立方法的回收率、精密度、重复性试验结果均符合2020年版《中国药典(四部)》[13]分析方法验证指导原则中相关规定,能确保回收乙醇分析结果的准确性与客观性。因本次提供的样本及测定杂质种类有限,不能全面分析葛根和丹参提取回收乙醇中挥发性杂质的含量和变化趋势,但对药品生产中类似回收乙醇的使用具有指导意义。

