载药聚乳酸支架制备及其用于抑制肌腱粘连的可行性研究
曾嘉梅,黄 晨
(东华大学 纺织面料技术教育部重点实验室,上海 201620)
研究表明[1],在肌腱损伤的患者中,有7%~15%的患者在愈合初期会出现疤痕愈合、肌腱粘连和关节运动受限等并发症。在这些患者中,多达10%的患者需要进行二次手术。渐进性愈合的肌腱与周围组织粘连,将导致肌腱功能受损,肌腱损伤治疗成本增大。造成肌腱粘连的主要原因是,在肌腱损伤愈合过程中,成纤维细胞从周围组织长入肌腱断端,同时肌腱断端出现炎症反应并机化[2]。
肌腱的内源性愈合和外源性愈合同时进行:内源性愈合表现为肌腱细胞的自我增殖、细胞外基质(ECM)的形成;外源性愈合则表现为成纤维细胞从周围腱鞘和滑膜中长入肌腱断端,生成肉芽,形成瘢痕愈合[3]。肌腱的内源性愈合能力比外源性愈合能力弱[4],这是因为,肌腱组织中的血管和神经等固有结构少,导致组织代谢活性低、肌腱细胞的密度低[5]。当肌腱受到严重损伤时,外源性愈合会破坏内源性愈合且占据主导地位。因此,减少外源性愈合,增进内源性愈合,减轻炎症,阻止成纤维细胞过度增殖,并使肌腱的滑动功能恢复正常,是抑制肌腱粘连的关键。
静电纺纳米纤维膜由于可以模拟腱鞘的微观结构[6,7],易于制备和功能化[8],因此广泛用作抑制肌腱粘连膜。有研究人员[9,10]以聚乳酸纳米纤维膜为物理屏障,把肌腱与周围组织分隔开,减少腱周成纤维细胞的增殖和渗透,阻断外源性愈合,在抑制肌腱粘连方面取得一定效果。但是巨噬细胞浸润和聚乳酸降解导致的局部酸性环境,会引发炎症反应。陈华等人[11]研究了载布洛芬PLLA纳米纤维膜作为抗粘连膜的疗效和机制,发现相对不载药PLLA纳米纤维膜,载布洛芬PLLA纳米纤维膜能更好地抑制成纤维细胞黏附及增殖,且体内的炎症细胞浸润评分和粘连组织评分更低,说明布洛芬可以减少创伤和材料降解导致的炎症反应,并减少血管和炎性细胞浸润,进而抑制肌腱粘连。
针对纳米纤维膜拉伸性能差、植入动物体内后易发生拉伸断裂[12],纳米纤维间孔隙较小不利于营养物质的运输和代谢废物的排出[13],将布洛芬直接加入纺丝液中纺丝易造成药物被聚合物包裹无法发挥疗效[14]等问题,本研究采用动态水浴涡流加捻装置制备基于纳米纤维束集合体的聚乳酸(PLLA)组织工程支架,利用PLLA极佳的吸油性能[15],通过动态水浴载入油性药物布洛芬,高效可控。制备的支架不仅拉伸性能较好、具有大孔结构,而且体外实验结果证明,随着布洛芬的缓释,小鼠胚胎成纤维细胞(NIH-3T3)的黏附和增殖被有效抑制,载布洛芬支架具有用于抑制肌腱粘连的可行性。
1 试验部分
1.1 载布洛芬支架的制备
配制浓度为12wt%的PLLA纺丝液,将一定量的PLLA颗粒溶解在体积比为9∶1的DCM/DMSO双组份溶剂中,随后在恒温磁力搅拌器下搅拌24 h,实验过程如图1所示。将配制好的纺丝液注入连接21号针头的10 mL注射器中,并安装到推进泵上,设置挤出速度为1.0 mL/h,纺丝电压为15 kV,接收滚筒的转速为100 rpm,调节针头到接收水浴表面的距离为10 cm。分别将5 g、10 g的油性药物布洛芬滴加进液体总体积为10 L动态水浴中,在恒温恒湿(25±2℃,50±5%)的条件下制备不同布洛芬浓度的、基于纳米纤维束集合体的PLLA组织工程支架。
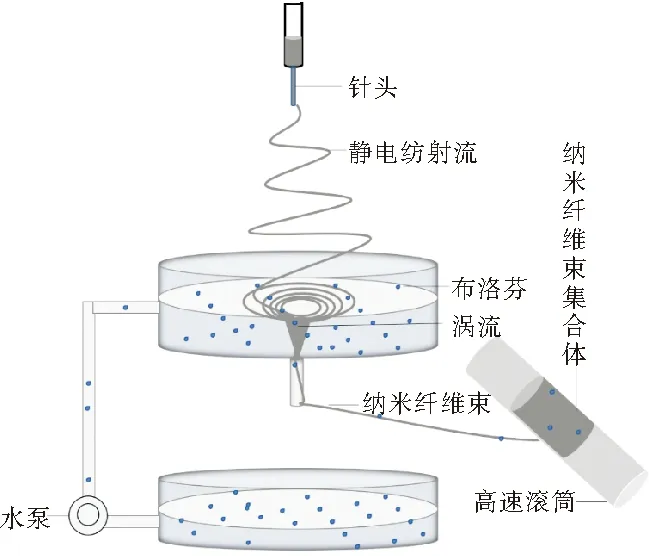
图1 实验装置简图
1.2 性能测试与表征
1.2.1支架的形貌表征
扫描电镜观察:对样品进行喷金处理,利用场发射扫描电镜(FE-SEM)对纤维的形貌进行表征。因为PLLA纤维的玻璃化转变温度较低,在高温高电压的情况下纤维形貌会被破坏,所以扫描电压控制在5 kV以下,在样品的不同区域拍摄多张SEM图片。
1.2.2支架的红外光谱测试
将试样裁剪为1 cm×1 cm的正方形,采用红外光谱仪(FTIR)对样品进行红外光谱分析,扫描范围为500~4000 cm-1。
1.2.3载布洛芬支架抑制肌腱粘连的可行性测试
1.2.3.1 细胞的增殖情况检测
本实验采用CCK-8试剂盒检测细胞的增殖情况。在避光的环境下,将CCK-8储存液、高糖培养基以1∶9的体积比混合均匀,配制出CCK-8工作液。在细胞种植到材料上培养1 d、4 d、7 d后,将孔板中的培养基吸出,加入无菌PBS清洗3次,每孔加入200 μL配好的CCK-8工作液,放入培养箱继续培养1 h,每孔吸取100 μL CCK-8工作液于96孔板中,用酶标仪在450 nm处测得吸光度。
1.2.3.2 细胞活性测试
在细胞种植到材料上培养1 d、4 d、7 d后,从培养箱中取出,将孔板中的培养基吸出,用PBS清洗3遍后,每孔加入200 μL配置好的AM/PI活死细胞染料,避光孵育45 min后,用PBS清洗3遍,随后立马将膜置于倒置相差荧光显微镜下,观察细胞活性。
2 结果和分析
2.1 支架的形貌表征
不同载药浓度的聚乳酸组织工程支架的SEM图如图2所示,其表观形式是纳米纤维束集合体。聚乳酸多孔纤维沿着纤维束的轴向排列,被动态水浴形成的涡流微弱加捻。纤维束间形成了一定的大孔结构,有利于营养物质的输送和代谢废物的排出。纤维上分布大量微细孔,微细孔直径约为200 nm,这样的纳米孔结构可以提高支架的比表面积,有利于PLLA纤维的降解。

图2 载药PLLA纳米纤维束集合体的SEM图
2.2 支架的红外光谱分析
进一步通过FTIR验证载布洛芬聚乳酸支架(PLLA-IBU)成功制备。如图3所示,布洛芬的图谱中3432~2955 cm-1波数范围内有一个宽峰,这与布洛芬的羧酸二聚体中O-H的伸缩振动有关;在1708cm-1附近的锐利尖峰,是单羧酸基团中C=O伸缩振动。对比PLLA-IBU和PLLA的红外光谱图可知,在这些波数范围内,PLLA-IBU红外光谱上都出现了布洛芬的特征峰,证明聚乳酸支架上有效负载了布洛芬。
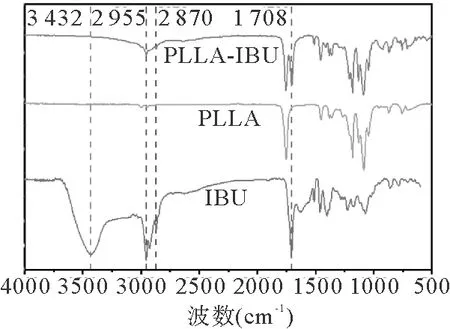
图3 布洛芬、PLLA支架和PLLA-IBU支架的红外光谱图
2.3 载布洛芬支架抑制肌腱粘连的可行性测试
2.3.1细胞增殖能力分析
进一步分析细胞的生长情况,图4是NIH-3T3的CCK-8实验结果图。随着培养时间的增加,每组样品的吸光度值都有不同程度的增加,说明细胞在三种不同布洛芬浓度的支架上都能黏附和增殖。在第1 d,无统计学上的显著性差异,这是因为在细胞的早期培养中,材料的亲疏水性是影响细胞初始黏附的主要因素,而在第7 d,IBU-0组的细胞增殖数量显著高于IBU-0.5组和IBU-1.0组,存在统计学上的显著性差异,这是由于布洛芬随着培养时间的延长持续释放,抑制了NIH-3T3的增殖,降低了NIH-3T3的细胞活性。

图4 NIH-3T3在载布洛芬PLLA组织工程支架上的增殖情况
2.3.2细胞活性分析
如图5所示,与材料共培养7天中,大部分NIH-3T3能够存活于IBU-0上,而代表死细胞的红点数目可忽略不计,这说明聚乳酸支架对这类细胞没有明显的毒性。此处需要指出的是,NIH-3T3在IBU-0.5和IBU-1.0上活细胞的数量逐渐减少,死细胞的数目逐渐增多,说明随布洛芬含量的增加,NIH-3T3细胞的活性受到抑制。
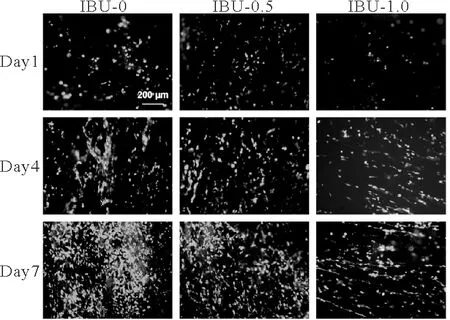
图5 NIH-3T3在载药聚乳酸支架上培养的活、死细胞染色图
3 结语
在本研究中,利用实验室自组装的动态水浴涡流加捻装置,通过静电纺丝技术,一步制备了负载油性药物布洛芬,且同时具备纳米和微米孔隙结构的组织工程支架。通过一系列手段表征支架性能,得到的主要研究结论如下:
(1)纳米纤维束集合体中,纤维呈高度取向结构,可以提高纤维取向方向的拉伸强度;纤维束有一定的捻度,可以增强纤维间的抱合力,进一步增强支架的拉伸强度。同时,取向结构的纳米纤维,可以仿生肌腱组织结构。
(2)聚乳酸纤维具有较好的吸油性能,可以有效地吸附油性药物布洛芬,从而实现支架上药物的负载。
(3)纳米纤维束集合体具有微米尺度的纤维束所形成的大孔结构,有利于营养物质的输送和代谢废物的排出;纳米尺度的纤维上形成的纳米孔结构,有利于药物的负载和缓释。
(4)将NIH-3T3种植在不同载药浓度的、基于纳米纤维束集合体的PLLA组织工程支架上进行细胞增殖和生长分析。发现NIH-3T3可以在不同布洛芬浓度的支架上黏附和增殖。但IBU-0、IBU-0.5和IBU-1.0上NIH-3T3的增殖被抑制,细胞活性依次降低。说明载布洛芬聚乳酸支架可以减少NIH-3T3的增殖和渗透,有望在肌腱损伤模型中表现出优良的抑制粘连功能。

