单原子纳米酶在生物医学中的应用
向 琴, 董海峰, 张学记
(深圳大学生物医学工程学院,广东深圳 518061)
1 前言
自然界一切生命现象都与酶有关。天然酶作为一种强大的生物催化剂,因其优异的催化活性和特异性而在医药、农业、化工、食品领域发挥着重要作用[1 - 4]。然而天然酶主要由蛋白质和生物有机分子组成,易受外界酸、碱、温度等条件影响,并且生产成本高,阻碍了其实际应用。酶模拟物,尤其是纳米酶,在替代天然酶方面具有至关重要的作用。纳米酶是一类既有纳米材料的独特性能,又有类似天然酶的催化效率和酶促反应动力学的人工模拟酶[5 - 8]。纳米酶具有良好的稳定性、制备成本低、储存时间长等优点,能有效避免天然酶制备和纯化过程中的复杂性,可应用于生物检测、肿瘤治疗以及其他类酶催化反应(图1)[9 - 14]。然而与天然酶相比,其结构、性质和催化机理都十分复杂,严重制约了它的快速发展。随后有研究表明,纳米酶的尺寸对其催化性能起着至关重要的作用,由于低配位金属原子通常作为活性部分,每个金属原子的催化活性随着金属颗粒尺寸的减小而相应提高,并且通过实验和理论分析,验证了亚纳米尺寸的金属团簇具有更高的催化活性和选择性。
图1 单原子纳米酶在生物医学中应用示意图Fig.1 Illustration of SAzymes in biomedical applications
为进一步推进纳米酶的发展,新出现的单原子纳米酶(SAzymes),集成了单原子技术和固有的类酶活性位点,将纳米酶技术提升到原子水平,并为突破其固有的局限性提供了新的机遇[15 - 20]。SAzymes中,原子分散的金属中心最大限度地提高了原子利用效率和活性位点密度,具有比传统纳米酶高10~100倍的优异催化活性[21],并且通过精确调节原子的空间构型可以设计出同时具有多种酶催化活性的金属配位结构,展现出广泛的催化选择性,为其实际应用提供了广阔的前景。
2 单原子纳米酶的特征
2.1 单原子纳米酶的结构优点
基于SAzymes的类酶催化反应是一种特殊的多相催化反应,其催化活性和选择性是最重要的考察因素,这在很大程度上取决于纳米材料的结构和原子特性[22 - 23]。然而,对于传统纳米酶,其活性主要来源于纳米材料表面极少的活性位点,如边缘、缺陷位点中的不饱和配位原子[24]。这些位点结构难以区分和定量控制,不仅使催化机理极其复杂,还导致其与天然酶的活性相差甚远。大量的研究表明,较小尺寸的纳米酶会因较高的表面体积比而暴露出更多的催化活性位点,从而提高催化活性[25 - 26]。当纳米粒子缩小到原子水平时,可以表现出与纳米颗粒显著不同的几何和电子效应,不仅具有最高的原子利用率,并且原子结构简单,表现出明确的配位结构、活性位点、催化机理以及优越的催化性能。SAzymes可以填补均相催化与多相催化之间的空白,突破材料设计的局限[27]。
2.2 单原子纳米酶的表面优化
通常,合成的SAzymes具有较高的表面能,对其表面进行修饰,能改变对底物的亲和力,改善疏水性,增加靶向性,并提高其催化效率[28 - 30]。在SAzymes的表面进行适当的聚乙二醇(PEG)修饰,不仅可以增强其在溶液中的分散性和生物相容性,而且可以防止SAzymes与生物液体组分相互作用,从而延长血液循环,降低单核吞噬系统的清除率。Huo等[27]使用DSPE-PEG作为表面活性剂,使得Fe -N4SAzymes在生理盐水中具有良好的分散性,显著提高了对肿瘤的抑制作用;同样,Xu等[31]使用PEG共轭维生素E改善了Zn-N4催化剂在溶液中的分散性。除了PEG,Wang等[29]利用PVP作为稳定剂,使锚定Ru原子的Mn3[Co(CN)6]2在水溶液中具有较好的分散性,提高了其用于癌症光动力学治疗的效率。
此外,使用靶向配体修饰于SAzymes表面,可以提高SAzymes与细胞表面的特异性相互作用,有利于对病灶位点的特异性选择。常用的靶向修饰物有生物小分子、肽、抗体或蛋白质等,通过与细胞表面受体结合,然后由受体介导的内吞作用进入细胞,进而实现有效靶向癌细胞[27,32,33]。例如利用EDC/NHS化学偶联法,将三苯基膦(TPP)上的羧基与所制备的碳点上的胺共价偶联,可以得到稳定的靶向线粒体的Au-碳点结构,而且具有原子分散的Au,可以实现最大程度地与内源性谷胱甘肽(GSH)反应,降低GSH水平,放大线粒体内活性氧(ROS)水平,进而诱导癌细胞凋亡[34]。
3 单原子纳米酶在生物医学领域中的应用
3.1 单原子纳米酶用于生物传感
SAzymes具有高选择性和优异的催化活性,有利于应用于生物传感[30,35-40]。Jiao等[41]通过掺杂B元素精确调控中心Fe原子的配位环境,开发出一种B掺杂的Fe-N-C单原子纳米酶(FeBCN),其具有与天然辣根过氧化物酶(HRP)相似的结构(图2(A)),表现出比HRP更高的温度耐受性以及显著增强的类过氧化物酶(POD)活性和选择性。通过pH调节FeBCN的POD活性,实现了对乙酰胆碱酯酶(AChE)活性及其相应的抑制剂分子的高灵敏检测。证明了SAzymes能有效模拟天然酶,在生物酶活性和小分子检测中显示良好的应用前景。
除了利用单原子Fe构建纳米酶催化位点,Cu离子同样可以用于构建SAzymes。Zhu课题组[35]通过盐模板策略,在掺N碳纳米片上嵌入高浓度Cu单原子位点,合成了具有POD活性的Cu-NC SAzymes。然后将Cu-NC SAzymes与AChE和胆碱氧化酶(ChOx)结合,构建了基于三酶的级联反应体系(图2(D)),通过显色法可以检测痕量的乙酰胆碱,线性检测范围为10~8 000 μmol/L,检出限为1.24 μmol/L。
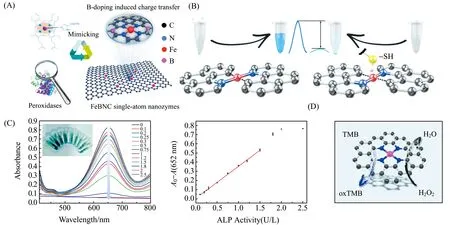
图2 FeBCN(A)[41]、Fe -N-C(B)[36]、Cu-N-C(D)[42]结构示意图以及Fe/NC-SAzymes[35]对ALP的检测(C)Fig.2 Structure diagram of FeBCN(A)[41],Fe -N-C(B)[36] ,Cu-N-C(D)[42] and UV-Vis absorption spectra of the Fe/NC-SAzymes/H2O2/TMB/AAP system with various concentrations of ALP(U/L) and Plots of the absorbance of the assay based on Fe/NC-SAzymers[35] versus ALP activity at 652 nm(C)
3.2 单原子纳米酶用于肿瘤治疗
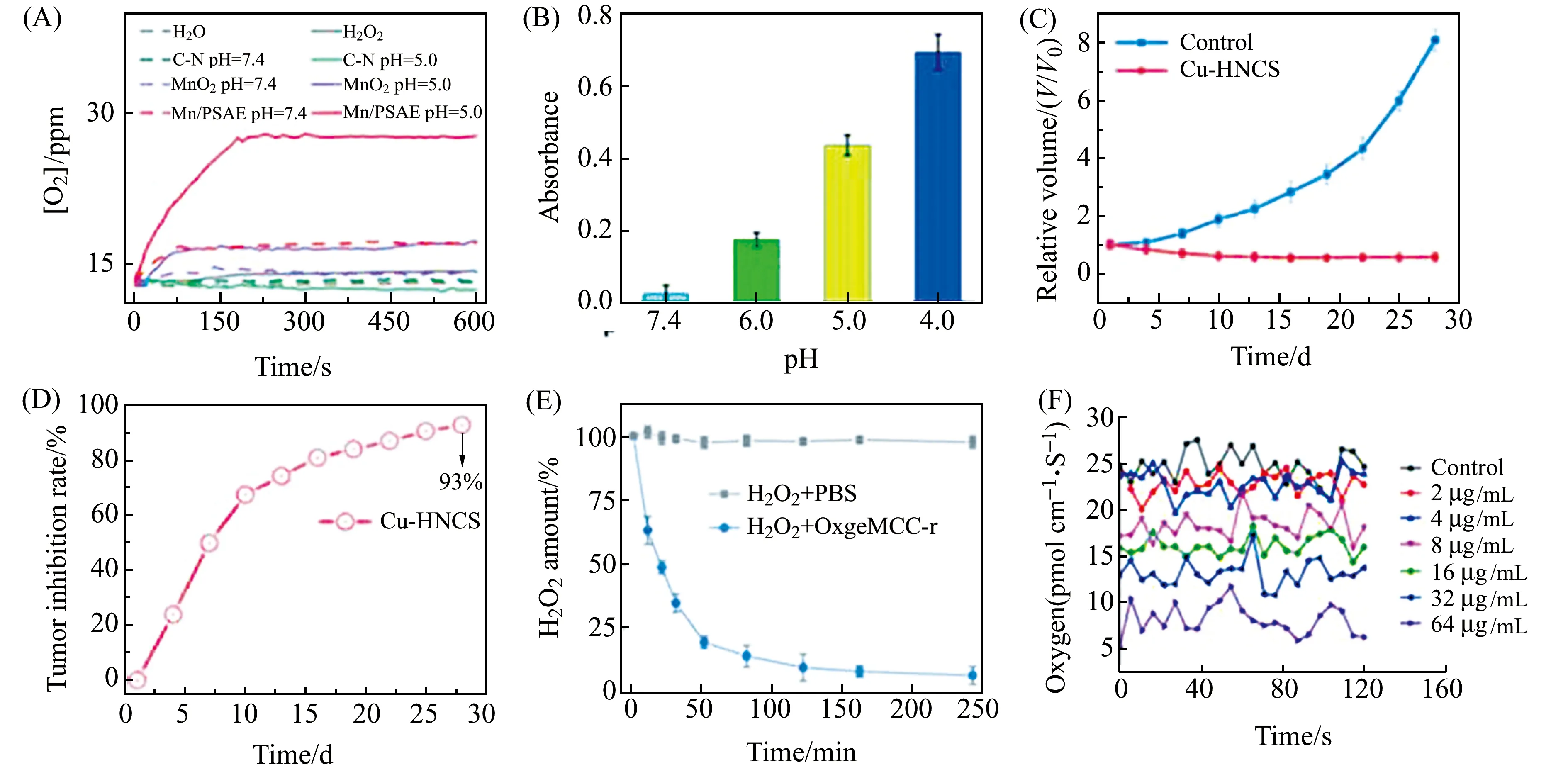
图3 Mn/PSAE催化H2O2分解O2(A);TMB法测定不同pH下Mn/PSAE的类氧化酶活性(B)[28];Cu-HNCS用于小鼠后的肿瘤生长曲线(C)和肿瘤抑制率(D)[50];OxgeMCC-r SAE分解H2O2的能力(E)[29];不同浓度MitoCAT-g处理后单个HepG-2细胞中的氧通量(F)[34]。Fig.3 The O2 generation from the decomposition of H2O2 by Mn/PSAE-mediated catalysis (A);TMB assay for measuring oxidase-like activity of the Mn/PSAE at the different pH(B) [28];Tumor proliferation curves (C) and relative tumor inhibition rates (D) after treatment with Cu-HNCS [50];Degradation profiles of H2O2 with or without of OxgeMCC-r SAE(E)[29];Representative traces of oxygen flux in single HepG-2 cells after treatment with different concentrations of MitoCAT-g(F)[34].
除了催化产生ROS,有效降低肿瘤细胞内谷胱甘肽(GSH)的含量,同样可以破坏细胞内的氧化还原内稳态,从而引起ROS相对增加,诱发细胞凋亡。例如,Gong等[34]开发了一种碳点支撑的原子尺度分散的金(CAT-g),这种纳米材料可以有效清除线粒体中的GSH,并增加ROS,经过瘤内注射后,可以显著杀伤癌细胞,抑制肿瘤细胞生长,同时不损伤正常组织。并且,通过流式细胞术检测发现,修饰了三苯基膦(TPP)的MitoCAT-g可以降低癌细胞线粒体膜电位和氧消耗,导致细胞凋亡。
3.3 单原子纳米酶用于抗菌作用
ROS可以破坏细菌的活性组分,造成其细胞膜、核酸、蛋白质等损伤,最终导致细胞死亡[21,52 - 53]。目前报道的纳米酶主要介导氧化还原反应,可以调节ROS水平,用于开发新型的抗菌药物。例如,Huo等[51]将单原子Fe锚定在氮掺杂无定形碳上,制备了碳基单原子Fe催化剂(SAF NCs),该纳米材料具有优异的POD活性,在生理水平浓度(50~100×10-6)的H2O2存在下,可以产生丰富的 ·OH,具备杀死革兰氏阳性菌(金黄色葡萄球菌)和革兰氏阴性菌(大肠杆菌)的能力。利用SAF NCs和H2O2处理细菌后,大肠杆菌和金黄色葡萄球菌的存活性仅为28.9%和17.4%,并且此单原子催化剂对近红外光具有特异性吸收,表现出19.37%的光热转化效率,在近红外光照射下,对两种菌落的抗菌效率均提高到接近100%,可以协同杀死细菌。类似的,Liu课题组[31]利用金属有机框架(MOFs)材料ZIF-8,通过介孔硅裂解保护策略,制备了单原子Zn催化剂,通过酶学实验验证其可作为一种高效的单原子POD模拟物,可应用于伤口消毒。在体外抗菌实验中,该SAzymer实现了高达99.85%的抑菌率,同时能够在低浓度H2O2情况下有效促进小鼠伤口的愈合。此外,Huang等[54]制备了一种能模拟细胞色素P450的单原子纳米酶(FeN5-SA/CNF),以Zn基MOFs包裹铁酞菁作为前驱体,高温热解形成FeN5/C位点,该位点具有优异的OXD活性。体外抗菌实验表明,经FeN5SA/CNF处理的大肠杆菌细胞的存活率明显降低,细菌形态受到严重损伤。并且FeN5SA/CNF对小鼠的溃疡情况具有明显的缓解作用,可以加速伤口愈合。
3.4 单原子纳米酶的抗氧化应激作用
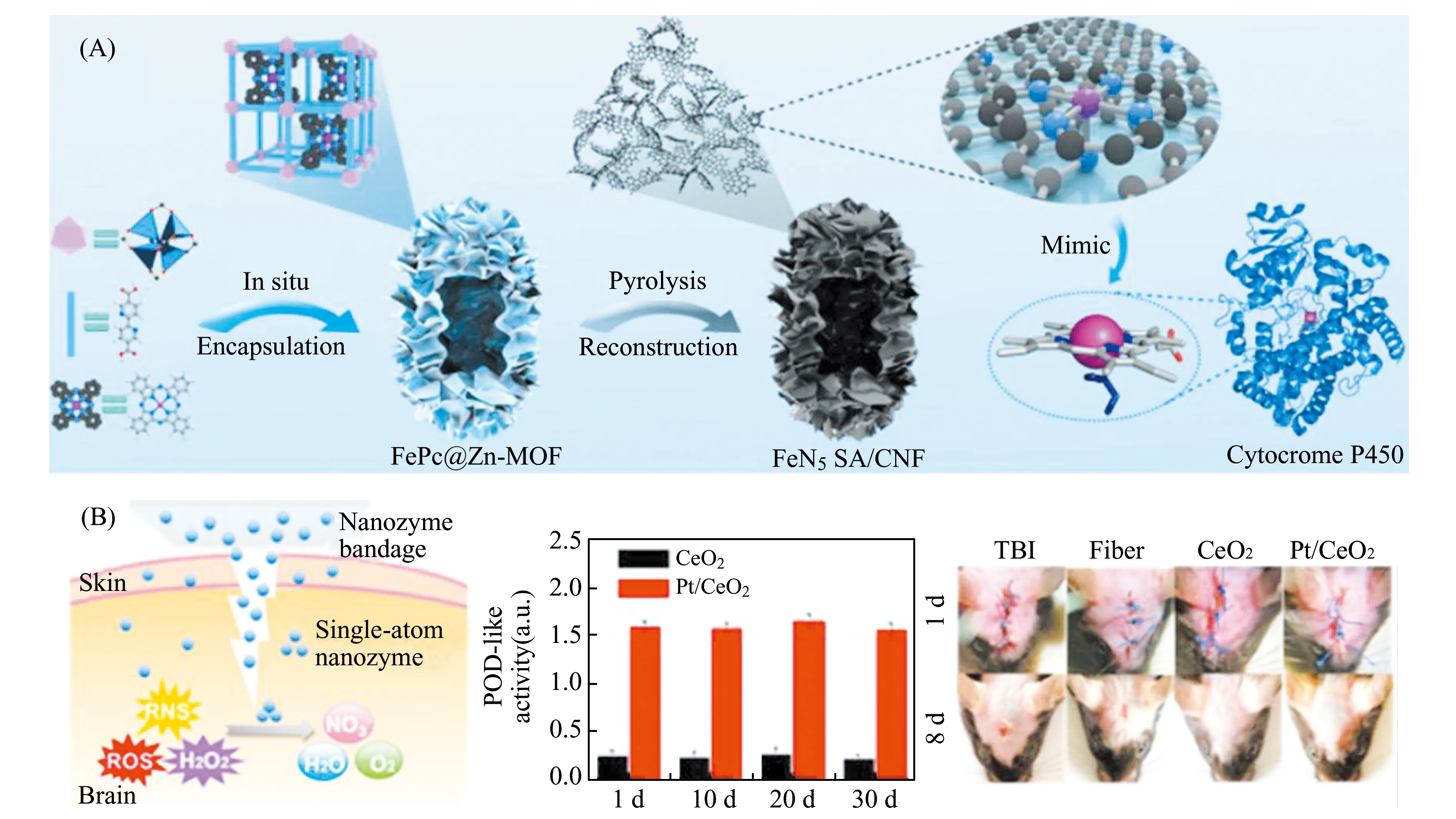
图4 (A)FeN5SAzymes/CNF的形成示意图[54];(B)单原子Pt/CeO2纳米酶绷带对小鼠脑外伤的无创治疗[58]。Fig.4 (A)Schematic formation process of carbonnanoframe-confined atomically dispersed Fe sites with axial five-N coordination for mimicking the active center of cytocrome P450[54];(B)Noninvasive treatment of brain trauma in mouse models using the nanozyme-based bandage [58].
4 结论与展望
SAzymes具有均匀分散的活性位点和明确的配位结构,能够模拟多种天然酶的活性,可用于生物的检测与疾病的治疗。未来应进一步探索SAzymes的活性-结构关系,合理地调节催化活性位点的几何和电子性质,从而设计出效率更高的纳米酶;应拓展金属原子的种类,开发除Fe、Zn、Au金属原子以外的SAzymes,深入挖掘其潜力;应着眼于加强SAzymes的反应特异性和优化催化性能,研究纳米酶在体内的药代动力学、降解、代谢、剂量依赖毒理性以及生物相容性等,实现SAzymes的临床使用。SAzymes的高催化性与选择性以及优异的稳定性,为开发可持续、经济、安全的疾病治疗方法提供了新思路。也预示了SAzymes在生物医学领域巨大的应用前景,但也存在如下一些挑战:
(1)目前已报道的SAzymes多基于碳基材料,其合成方法主要是通过高温热解,然而经过高温煅烧的碳材料水溶性和生物相容性差,难以直接应用于生物医学领域,虽然可以通过表面修饰改善其疏水性,但同时可能对纳米材料的结构位点造成破坏,加大对催化机理的研究难度,故未来需拓展负载单原子材料的种类。
(2)单原子纳米材料的金属负载量仍然是目前亟待解决的难题之一,开发高效合理的合成方法,减小负载材料的尺寸,加强金属原子的分散,以最大程度的提高金属原子的负载量是未来研究的方向之一,并且可以开展杂原子(N/S/B/P)掺杂,以及设计多金属中心的SAzymes,以追求发挥SAzymes最大的功效。
(3)应用于生物医学领域的中心原子主要基于Fe、Zn、Au,并多以M-N-C形式存在,而对其它金属原子研究甚少,造成了SAzymes的活性单一,未来还需开发对贵金属、稀有金属的研究,扩大SAzymes的研究范围。
(4)为早日实现SAzymes的临床转化,需特别重视材料的生物安全性,提高材料的生物相容性和生物可降解性,深入探究纳米酶在体内的作用机制,建立完备的纳米酶毒性评估平台,最终实现低毒、高效纳米酶制剂的开发。

