幂函数在肠道微生物聚集性中的应用
沈栩竹
(昆明冶金高等专科学校通识与素质教育学院,云南 昆明 650033)
1 问题的提出
人体与微生物的关系极其密切,在人体的5个主要部位(口腔、皮肤、肺、肠道、生殖道)都寄生着大量的微生物[1]。长期以来,人体与微生物间相互进行物质、能量及基因的交流,形成了一种互利共生或共栖的亲密关系。人体作为微生物的宿主,为这些微生物的繁殖、成长提供了必要的场所,而微生物的活动也直接或间接地对人体的健康产生重要影响。一些研究者把这些微生物群看作人体的重要“器官”,甚至把人体看作是微生物与人体细胞构成的“超生物”。其中,肠道微生物是寄生在人体内最庞大、最复杂的微生物群体。研究表明:成人肠道中的微生物数量达到惊人的1012~1014个,远超人体皮肤上的微生物数量,而10倍于人体自身的细胞数量[2]。肠道微生物群的基因组中的基因数目约是人体基因数目的100倍[3-4]。所以肠道微生物的物种数多,物种间的关系极其复杂。
通常情况下,肠道微生物构建的生态群落系统是相对稳定的,群落中的物种类型和比例变化不大。但当宿主所处地域、年龄、生理状况、饮食模式等发生变化时,就会引发肠道微生物群落系统产生显著的改变。Claesson等[5]指出不同年龄的人体内的肠道微生物的群落结构是不同的,益生菌的数量和种类伴随年龄增长而减少,病原菌的数量会明显增多。怀孕前后的妇女的肠道微生物有显著变化[6]。Fan等[7]研究了生活习惯也能导致肠道微生物群落结构差异。欧洲儿童和非洲儿童的食物差异也引起微生物的丰度不同[8]。肠道微生物群与人体免疫系统的发育与成熟、能量代谢、药物代谢等诸多生理功能密切相关,帮助人体消化食物,合成维生素,抑制病原体的入侵[9-14]。多项研究表明:肠道微生物群落的失衡会诱发人体的诸多慢性疾病,包括肥胖及相关炎症、糖尿病,衰老和老年性疾病,甚至自闭症及其他精神疾病[15-19]。饮食模式是影响肠道微生物组成和代谢的一个重要因素,不同的饮食模式会引发肠道微生物的物种类、比例结构和代谢活动的差异,并引起肠道炎症和免疫系统的变化。研究表明长期食用蛋白和脂肪为主要成分的饮食,肠道中主要微生物是拟杆菌属;而以糖类饮食为主的人群,其肠道中普氏菌属占核心地位;富含高饱和脂肪酸的饮食能改变肠道中的微生物并促进其他细菌的繁殖[20]。
当前,以细菌核糖酸RNA序列(16S rRNA)分析为基础的非培养微生物研究技术拓展了微生物研究的内容,为深入阐明微生物群落的多样性结构和功能提供了新方法。有观点认为微生物群落是自组织的、自我进化的系统,在空间分布上会呈现出相应模式。微生物的聚集是其重要的空间分布模式,虽有研究表明多数微生物群落都是聚集分布的[21],但从不同角度对群落的聚集度(异质差异)进一步研究,揭示群落空间分布模式与生态功能的关系,在理论和实践中都有积极的意义。本文所指异质性或异质差异是指生态学过程和格局在空间分布上的不均匀性及其复杂性。Taylor[22]的幂法则广泛应用于宏观生态学的研究,通过反映生态群落中物种的均值和方差在空间分布上的关系来揭示生态群落的结构功能。Taylor[22-24]解释该幂法则为物种丰度的空间聚集性(异质性)的度量,同时把该法则应用于时间采样的数据时,它是对时间聚集度(稳定性)的度量。Ma[21,25,36]将Taylor幂法则应用于微生物群落的研究,并在微生物群落水平上扩展出了4个模型,Type-I,II,III,IV。其中,Type-I和Type-III可以用来描述微生物群落的空间聚集度(异质性)。Type-I描述的是微生物样本组中物种间的聚集度(种间异质性);Type-III描述物种在不同样本间的聚集度(种内异质性)。另一微生物群落多样性分析的有力工具是Hill number指数。该指数可以从多个角度描述微生物群落内的物种多样性。1973年,Hill[26]在经济领域提出了Hill number指数。Chao[27-28]等用该指数来度量生物样本的多样性。对应不同阶数(q=0,1,2,3,4)的Hill number 反映了多样性的不同特征。
本研究根据人群的饮食情况把从粪便中采集到的微生物样本分为3组:饮食前、饮食含高脂肪、饮食含低脂肪。采用以上介绍的扩展Taylor幂法则(Type-I,III)和Hill number多样性指数对分组样本的16S rRNA测序数据进行计算,比较不同分组的肠道微生物群落的空间分布异质性和多样性,研究饮食对肠道微生物的生态属性影响。
2 材料和方法
2.1 数据来源
本文中使用到的数据来自Wu[29](2011)对饮食和肠道微生物模式的关系研究。饮食按纤维和脂肪所占的比例情况分为2种类型:低纤维/高脂肪和高纤维/低脂肪。结合采样人群是否进食,样本人群分为3个组:饮食前(未进食)、饮食含高脂肪(已进食,食物含高脂肪)和饮食含低脂肪(已进食,食物含低脂肪)。对样本人群的粪便中的微生物进行16S rRNA测序,获得微生物分类单元(OTU)数据。
2.2 幂分布模型及其扩展模型
Taylor[22]的幂法则用于度量生物种群空间分布的聚集程度(非均匀度或异质性),是种群生态学中最重要的理论模型之一。该法则认为物种的空间分布的均值和方差满足如公式(1):
(1)
式(1)中:μi是样本i的均值;vi为对应样本的方差;参数β是样本方差伴随样本均值的增长率。β反映了种群内在的聚集度,是种群行为演化特征;而参数α是抽样方法和外部环境异质的影响。对法则(1)的参数估计,通常取对数转化为线性模型:
log(vi)=logα+βlog(μi)i=1…n
(2)
模型中的β值可以区分种群在空间上的分布类型:β>1,种群空间分布呈现聚集形态;β=1,种群空间分布形态是随机的;β<1,种群空间分布是均匀分布。此后,Taylor幂法则在物种种群的结构研究中得到广泛的应用[30-31]。
Ma[21,25]基于Taylor 幂法则扩展出4个模型Type-I,II,III,IV。其中Type-I和Type-III适用于研究微生物群落的物种间和物种内的异质性;Type-II和Type-IV适用于对群落的稳定性进行估计。本文简要介绍扩展模型Type-I和Type-III。
扩展模型Type-I:
(3)
式(3)中,μs表示样本中物种多度的均值;vs是其方差;S是样本数量。当β=1,群落按照种群多度分布是随机的;当β>1时,群落呈高度聚集或异质性,群落是高度偏斜的种群多度分布,β值越大,聚集程度越大;当β<1时,群落的聚集度通常是一个常数,也就是群落结构是均匀的。
扩展模型Type-III:
(4)
式(4)中,μm是特定细菌物种的种群的多度的均值;vm是相应的方差;M是整个群落中混合物种的数量。当β=1,群落的混合种种群是随机分布的;当β>1时,混合种群群落呈异质分布,β越大说明异质程度越高;当β<1时,混合种群群落是均匀分布。
2.3 Hill number指数
Chao[27-28]把经济领域中的Hill number(Hill,1973)用于对生物样本多样性的研究。该指数在不同的阶数下,描述了样本多样性的不同特征。见公式(5):
(5)
式(5)中,数值qD反映了多样性的大小;S是样本中的物种数量;yij/y++=wijpij是样本中每个物种的相对丰富度(relative abundance)。当q=0时,0D反映群落中物种的丰富度(richness);当q=1时,1D是Shannon熵指数,反映群落中典型物种的数量;当q=2时,2D相当于Simpson逆浓度,表示群落中高丰富度物种的多样性;而q=3和4时,qD也对群落的多样性给以度量,只是没有传统的多样性指数与其对应。为了检验分组间多样性的差异,本文使用Wilcoxon秩和检验方法[32]。
3 结果分析
对分组内的每一样本计算其均值与方差,采用扩展模型Type-I对均值和方差进行拟合;对每一物种计算其在分组中的均值和方差,采用扩展模型Type-III对物种的均值和方差进行拟合。模型拟合的参数结果如表1所示。在表1中,β与SE (β)是模型的幂次数及其标准误,ln(α)与SE [ln(α)]是模型中幂系数的对数值及其标准误,R2是模型拟合的可决系数,p-value是模型系数检验的p值,n在Type-I中是分组的样本数,而在Type-III中是分组中的物种总数。整体上,Type-I和Type-III扩展模型对3组数据的拟合效果都较好,Type-I的可决系数R2都>0.8,而Type-III的可决系数R2皆>0.95,且拟合的所有模型的p值都<0.05的显著水平。所以,Type-I和Type-III扩展模型是较适合研究肠道微生物的多样性特征的。根据扩展模型的参数解释,3个分组的种间空间分布都是非随机的,都表现出较强的聚集性(β值 2.344 2.6 262.432)。因为3个分组的β值差异较小,可以认为3组的肠道微生物群落的空间异质性几乎是一样的,也说明饮食对肠道微生物群落的空间分布模式影响有限。另外,Type-III的拟合β参数值(2.282,2.205,2.284)说明2个分组的物种内的空间分布异质性差异也不明显。

表1 饮食前、饮食含高脂肪、饮食含低脂肪人群的肠道微生物的种间和种内异质性评估Tab.1 Evaluation of interspecific and intraspecific heterogeneity of intestinal microorganisms in pre-diet,high-fat diet and low-fat diet
对分组后的数据,在不同的阶数(q=0,1,2,3,4)下按分组计算每一个样本的多样性指数,结果见表2。表2列出了每个分组数据集上的不同阶数下的多样性均值和标准误。饮食含高脂肪分组的多样性均值在每一阶数下都比饮食含低脂肪和饮食前分组的要大,而饮食前分组的标准误比饮食含高脂肪和饮食含高脂肪分组的标准误数值都要大。

表2 饮食前、饮食含高脂肪、饮食含低脂肪分组的肠道微生物的多样性评估Tab.2 Evaluation of the diversity of intestinal microorganisms in pre-diet,high-fat diet and low-fat diet
在同一阶数下,对不同分组的Hill number指数进行Wilcoxon检验(选取3个原假设:<>,>,<),表3列出了每次检验的p值。p值显示在q=0,1的阶数下,饮食含高脂肪分组的多样性数值显著大于饮食含低脂肪分组的多样性(显著水平0.05),而其他分组间的多样性差异在不同阶数下是无差别的。
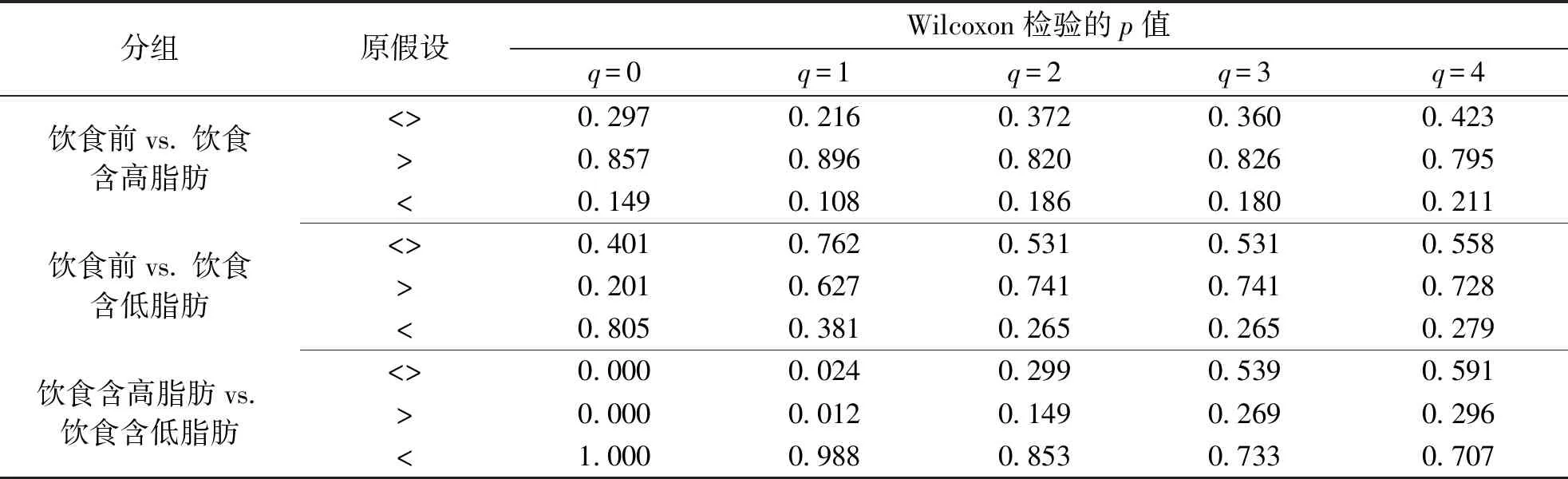
表3 饮食前、饮食含高脂肪、饮食含低脂肪分组间Wilcoxon检验P值Tab.3 P value of Wilcoxon test before diet,among groups with high fat in diet and low fat in diet
4 讨 论
饮食结构对人体的肠道微生物影响显著。长期而言,饮食的主要成分(糖、脂肪、蛋白)决定了肠道微生物的主要物种[20];配方奶粉代替母乳时,婴儿肠道内的微生物主要物种会发生更替[33];欧洲成年人粪便中的微生物与美国成年人的相似[34];非洲农村儿童与欧美儿童的肠道微生物差异明显[8];正常饮食切换为肉食或素食为主的饮食后,肠道微生物的数量和种类会在一天内发生改变[35]。以上的研究更多的是分析肠道微生物的结构和物种类型。然而肠道微生物数量庞大而复杂,完全分离鉴定肠道中的微生物还存在一定的技术限制,与人体健康相关的具体微生物物种及其作用机制还有待研究。因此,从微生物群落的水平,探讨群落的生态特征及其功能,找到生态特征与饮食结构的对应关系,为人体的健康管理提供指导是极其有价值的。
本文从肠道微生物群落整体系统的角度,使用扩展Taylor 幂法则(Type-I,III)和Hill number 多样性指数研究肠道微生物的空间分布模式及多样性与饮食的关系。结果表明:Type-I,III扩展模型对于样本数据的拟合效果较好,模型中的参数能反映群落的空间分布的异质性特征,并且饮食前、饮食含高脂肪、饮食含低脂肪人群的肠道微生物的空间分布模式(异质性)差异极小。Hill number 指数融合了多个多样性指数,是比较优良的多样性计算指标,通过选取不同的阶数,反映了样本的多个多样性特征。Hill number 指数的计算结果表明在3个分组中,饮食含高脂肪分组的多样性大于饮食含低脂肪分组的多样性 (q=0,1)。综合结果表明,从群落的空间异质性和多样性角度对肠道微生物进行研究是一种较好的尝试,它能克服群落中具体物种的生物功能信息的缺失,而从整体上研究肠道群落的生态结构及其功能的关系。此研究在理论和实践上具有积极的意义,能促进肠道微生物与人体健康关系的研究。
- 昆明冶金高等专科学校学报的其它文章
- 基于AHP-LEC法的冶炼作业危险性评价
- 火焰原子吸收法测定高铁闪锌矿中低含量铟
- 提高某铁矿选矿指标的试验研究

