蛇床子素对人舌鳞癌Tca8113细胞凋亡和自噬的影响
孙兴雅,刘 馨
锦州医科大学附属第一医院检验科,辽宁锦州 121000
口腔癌是全球最常见的恶性肿瘤之一[1],其中90%的病理类型是鳞状细胞癌[2],目前舌癌的治疗手段以手术根除并结合术后放、化疗为主[3],尽管医疗水平飞速发展,但术后复发、转移以及手术影响的其他头颈部功能的丧失极大地危害着患者的生活质量。有生物活性次级代谢物的天然产物是开发新药的重要候选成分[4],蛇床子素(osthole,OST)是从中药蛇床子中提取的一类香豆素类衍生物,除具有广泛的药理活性,包括抗氧化、抗炎、抗感染、抗过敏、治疗骨质疏松、镇痛、杀虫等作用外,还具有良好的抗肿瘤效果[5],但对口腔癌细胞的研究报道较少,本研究主要探讨OST对人舌鳞癌Tca8113细胞凋亡、自噬的影响及分子机制。
材料和方法
材料CO2培养箱[赛默飞世尔科技(中国)有限公司],荧光显微镜(奥林巴斯中国有限公司),流式细胞仪(美国碧迪公司),电泳仪和转膜仪(安玛西亚中国有限公司);人舌鳞癌Tca8113细胞由锦州医科大学附属第一医院外科重点实验室赠予;OST购于南京景竹生物科技有限公司(分子质量:244.29,纯度>98%,CAS NO:484- 12- 8,分子式:C15H16O3),溶于二甲基亚砜(dimethyl sulfoxide,DMSO),且DMSO浓度<0.1%;RPMI 1640培养基、青链霉素双抗(海克隆生物化学制品北京有限公司);胎牛血清;MTT(西格玛奥德里奇上海贸易有限公司);结晶紫(北京索莱宝科技有限公司);流式细胞术细胞凋亡试剂盒(上海贝博生物科技有限公司);Hoechst 33242染液、BCA蛋白浓度测定试剂盒、聚丙烯酰胺凝胶配置试剂盒、辣根过氧化物酶标记山羊抗兔二抗IgG(H+L)(上海碧云天生物技术有限公司),Bax 、Bcl- 2、活化的半胱氨酸蛋白酶3(美国细胞信号通路)LC3、P62、GAPDH(英国剑桥大学抗体)。
细胞培养细胞生长于RPMI 1640培养基(内含10%胎牛血清、1%青链霉素双抗)在5%CO2、37 ℃恒温培养箱中,每个培养皿5~7 ml培养液,每2~3天换1次液体,细胞长到培养皿底的80%~90%根据实验要求进行传代或者冻存,取对数生长期细胞进行实验。
细胞分组及给药方法取对数生长期Tca8113细胞分为对照组和4个剂量的实验组。对照组不加药,实验组分别加入40、80、120、160 μmol/L的OST。
MTT检测细胞存活率取对数期的细胞,消化、计数,调整密度为每孔5×103个细胞接种于96孔板中,24 h后,按分组要求加入培养液及实验药物,使蛇床子素的目的浓度分别为0、20、40、80、120、160、200 μmol/L OST,对照组无药物处理,空白组加入培养基,使各孔体积均为100 μl,终止培养前4 h每孔加入MTT(5 mg/ml)溶液20 μl,4 h后吸净培养基,加入150 μl的DMSO,水平摇床混匀后用酶标仪490 nm处测定各孔吸光度值,计算细胞生长抑制率。
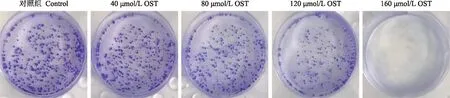
集落形成实验检测细胞克隆形成能力以每孔700个细胞接种在6孔板,按细胞分组方法处理细胞,设置对照组,每2~3天换液,培养基内仍含原浓度药物,作用周期为1~2周,当镜下30~50个细胞数的细胞团时终止培养。甲醇固定20 min,PBS漂洗几次,0.1%结晶紫染色20 min,PBS漂洗干净,晾干拍照并计算克隆形成率。
Hoechst33342染色观察细胞核凋亡形态取对数生长期细胞,以每孔1×104个细胞接种于6孔板,待贴壁后,按细胞分组方法处理细胞,并设置对照组,24 h后加入2 ml配好的Hoechst33342工作液,37 ℃避光染色30 min,荧光显微镜观察细胞核着色情况并保留图像。
流式细胞术检测细胞凋亡取对数生长期细胞加入含有蛇床子素药物的培养基,浓度分别为40、80、120和160 μmol/L OST,设置不含药空白对照,作用24 h,用胰酶常规消化,冷PBS洗2遍,1200 r/min(r=10 cm)离心 4 min,用400 μl缓冲液重悬细胞,调整细胞数为1×106细胞/ml,加入5 μl抗凝血蛋白膜黏连蛋白- 5-异硫氰酸荧光素染色液,混匀,于避光条件下孵育15 min,再加入5~10 μl 碘化丙啶混匀,于避光条件下孵育5 min,于1 h内通过流式细胞仪检测。Q1区表示坏死细胞,Q2区表示晚期凋亡细胞,Q3区表示活细胞,Q4区表示早期凋亡细胞,总凋亡率为Q2和Q4区的总和。
Western blot检测凋亡和自噬相关蛋白表达细胞分组及给药情况同上,收集给药24 h细胞样,在冰上用细胞裂解液(细胞裂解液:蛋白酶抑制剂=100∶1)提取各组细胞总蛋白,通过BCA测定蛋白浓度,蛋白变性10 min。行聚丙烯酰胺凝胶电泳1.5 h,恒流280 mA、1 h转至聚偏二氟乙烯膜,5%牛血清白蛋白室温封闭1.5 h,一抗(Bax 、Bcl- 2、活化的半胱氨酸蛋白酶3、GAPDH、LC3、P62)4 ℃过夜,洗涤缓冲液洗膜3次,二抗室温孵育1 h,洗膜,超敏发光显色试剂盒显色,用Image J分析条带灰度值。
统计学处理统计分析由 SPSS 22.0软件完成,两独立样本采用t检验,多组间比较用单因素方差分析,结果用均数±标准差表示,P<0.05为差异有统计学意义。
结 果
OST抑制Tca8113细胞增殖MTT结果显示,与对照组(99.60±0.89)%比较,20、40、80、120、160、200 μmol/L OST对Tca8113细胞的增殖抑制率分别为(93.46±1.72)%(t=2.931,P=0.032)、(78.94±6.73)%(t=9.861,P=0.000)、(66.77±1.44)%(t=15.670,P=0.000)、(59.97±3.89)%(t=18.910,P=0.000)、(43.77±2.45)%(t=26.640,P=0.000)、(39.15±2.33)%(t=28.850,P=0.000)。对细胞的增殖抑制作用随着OST浓度的增大而增大,在24 h时OST对Tca8113细胞的增殖抑制率为154.1 μmol/L。
OST对Tca8113细胞克隆形成能力的影响作用1周后,与对照组(99.00±1.00)%相比较,40、80、120、160 μmol/L OST对Tca8113细胞的克隆增殖能力为(91.10±2.82)%(t=3.178,P=0.031)、(84.17±3.75)%(t=5.967,P=0.000)、(32.00±4.59)%(t=26.950,P=0.000)、(8.67±1.53)%(t=36.340,P=0.000)(图1)。
OST对Tca8113细胞凋亡的影响Hoechst33342染色结果显示,对照组Tca8113细胞核形态完整,在荧光显微镜下发出微弱的蓝光,荧光分布均匀;经OST处理后,细胞核固缩明显,染色质皱缩,胞核碎裂,随OST浓度的增大亮而致密的蓝色荧光越明显(图2)。流式细胞术结果显示,24 h后,对照组凋亡率(3.00±0.61)%,在40、80、120、160 μmol/L OST作用于细胞后,凋亡率分别为(11.23±5.01)%(t=3.146,P=0.033)、(15.13±1.90)%(t=4.631,P=0.003)、(28.70±2.76)%(t=9.795,P=0.000)、(46.30±3.87)%(t=16.490,P=0.000)(图3)。
OST:蛇床子素
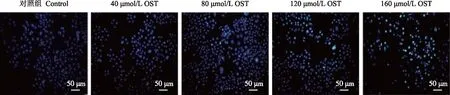
图2 Hoechst33342染色检测不同浓度OST对Tca8113凋亡能力的影响

PI:碘化丙啶;FITC:5-异硫氰酸荧光素
OST对Tca8113细胞凋亡相关蛋白的表达Western blot 结果显示,在40、80、120、160 μmol/L OST作用下,Tca8113细胞凋亡相关蛋白Bax表达水平(39.21±1.11)%(t=3.428,P=0.021)、(44.50±1.46)%(t=5.443,P=0.001)、(48.34±1.00)%(t=6.902,P=0.000)、(58.80±6.46)%(t=10.880,P=0.000)均明显高于对照组(30.20±2.40)%(图4)。在40、80、120和160 μmol/L OST作用后,凋亡相关蛋白活化的半胱氨酸蛋白酶3的表达水平分别为(70.80±10.32)%、(83.23±4.53)%、(106.40±8.95)%、(110.40±0.92)%,其中80(t=4.933,P=0.002)、120(t=9.186,P=0.000)、160 μmol/L OST(t=9.928,P=0.000)均高于对照组(56.37±3.80)%,而40 μmol/L OST与对照组相比差异无统计学意义(t=2.651,P=0.074)(图4)。在40、80、120、160 μmol/L OST作用后,抗凋亡蛋白Bcl- 2表达量分别为(51.21±1.51)%、(47.09±1.67)%、(35.60±8.76)%、(19.48±1.84)%,其中80(t=3.711,P=0.013)、120(t=7.009,P=0.000)、160 μmol/L OST(t=11.630,P=0.000)均高于对照组[(60.03±2.42)%],40 μmol/L OST与对照组相比差异无统计学意义(t=2.529,P=0.090)(图4)。
OST对Tca8113细胞自噬相关蛋白的表达与空白对照组(53.81±3.09)%相比,40、80、120、160 μmol/L OST处理Tca8113细胞后,LC3Ⅱ蛋白表达水平分别为(74.74±2.98)%(t=3.519,P=0.018)、(81.25±7.73)%(t=4.614,P=0.003)、(101.00±9.96)%(t=7.938,P=0.000)、(103.13±9.37)%(t=13.030,P=0.000),差异均有统计学意义(图5)。40、80、120、160 μmol/L OST处理Tca8113细胞后,P62蛋白表达水平分别为(56.22±3.64)%(t=3.327,P=0.026)、(58.99±0.67)%(t=4.046,P=0.008)、(77.80±1.45)%(t=8.931,P=0.000)、(88.49±9.68)%(t=11.700,P=0.000),与对照组(43.41±1.25)%相比差异均有统计学意义,且具有一定程度的浓度依赖性(图5)。
讨 论
OST(7-甲氧基- 8-异戊烯氧香豆素,C15H16O3)是一种天然香豆素化合物,香豆素由于原结构中官能团的存在,具有明显的抗癌作用且不良反应小[6],已被证实OST对子宫颈癌、鼻咽癌、乳腺癌、胃癌、慢性髓系白血病、肺腺癌、胶质瘤、肝癌等多种肿瘤均有抑制生长和治疗作用[7-11]。但对口腔癌细胞的研究目前还不清楚。

Mr:相对分子质量;1:对照组;2:40 μmol/L;3:80 μmol/L;4:120 μmol/L;5:160 μmol/L
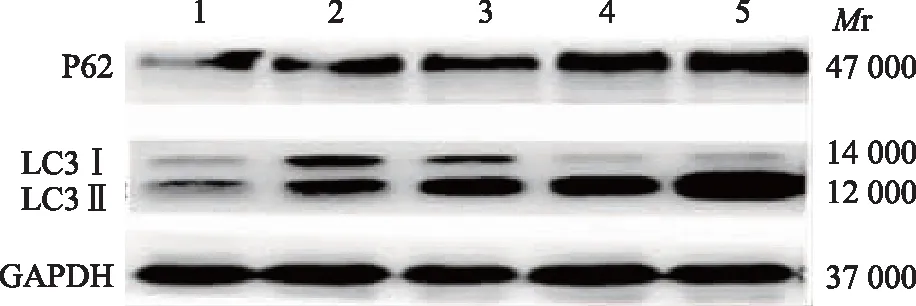
1:对照组;2:40 μmol/L;3:80 μmol/L;4:120 μmol/L;5:160 μmol/L
细胞凋亡是由基因控制的细胞自主有序的死亡[12]。诱导凋亡能力已被认为是抗肿瘤药物的一种作用机制,也是目前抗肿瘤最重要的途径之一,哺乳动物凋亡主要由线粒体依赖的凋亡途径完成。Bcl- 2蛋白是Bcl家族最关键的抗凋亡蛋白,通过Bcl- 2过量表达并与促凋亡因子Bax形成异二聚体来防止细胞凋亡。Bax是一种促凋亡蛋白,能转运到线粒体外膜,促进多种凋亡因子的通透性和释放[13-15]。当线粒体凋亡发生,Bax被激活,细胞色素C释放,线粒体外膜通透性增加半胱氨酸蛋白酶3活化,活化的半胱氨酸蛋白酶3可以转导和放大细胞内凋亡信号,催化聚合酶裂解,引发DNA损伤和凋亡[16-17]。本研究Western blot结果显示,经过蛇床子素处理的Tca8113细胞促凋亡蛋白Bax和活化的半胱氨酸蛋白酶3明显上调,Bcl- 2表达下降,提示OST可以通过线粒体途径促进舌鳞癌Tca8113细胞的凋亡。
自噬是一个高度调控的过程,适度的自噬通过降解被破坏的蛋白质和细胞器释放新的大分子前体氨基酸代谢物和供能,促进营养物质被细胞重新利用,维持细胞稳态,自噬受阻滞会导致细胞器缺乏能量供应,细胞器无法更新,细胞死亡速度增加[18-20]。越来越多的证据表明,自噬在抑制人类肿瘤中起着重要的作用。LC3是自噬小体的标志蛋白,其含量与自噬体形成的程度密切相关,当自噬激活过程中,LC3Ⅰ以胞浆形式与磷脂酰乙醇胺结合,进一步裂解为LC3Ⅱ,使LC3Ⅱ铆钉在自噬泡双层膜上,P62位于细胞核内并在细胞质中合成,是一种泛素结合支架蛋白,当自噬发生,P62与泛素结合并招募泛素化蛋白,再与自噬体膜上的LC3Ⅱ结合形成复合物,进入到自噬体后最终与溶酶体融合形成自噬溶酶体从而被清除,是评价自噬体降解的重要指标。P62蛋白与自噬溶酶体结合,代表自噬溶酶体降解水平,P62表达水平增加意味自噬溶酶体降解减少,自噬流被阻断,自噬过程受损[21]。本研究Western blot结果显示,经过OST处理的Tca8113细胞。LC3Ⅱ、P62蛋白表达量随OST浓度的升高而增加,LC3Ⅰ表达量降低,表示OST作用于Tca8113细胞时,能诱导细胞自噬,但是自噬流受阻自噬过程无法继续进行从而抑制细胞的自噬过程导致细胞死亡。
综上,本研究显示OST抑制Tca8113细胞增殖,机制可能是促进细胞凋亡、阻断自噬流抑制细胞自噬过程。

