一沙一世界
潘磊
我们无论是体内还是体外,都时时刻刻处于微生物的包围之中,它们无处不在。人体中有它们,土壤里有它们,大气中有它们,海洋里有它们,淡水中也有它们,甚至火山熔岩、盐湖深底、宇宙太空都有微生物的身影。
前人对微生物的认识
纵观历史,其实古代先贤对于微生物的利用远远早于我们能真实地观察到它们。考古学家发现,早在公元前7000年的新石器时代,中国就有了利用微生物发酵大米、蜂蜜和水果而成的鸡尾酒饮料。1991年在意大利阿尔卑斯山上发现的奥兹冰人,生活在5300多年前,其身上也留存有利用真菌缓解莱姆病(一种以蜱为媒介的螺旋体感染性疾病)的证据。古希腊人在很早的时候就意识到“坏空气”(miasmatic odors)中存在“看不见”的东西,可以传播疾病,从而提出了卫生学的初步理念——隔离可以很好地阻断疾病的扩散。甚至在圣经中(《旧约—利未记》第13章)都清晰地描述了对麻风和其他传染病如何开展有效的隔离。可悲的是,面对新冠疫情的突显,西方似乎早已忘记了这一原则和卫生学常识。
“西方医学之父”古希腊科学家希波克拉底(Hippocrates,前460年—前370年)也曾指出病人或他们所处的环境中含有“致病的因素”。古希腊科学家瓦罗(M. T. Varro,前116年—前27年)则进一步给出了微生物的概念:“我们必须注意病患所处的环境,因为空气中漂浮着我们看不见的微小生物,它们可以通过口腔和鼻孔进入我们的身体,从而引发严重的疾病。”这在当时已经是非常准确、非常了不起的认知了。现代微生物学可以说起源于列文虎克(A. van Leeuwenhoek, 1623—1723)的显微镜时代,他首次在雨滴中直接观察到这些微小的生物。之后,伟大的科学家巴斯德(L. Pasteur, 1822—1895)真正让我们对于微生物的认知越升了一个量级。他首次分离了单一的微生物菌株,提出了发酵的概念,发明了“巴氏灭菌法”。之后,德国科学家科赫(R. Koch, 1843—1910)提出了著名的“科赫法则”,将人类疾病和单一致病菌株关联起来。
微生物群和肠道共生菌
近10年来,一个新名词——微生物群(microbiota)逐渐被大家所认知。它特指一种生态学的群体概念,指征多细胞生物体内、体表或某种局限环境中所形成的相对稳定的微生物群。当然其范畴不限于细菌,也包含古菌、病毒、真菌、原生生物等微生物。如果单指依托于动植物等多细胞生物的微生物群来说,其与宿主的关系大致可区分为:互惠共生(mutualism),即菌群和宿主都从彼此身上获益;共栖共生(commensalism),多指宿主从菌群获益而不影响菌群本身(奉献型);偏害共生(amensalism)和寄生共生(parasitism)则都会对宿主造成伤害,前者不影响自身(损人不利己型),后者还能从宿主获益(损人利己型)。而无关共栖或称中立共栖(neutralism),则是双方相安无事,仅仅是生活在一起,互不影响。
在人体上,与我们共栖的微生物菌群就是人类共生菌。1880年代中,奥地利科学家埃斯克里奇(T. Escherich)第一次提出细菌长期共栖于人体的科学证据,他发现的这种细菌就是大名鼎鼎的大肠杆菌(Escherichia coli),后人用埃斯克里奇的姓氏命名了这种细菌。现如今,人体上已被发现拥有上千种细菌,数量超过百亿。它们分布于人的口腔、肠道、肺脏、阴道、眼睑、耳蜗、皮肤等等可以和外界进行交换的黏膜组织中。但更有意思的是,这些菌群在人体上的分布也不是随机的。不同组织部位所共栖的共生菌群存在着显著的种类差异和特异性。这取决于菌群在所处部位与宿主之间功能互作的结果。当然,我们人体也不是天生就拥有稳定的共生菌群结构。虽然,有报道称胎儿在羊水中就已开始接收母体带来的外源共生菌。但总体的认识是,我们从出生那一刻起开始真正大量地获得共生菌的定殖,这一阶段大概要历时3年时间,进而菌群在每个个体中趋于动态的平衡和稳定。
肠道具有人体里表面积最大的黏膜层,是人体和微生物交互作用的主战场。肠道共生菌也是迄今被研究得最多、种类最多、数量最多,以及功能最多样的人体共生菌类群。仅人体肠道所含有的细菌数就有1012,是人体自身细胞数的10余倍。这些共生菌所含的基因数是人类自身基因数的150多倍。所以,不难理解肠道共生菌对人类个体的影响也必然是巨大且顯著的,无论是发育还是衰老,代谢还是免疫,行为还是认知,其对人体的影响无处不在。难怪有科学家声称,肠道共生菌一直是人体“被遗忘的器官”。
影响肠道共生菌的因素
不论是我们出生后的菌群塑造过程,还是菌群已在人体内形成较为稳定组成的成熟阶段,肠道共生菌始终处于动态变化中,这种变化受到很多因素的影响。如饮食习惯,不同营养物质的摄入,必然导致肠道生理环境的不同,自然催生了可特异利用这种环境或营养代谢物质的细菌滋生。从大的范围来说,爱吃甜食的江浙人士和喜食辣椒的川贵人群,他们的肠道菌组成就截然不同。换言之,这些菌群的存在也是保证川贵人群的肠胃更加耐受辣椒的重要因素之一,不至于发生像其他地方的人们初食爆辣而疾奔如厕的囧样。从小的范围来讲,每一户人家都有着自己的口味和饮食习惯。你和邻居的肠道共生菌也存在着不小的差异。甚至有证据表明,我们的进食和口味选择也受到肠道菌的控制。有时候,真的不是你想吃饭,而是你的肠道菌“喊”你吃饭,而且还有着明显的口味偏好[1,2]。同理,营养不良人们的肠道共生菌与健康人群的也存在着极大的差异。世界卫生组织的研究也发现,在尚不能有效恢复营养不良人群的肠道菌群之前,即使提供充足的食物,也不能有效改善这些人的身体状况[3]。
地域环境也是很好理解的影响肠道菌组成的重要因素之一[4]。全球不同的气候、环境,以及差异性卫生条件,都极大地制约着每个人的菌群发展。你碰不到的菌,自然就没机会在你体内定殖。菌群的差异也是水土不服的影响因素之一。甚至有研究发现,经常进行全球商务飞行的人士所伴随的肠胃不适与自身肠道菌群不能及时适应密切相关[5]。另一个很好理解的因素就是药物的使用,尤其是抗生素和某些疫苗,都会显著改变我们肠道共生菌的构成。有研究表明,无论是母亲在怀孕期间,还是幼儿阶段,不恰当地使用抗生素,都可能转变小儿的肠道菌环境,从而极易引发成年后的哮喘疾病[6]。其实我们的肠道菌构成是非常脆弱的,仅仅一次简单的抗生素治疗,就可以立时破坏我们肠道共生菌的群落结构,而在停药后,需要花费数月甚至更长的时间才能恢复到原先的多样化水平。但即使这样,重塑的菌群结构也会与用药前存在显著的差别,可以说这是一个不可逆的过程。根本原因在于,肠道共生菌环境是一个相对和谐的小型生态环境。虽然抗生素只对部分种类细菌有效,但是单一菌种的破坏,很容易通过微生物之间的互相作用,放大到对整个生态环境的破坏。例如,肥胖症、糖尿病、哮喘等疾病都与抗生素治疗的不良反应密切相关。
影响肠道共生菌的因素还有很多,比如本身的遗传基因背景、运动情况、心情的好坏、年龄等等。这里仅再强调一点,那就是我们伟大的母亲。母亲在孕前、孕中、产后的生活习惯会极大地影响胎儿的肠道菌塑型,从而会对成年后的个体健康产生一生的影响。例如,顺产和母乳喂养就比剖腹产和奶粉喂养,在幼儿肠道菌多样化形成中具有更大优势,能显著降低幼儿过敏、哮喘甚至自闭症等疾病的发生概率。所以,请再次感谢我们的母亲吧!
前面提到肠道共生菌群在我们个人之间存在着差异,其实即使在每个个体之中,它们的组成与分布也是有着时空的特异性。按照肠胃轴的纵向分布,肠道共生菌无论是细菌数还是种类的多样性,基本是按照胃—十二指肠—空肠—回肠—结肠的空间顺序逐次增加。仅结肠的含菌量甚至都能达到胃部含菌量的1011倍。如果从肠道的横截面来看,由粪便中心逐次向外,肠腔—黏膜层—肠上皮层表面也都特异定殖着不同类别的菌群。当然,之前提到过的时间轴就更是如此,从出生—幼年—成年—老年,肠道共生菌都在不停地变化着。这也是为什么很多老年疾病的发生和发展与肠道共生菌的失衡密切相关。
肠道微生物研究面临的挑战和前景
鉴于肠道共生菌如此重要,各国科学家陆续提出各种人类共生菌研究方面的计划。从2005年至今,至少已有8个较大的微生物方面的研究计划在实施,如美国的人类微生物组项目、加拿大的微生物组倡议、欧洲和中国共同参与的“人类肠道宏基因组计划”(MetaHIT),以及日本的人类宏基因组联盟等。科学家希望首先建立涵盖人类共生菌的巨大的基因信息库,追踪共生菌的动态变化规律,了解其与疾病之间的关系。近年来,微生物组学的研究伴随着科技的发展而突飞猛进,比如单细胞基因组学的发展、宏基因组和转录组学的建立、大数据体系和新型数学算法的开发等,都为微生物群组的研究铺平了道路。科学家研究的最终目标是希望能回答两个重要的科学问题:健康的人类共生菌微生态是如何塑造的,它又是如何保持和修复的。
现阶段,人类共生菌的研究还面临着很多困难。首先,肠道中绝大数多数的区域处于无氧环境,很多共生菌自然是厌氧细菌,且它们的生长环境苛刻,甚至要依赖于其他细菌才能存活。这就导致科学家仅能通过大规模测序了解有些细菌的存在,但始终无法将它们分离出来,并在体外培养,所以很难深入了解它们的生物特质。第二,即使测序比对能够让我们了解某些细菌的存在,但对于如此庞大的细菌种类,绝大多数细菌的基因组信息尚未被有效收集。也就是说,即使你获得了新的基因序列,却苦于没有“字典”,根本就不知道它是什么。所以信息数据库的建立也是全球微生物研究计划的首要任務。第三,虽然很少的功能细菌已经被解析,但是如何让这些细菌通过回输方式稳定地“扎根”在新宿主体内从而发挥功能,还是一个很棘手的问题。人体并不像我们研究的无菌动物模型,它含有大量共生菌。即使疾病已导致肠道菌群的紊乱,但这些混乱的细菌也相应地形成了较为和谐的局面。如何让“有益的”治疗菌打破这种平衡,从而让其自身稳定定殖,进而形成新的平衡,这是极具挑战性的。因为不仅宿主和微生物存在活跃的互动,微生物之间也存在着各种竞争或依存关系。此外,个体的差异也限制了共生菌治疗的有效开展。毕竟同样的菌群“鸡尾酒”配方,肯定不可能适合所有存在巨大共生菌个体差异的患者。这也是精准医疗必须要解决的首要问题。
但也无需过于悲观,人体共生菌的应用其实早已展开潜移默化的应用。比如枯草芽孢杆菌、酵母菌早就应用于婴幼儿的腹泻和消化不良,比如我们常食用的益生菌食品。还有能够帮助我们自身合成维生素和氨基酸、分解纤维素的共生菌都已经在食品、保健品或药物中加以应用。更为复杂的粪菌移植(将健康人粪便中的功能菌群移植到患者胃肠道内,以重建新的肠道菌群,实现肠道及肠道外疾病的治疗),也已在临床医疗中逐步开展。早在1958年,美国丹佛的医生就尝试用健康人的粪便,给爆发性的肠炎病人灌肠,用来缓解由于抗生素处理而造成的肠道菌群紊乱。当然,那时还没有提出精确的治疗理念,仅是知道这种方法可以很好地在人体肠道中重建“自然”[7]。50多年后,医生们通过临床实验发现,引发顽固性小肠炎的艰难梭菌(Clostridium difficile)很容易在抗生素治疗后复发,即使用强力的万古霉素也很难将其清除干净。但是如果通过十二指肠回输健康人群的粪便,要比抗生素处理更能显著地降低艰难梭菌的复发感染[8]。这之后,粪菌移植的疗效也在器官移植、自闭症、溃疡性肠炎、腹泻等临床疾病中得以证实。甚至有人开玩笑地说“去吃屎吧”,这也许并不再是骂人的话。
此外,随着微生物组学计划的开展和共生菌研究的深入,很多具有想象力的应用前景也陆续出现在我们面前。例如,基于个人共生菌群的专一性,有人提出可将它作为我们的“分子指纹”。同样,这些个人的共生菌基本信息也将是我们未来能够开展精准医疗的基础与前提。当然,各类以共生菌为配方的“鸡尾酒”药方也在如火如荼的发展中。可以想象,未来这种生物药物将会有更为广阔的市场。甚至还有科学家提出,学会构架共生菌微生态也将是我们未来星际殖民的有利辅助,如果能够在外星球首先定殖类地和对人类有益的共生菌界面,对于新星球环境的改造和后期的顺利殖民将起着至关重要的作用。正如马克思的墓志铭上所写名言的含义所指:科学家不应满足于对事物的描述,而是要想办法能够改变并利用它。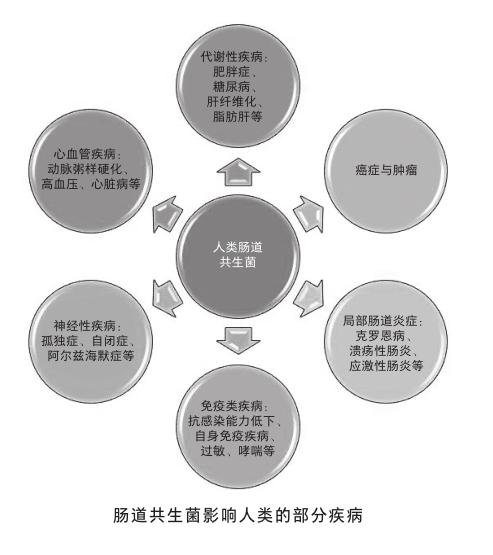
[1]Breton J, Tennoune N, Lucas N, et al. Gut commensal E. Coli proteins activate host satiety pathways following nutrient-induced bacterial growth. Cell Metab, 2016, 23: 324-334.
[2]Leit?o-Gon?alves R, Carvalho-Santos Z, Francisco A P, et al. Commensal bacteria and essential amino acids control food choice behavior and reproduction. PLoS Biology, 2017, 15: e2000862.
[3]Blanton L V, Charbonneau M R, Salih T, et al. Gut bacteria that prevent growth impairments transmitted by microbiota from malnourished children. Science, 2016, 351: 6275.
[4]Yatsunenko T, Federico E R,Manary M J. et al. Human gut microbiome viewed across age and geography. Nature, 2012, 486: 222-227.
[5]Dey N, Wagner V E, Blanton L V, et al. Regulators of gut motility revealed by a gnotobiotic model of diet-microbiome interactions related to travel. Cell, 2015, 163, 95-107.
[6]Mets?l? J,Lundqvist A,Virta L J, et al. Prenatal and post-natal exposure to antibiotics and risk of asthma in childhood. Clin Exp Allergy, 2015, 45: 137-145.
[7]Kelly C P. Fecal microbiota transplantation—an old therapy comes of age. N Engl J Med, 2013, 368: 474-475.
[8]Van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med, 2013, 368: 407-415.
關键词:微生物 微生物群 肠道共生菌 人体 遗忘的器官 ■

