基于网络药理学的六味地黄丸治疗高血压作用机制探讨△
刘云宽,高敏,林柳任,张昆,蔡俊飞,马云淑,3*
1.云南中医药大学,云南 昆明 650500;
2.昆明理工大学,云南 昆明 650500;
3.云南省高校外用给药系统与制剂技术研究重点实验室,云南 昆明 650500
高血压是一种常见的慢性病,同时也是引发心血管病的最主要危险因素,控制高血压是预防心血管疾病的关键措施[1]。目前,高血压治疗以药物治疗为主,如使用钙拮抗剂、利尿剂、β受体阻断剂等,但这些药物普遍存在不良反应较多、作用时间短、需终身服用等缺点[2-3]。六味地黄方是我国中医滋阴补肾的经典名方,至今已有近千年的应用历史。近期临床研究发现,其能显著改善高血压患者的收缩压和舒张压[4],对老年性高血压、女性更年期高血压、糖尿病合并高血压及高血压早期肾损伤均有良好的治疗效果[5-8],其与临床常用的治疗高血压的化学药物联合应用时显示出更优的治疗作用[9]。但六味地黄丸治疗高血压的分子作用机制尚未明确。本研究采用网络药理学方法,收集六味地黄丸有效化合物及预测其治疗高血压的可能作用靶点,并通过富集分析揭示其治疗高血压的可能分子机制,为六味地黄丸治疗高血压的深入研究提供参考。
1 材料与方法
1.1 六味地黄丸有效化合物的收集与作用靶点的预测
在中药系统药理学数据库和分析平台(TCMSP,http://tcmspw.com/tcmsp.php)中,以“熟地黄”“山药”“山茱萸”“茯苓”“泽泻”“牡丹皮”作为检索词收集其化合物,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18筛选出有效化合物[10-11],记录化合物的MOL号,并将下载的MOL结构输入PharmMapper平台(http://www.lilab-ecust.cn/pharmmapper/)预测作用靶点,筛选矫正分数(Norm Fit)≥0.7 的靶点,用STRING v11.0 平 台(https://string-db.org/)矫 正基因名。
1.2 六味地黄丸对高血压作用靶点的预测
在GeneCards 数据库中(https://www.genecards.org/)以“hypertension”检索高血压相关靶点,选择相关度得分≥20 的靶点作为高血压靶点,并与六味地黄丸的预测靶点一同输入Venny 2.1平台,得的共同靶点即为六味地黄丸对高血压的作用靶点,通过Cytoscape 3.6.1软件建立化合物-靶点网络。
1.3 六味地黄丸作用于高血压靶点的蛋白质-蛋白质相互作用(PPI)网络构建
将共有靶点输入STRING v11.0 平台得到靶点的相互联系网络,并用Cytoscape 3.6.1 软件进一步构建其PPI网络。
1.4 六味地黄丸作用于高血压靶点的基因本体(GO)富集与京都基因与基因组百科全书(KEGG)通路分析
在DAVID 数据库(https://david.ncifcrf.gov/summary.jsp)中导入共有靶点,从生物过程、细胞成分和分析功能进行GO 富集分析,使用GraphPad Prism 7 软件将P<0.05 的结果可视化;以KEGG 进行通路分析,用R 语言将P<0.05 的结果生成可视化气泡图。
1.5 分子对接验证
使用AutoDock 软件对六味地黄丸中的成分和PPI网络中的蛋白进行分子对接验证,并通过所得的binding-energy 得分评价化学成分与靶点间的对接效果。
2 结果
2.1 六味地黄丸有效化合物
由1.1 项下的检索方法,得到熟地黄有效化合物2 个,山药有效化合物16 个,山茱萸有效化合物20个,茯苓有效化合物15个,泽泻有效化合物10个,牡丹皮有效化合物11 个,见表1。除去药材间重复化合物,得到六味地黄丸有效化合物共69 个,共预测并校正得到5495 个靶点的标准基因名,删除重复靶点后剩余269个靶点。

表1 六味地黄丸有效化合物

续表1
2.2 六味地黄丸对高血压的作用靶点
GeneCards 数据库共检索出7913 个高血压相关靶点,相关度得分≥20 的靶点有176 个。通过Venny 2.1 平台交互六味地黄丸与高血压的靶点,得到六味地黄丸作用于高血压的靶点共14 个,见表2。将药材与其有效化合物相联系,共得到74 对相关的联系;将每个化合物和其作用于高血压的靶点相联系,共得到545 对相关的联系,通过Cytoscape 3.6.1 软件构建药物-化合物-靶点网络,见图1。结果表明,六味地黄丸治疗高血压的主要成分是茯苓酸、泽泻醇、芍药苷、谷甾醇、豆甾醇等。

图1 六味地黄丸作用于高血压的药物-化合物-靶点网络

表2 六味地黄丸作用于高血压的靶点
2.3 六味地黄丸对高血压作用靶点的PPI网络
将14 个共有靶点导入STRING v11.0 数据库中,设置靶点之间最低要求的联系分数为0.4,将结果输入Cytoscape 3.6.1 得到PPI 网络,见图2。结果显示,网络中有14 个节点、35 条边,血清白蛋白(ALB)、一氧化氮合酶3(NOS3)、表皮生长因子受体(EGFR)、肾素(REN)是其主要的作用靶点。
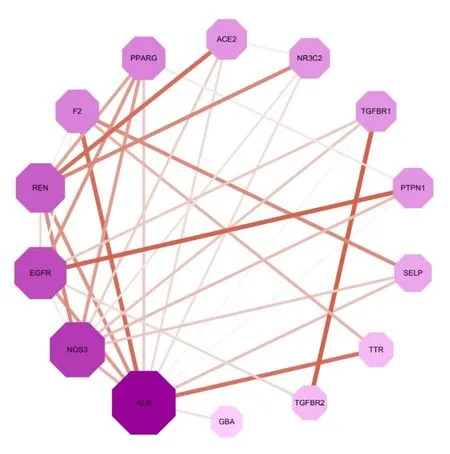
图2 六味地黄丸对高血压作用靶点的PPI网络
2.4 六味地黄丸作用于高血压靶点的GO 富集与KEGG通路分析
将共有靶点输入DAVID 数据库中,GO 富集分析结果体现在生物过程(BC)、细胞组成(CC)和分子功能(MF)3 方面,在P<0.05 条件下,这3 个方面分别得到35、7、11 个条目,取前10 个条目用GraphPad Prism 7 软件作成可视化条形图,见图3。KEGG 通路富集分析得到6 条通路(P<0.05),分别是黏附连接(adherens junction)、胰腺癌(pancreaticcancer)、破骨细胞分化(osteoclast differentiation)、FoxO 信号通路(FoxO signaling pathway)、癌症途径(pathways in cancer)、肾素-血管紧张素系统(reninangiotensin system,RAS)。黏附连接通路由4个基因靶点共同调控,分别是转化生长因子-β受体Ⅰ(TGFBR1)、转化生长因子-β受体Ⅱ(TGFBR2)、表皮生长因子受体(EGFR)、非受体型蛋白酪氨酸磷酸酶1(PTPN1);胰腺癌通路由3 个基因靶点共同调控,分别是TGFBR1、TGFBR2、EGFR;破骨细胞分化通路由3 个基因靶点共同调控,分别是TGFBR1、TGFBR2、过氧化物酶体增殖物激活受体γ(PPARG);FoxO信号通路由3个基因靶点共同调控,分别是TGFBR1、TGFBR2、EGFR;癌症途径通路由4 个基因靶点共同调控,分别是TGFBR1、TGFBR2、PPARG、EGFR;RAS 通路由2 个基因靶点共同调控,分别是血管紧张素转换酶2(ACE2)、REN,将分析结果用R 语言生成可视化气泡图,见图4。

图3 六味地黄丸对高血压作用靶点的GO富集分析

图4 六味地黄丸对高血压作用靶点的KEGG分析
2.5 分子对接验证
采用AutoDock 软件对药物-化合物-靶点网络中相关度值排名前10 位的化合物与PPI 网络中自由度较高的前4 个靶点进行分子对接。通过PDB 数据库(https://www.rcsb.org/)下载ALB、NOS3、EGFR、REN 的PDB 文件,于PyMOL 软件移除水分子和配体分子,AutoDock 软件分别对接靶点与化合物,最后将对接好的PDBQT文件导入PyMOL软件中,显示化合物和靶点相结合的位点图。分子对接结果中,蛋白质与化合物结合越紧密,结合能(binding energy)值越低,见表3。结合较紧密的前5 组分子对接见图5。
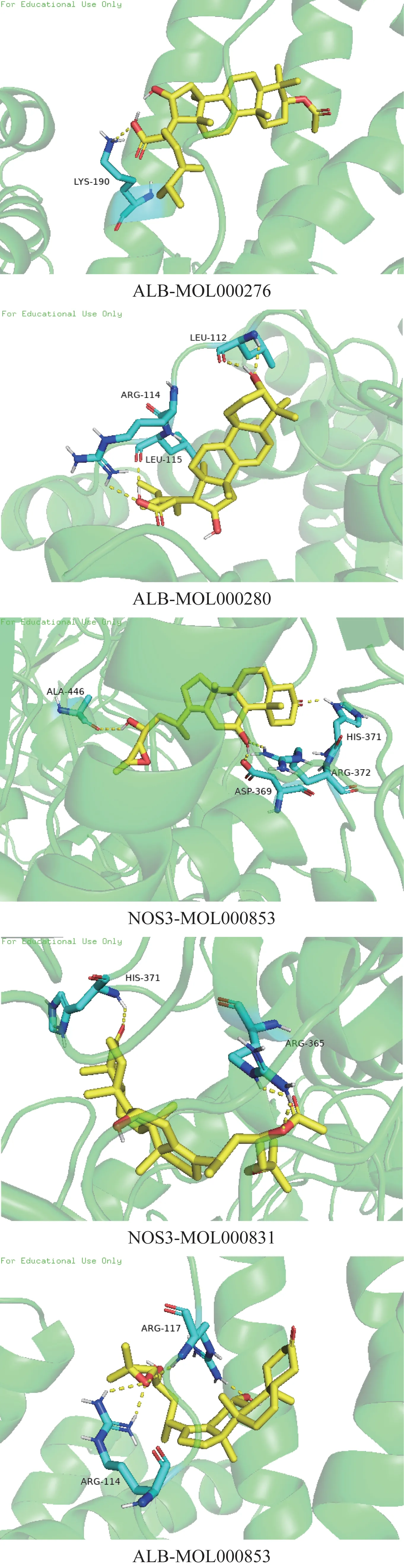
图5 六味地黄丸中作用于高血压的化合物与核心靶点的分子对接

表3 六味地黄丸作用于高血压的化合物-靶点分子对接
3 讨论
高血压的临床症状表现为头痛头晕、疲劳心悸、颈项板紧等,在传统中医学中可归属于“眩晕”“头痛”“中风”等范畴,常见于中老年人,在年轻人中发病较少。黄兴等[12]认为,中老年人高血压因体内的肾气亏虚、脏腑功能失调而致,在治疗中应重视补肾脏、调阴阳。六味地黄丸是滋阴补肾的经典名方,对高血压有明显改善、治疗作用[13-14],相关分子机制仍需不断探索。
本研究结果显示,六味地黄丸的69 个有效化合物可作用于14 个高血压靶点。茯苓酸B 作用于高血压的靶点数最多(12 个),5-{[5-(4-methoxyphenyl)-2-furyl]methylene}barbituric acid 作用于高血压的靶点数最少(2 个),说明六味地黄丸治疗高血压时确实存在多成分、多靶点的特点。alisol,b,23-acetate 及茯苓酸B 能抑制血管紧张素Ⅱ诱导的RAS/Wnt/βcatenin 轴的激活,减轻人肾皮质近曲小管上皮细胞HK-2 和足细胞的损伤,其中血管紧张素Ⅱ激活RAS,能引起高血压、慢性肾脏病发生[15];槲皮素、山柰酚、豆甾醇具有抗低密度脂蛋白氧化和抗血小板聚集作用,具有保护心血管的活性[16]。
六味地黄丸作用于高血压14 个靶点的PPI 网络显示,每个靶点与其他靶点联系的个数依次是ALB(12 个)、NOS3(9 个)、EGFR(8 个)、REN(7个)、F2(5个)、PPARG(5个)、TGFBR1(4个)、PTPN1(4 个)、ACE2(4 个)、NR3C2(4 个)、SELP(3 个)、TGFBR2(2 个)、TTR(2 个)、GBA(1个),其中靶蛋白ALB、NOS3、EGFR、REN 在蛋白相互作用网的度值较高,说明六味地黄丸可能通过以上靶点治疗高血压。王建国[17]报道高血压性脑出血患者的血肿周围的水肿程度与ALB 水平呈负相关,ALB 能通过调节凝血功能、降低炎症因子毒性、保护大脑微循环的途径改善脑功能;NOS3是心血管系统中重要的氧化应激相关因子,能双重调节血压,NOS3 可产生NO 来舒张血管从而降低血压,也能产生超氧阴离子后继而氧化成亚硝酸盐,起到促高血压作用[18];EGFR 可以调节血管张力和组织的平衡,也可以参与诱导促炎介质生成,增强血管平滑肌细胞的增殖及血管重构,从而加剧高血压等血管疾病的发展[19]。
GO 富集分析结果显示,六味地黄丸治疗高血压的相关生物过程有活性氧代谢过程的调控、对雌激素的反应、血压调节、伤口愈合、细胞生长调节、基因表达调控、上皮-间充质转化(EMT)参与心内膜垫形成的调节、细胞增殖调控、血小板活化的负调节等。Yeasmin 等[20]报道,绝经后妇女的高血压与血清中雌激素水平有关,血清雌激素水平与收缩压和舒张压水平呈负相关。在血管损伤方面有关键作用的是氧化应激,高血压人群体内的活性氧生成明显增多,抗氧化治疗能减小血管损伤、降低高血压导致的终末器官损伤[21]。高血压能引起肾脏并发症,如肾纤维化,而EMT 在肾纤维化过程中起重要作用,抑制EMT 能改善高血压对肾的损伤[22]。有高血压病史的患者体内低密度脂蛋白胆固醇增高会引起脑梗死,但过低会增加脑出血风险[23]。心房颤动(AF)是较为常见的心律失常,能引发严重的并发症而危及生命,其中高血压患者血清中的血管紧张素转化酶升高和左房内径扩大增加了AF的发生,注重高血压患者血清血管紧张素转化酶水平与左房内径能预防AF发生[24]。
KEGG 通路富集结果显示,六味地黄丸靶点富集的高血压相关通路有黏附连接、胰腺癌、破骨细胞分化、FoxO 信号通路、癌症途径、RAS。原发性高血压(EH)能促进内皮细胞和白细胞表面黏附分子的表达,这会导致内皮细胞功能紊乱及内皮损伤[25]。李小兵等[26]报道可溶性细胞间黏附分子(sICAM1)、可溶性血管细胞黏附分子(sVCAM1)在痰湿证原发性高血压患者中显著升高;平静娜等[27]报道,代谢综合征及其包括的新发糖尿病、体质量指数增高、高血压等代谢性疾病都是胰腺癌发生的危险因素;高血压患者中骨质疏松的发病率远高于正常人,可能是因为高血压引起机体某些激素水平变化,而导致老年人骨形成率降低,但破骨细胞分化、成熟和骨吸收活性相对活跃,最终导致骨质疏松,预防骨质疏松能减少及延缓高血压对靶器官的损害[28]。氧化应激反应通过PI3K/FoxO 信号通路传导及表达相关的酶和蛋白,从而引发血管内皮损伤,导致血栓形成[29]。恶性肿瘤和高血压都属于增殖性病变,高血压引起的血流动力学的改变及易栓塞倾向能加快肿瘤的发展,推动肿瘤的进程[30]。RAS属于内分泌系统,在机体中维持水电解质平衡、血压稳定、心血管系统稳定,抑制RAS 的过度激活能稳定调节细胞生长、细胞内水-钠平衡及心血管微环境,从而控制血压[31]。这些均与网络药理学的生物功能注释和通路分析一致。
综上所述,本研究通过网络药理学的方法揭示了六味地黄丸治疗高血压时存在的可能分子机制。研究结果表明,六味地黄丸通过多活性成分、多靶点、多途径发挥抗高血压作用,为该制剂的进一步药效物质基础分析和机制研究提供参考。

