产黑普氏菌破坏上皮屏障紧密连接在口腔扁平苔藓发病机制中的作用
谭正午, 徐 盼, 郭艺婷, 何 园
(同济大学口腔医学院·同济大学附属口腔医院口腔黏膜病教研室,上海牙组织修复与再生工程技术研究中心,上海 200072)
口腔扁平苔藓(oral lichen planus, OLP)是一种由T淋巴细胞介导的慢性炎症性疾病,成年人发病率为0.5%~2%[1-2],部分病损组织具有恶化癌变的倾向,至今OLP发病机制仍不明确。目前认为OLP是由多种因素引起,包括遗传因素,精神压力,创伤以及感染[3]。由于T细胞在OLP组织固有层的带状浸润,推测可能存在未知抗原被抗原呈递细胞识别,从而招募T细胞的聚集[4],对口腔黏膜上皮角质形成细胞产生慢性免疫性破坏。
近年来,越来越多的研究提示微生物可能在OLP发病中有重要作用。本课题组研究发现OLP患者颊黏膜表面微生物群落多样性增加,其菌落结构和健康对照组相比发生显著改变[5]。此外多个不同研究者的研究也发现OLP病损黏膜表面及唾液中存在菌群结构的改变[6-9],与本课题组研究结果一致。并且通过高通量测序分析发现,产黑普氏菌(Prevotellamela-ninogenica,Pm)在OLP颊黏膜表面构成比显著增加,且在目、科、属、种各层次上的差异均有统计学意义(P<0.05)[10],并且在OLP组织的上皮层和固有层均检测到产黑普氏菌的存在,提示产黑普氏菌可能在OLP的发生发展中起到重要作用[11]。
口腔上皮组织是机体与外界环境之间的屏障,口腔角质形成细胞则形成了抵御细菌攻击的第一道防线[12]。细胞与细胞之间存在着多种连接方式,包括紧密连接、黏附连接以及间隙连接。其中紧密连接主要负责离子、溶质和水、细胞旁运输以及上皮屏障完整性。紧密连接蛋白主要包括咬合蛋白Occludin、闭合蛋白Claudins、闭锁小带蛋白ZOs以及连接黏附分子JAMs[13]。紧密连接的破坏会引起紧密连接蛋白表达紊乱,导致细胞旁通透性的增加,促进细菌及其毒性物质进入组织内部,上皮屏障功能则进一步受到损害[14]。为了明确产黑普氏菌入侵OLP组织的可能机制,本研究主要探索Pm对口腔上皮细胞紧密连接的影响。
1 材料与方法
1.1 研究对象
收集2017年4月—2020年6月于同济大学附属口腔医院就诊的口腔扁平苔藓患者共12例,所有患者均经临床检查及病理学活检证实,见表1。排除标准: (1) 患有全身系统性疾病及肿瘤;(2) 涎腺疾病;(3) 近6个月使用皮质激素、免疫调节剂等药物治疗;近1个月使用抗生素;(4) 女性处于月经期、妊娠期或哺乳期;(5) 药物或银汞合金充填物可能引起苔藓样反应者;(6) 患有除口腔扁平苔藓外其他黏膜病; 正常对照组12例为拔牙或外科小手术患者,年龄、性别与实验组相匹配。所有OLP患者及对照组均签署知情同意书,本项目实验计划得到同济大学科学与伦理委员会审核与批准(伦理批准号: No.2018-002)。

表1 研究对象基本信息
1.2 细胞与细菌准备以及Pm菌种鉴定
人口腔角质形成细胞系HOK由浙江大学附属口腔医院陈谦明教授惠赠,该细胞培养于含5%胎牛血清和1%青链霉素的高糖DMEM培养基。放置在5% CO2、37 ℃孵箱内培养。
产黑普氏菌PmATCC25845和唾液链球菌(Stre-ptococcussalivarius,Ss)M18均购自美国模式培养物集存库。Pm在含5 μg/mL的氯化血红素、0.5 μg/mL的维生素K的厌氧基础培养基和血平板中37 ℃厌氧培育。唾液链球菌Ss在脑心浸液(brain heart infusion, BHI)液体培养基和BHI琼脂平板中37 ℃培育。
Pm或Ss在血平板中长成数个单菌落后,肉眼观察其形态。革兰染色: 挑取Pm或Ss单菌落至载玻片上的无菌水滴,将单菌落涂成均匀的圆形菌膜,使用革兰染色试剂盒分别进行染色,油镜下观察。PCR鉴定: 挑取Pm或Ss单菌落,根据PCR试剂盒进行PCR反应。Pm上游引物: 5’-TCTTGATAGC-TCAGTTTCTTCAATC-3’;下游引物: 5’-GCCTCA-ATCTCTGAGTGGCT-3’。PCR产物大小为114 bp。Ss上游引物: 5’-GTGTTGCCACATCTTCACTCGC-TTCGG-3’;下游引物: 5’-CGTTGATGTGCTTGA-AAGGGCACCATT-3’。PCR产物大小为542 bp。将Pm或Ss的PCR产物进行凝胶电泳,数字凝胶成像分析系统拍照。并将PCR产物进行测序。
1.3 主要试剂
革兰染色液试剂盒购自青岛海博生物技术有限公司;免疫组化试剂盒购自福州迈新生物技术开发有限公司;Anti-ZO-1抗体、Anti-JAM-1抗体购自武汉三鹰生物技术有限公司。FITC-dextran 4KD(FD4)购自德国Sigma-Aldrich公司。PCR试剂盒、TRIzol试剂、PrimerScript-RT试剂盒和qPCR试剂盒均购自宝生物工程(大连)有限公司。
1.4 方法
1.4.1 免疫组织化学染色 将标本应用4%的多聚甲醛固定、石蜡包埋、切片、脱蜡、水化、流水冲洗以及抗原修复。根据迈新免疫组化试剂盒说明进行内源性过氧化物酶阻断,加非特异性染色阻断剂,一抗ZO-1或JAM-1 4 ℃过夜孵育。加生物素标记的IgG聚合物、链霉菌抗生物素蛋白-过氧化物酶。DAB显色液显色,苏木精复染,封片,显微镜下观察,拍照,Image Pro Plus软件半定量分析。
1.4.2 细菌与细胞共培养 将在液体培养基中生长到OD600值为1的Pm或Ss,吸取2 mL的菌液至离心管离心(离心半径8.27 cm,3 000 r/min,5 min),离心后去上清液,用PBS清洗2~3次后,离心后去上清液,用2 mL不含血清和青-链霉素的高糖DMEM重悬,即2 mL含Pm或Ss的DMEM,室温放置备用。将培养的12孔HOK细胞去除培养基,PBS清洗,去除PBS,加入DMEM培养基。从含Pm的DMEM中分别吸取0、1、10、50 μL感染细胞24 h,或均吸取50 μL感染细胞0、4、10、24 h。感染细胞放置在含5%CO2的37 ℃孵箱内培养。
1.4.3 上皮渗透性分析 HOK细胞接种于Transwell上室。当细胞长满,从含Pm或Ss的DMEM中分别吸取0、1、2、5、10 μL加至Transwell上室中感染HOK细胞4 h。去除上室培养基,加入新的培养基,并在每孔上室加入10 μL 10 mg/mL的FD4。1 h后应用多功能酶标仪检测下室中FD4的荧光信号强度。设置激发波长、发射波长分别为485、528 nm。
1.4.4 总RNA提取与反转录 根据氯仿法提取细胞总RNA,将感染后的细胞培养皿取出后去除培养基,PBS清洗3次后并去除,每孔加入TRIzol 250 μL,用细胞刮刮取贴壁细胞后收集至RNase-free的离心管内,每管50 μL氯仿,剧烈振荡15 s,冰上放置10 min,4 ℃离心(离心半径8.27 cm,12 000 r/min,15 min),吸上层水相转移至另一离心管内,加入等体积异丙醇,彻底混匀,冰上放置15 min后,4 ℃离心(离心半径8.27 cm,12 000 r/min,10 min),弃上清液,75%乙醇清洗沉淀,4 ℃离心(离心半径8.27 cm,7 500 r/min,5 min),弃上清液,DEPC水溶解沉淀。根据反转录试剂盒说明书反转RNA为cDNA,调整终浓度为25 ng/μL。
1.4.5 实时荧光定量PCR 检测Pm与HOK细胞共培养后,紧密连接基因ZO-1、JAM-1、Occludin、Claudin-2、Claudin-3和Claudin-4的表达变化。引物序列见表2。引物设计由苏州金唯智生物科技有限公司定制。根据qPCR试剂盒说明书配制反应体系。qPCR仪扩增反应程序: 94 ℃ 30 s;94 ℃ 5 s,61 ℃ 30 s,40个循环,分析相关基因的相对表达情况。

表2 实时荧光定量PCR引物序列
1.5 统计学处理
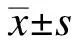
2 结 果
2.1 产黑普氏菌Pm菌种鉴定结果
将Pm分别进行肉眼观察,革兰染色以及PCR鉴定。革兰染色可见Pm被染成红色,证明其为革兰阴性菌。PCR电泳图显示1号和2号泳道可见约114 bp的单一特异性电泳条带,NTC阴性对照未见电泳条带。将PCR产物测序并与NCBI核酸序列数据库进行比对,产物序列与Pm的一段基因序列覆盖率为99%,一致度为100%,见图1。

图1 产黑普氏菌Pm菌种鉴定Fig.1 Identification of Prevotella melaninogenica strainsA: Pm在血平板的菌落形态;B: 1 000倍油镜下Pm的革兰染色;C: 菌落PCR电泳图,1、2: Pm,M: DL2 000 DNA标记,NTC: 阴性对照;D: 序列碱基配对具体情况
2.2 唾液链球菌Ss菌种鉴定结果
将Ss分别进行肉眼观察,革兰染色以及PCR鉴定。革兰染色可见Ss被染成蓝色,证明其为革兰阳性菌。PCR电泳图显示1号和2号泳道可见约542 bp的单一特异性电泳条带,NTC阴性对照未见电泳条带。将PCR产物测序并与NCBI核酸序列数据库进行比对,产物序列与Ss的一段基因序列覆盖率和一致度均为100%,碱基完全配对,见图2。
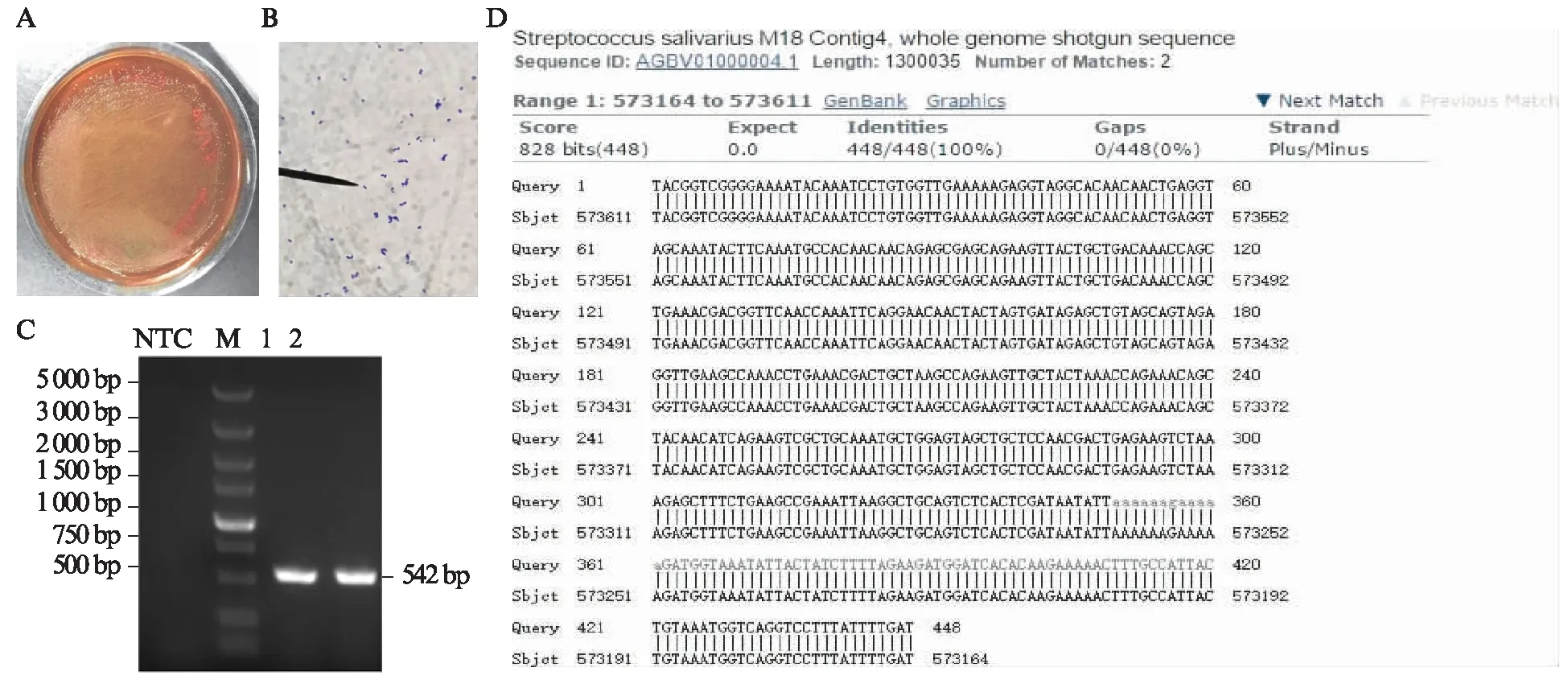
图2 唾液链球菌Ss菌种鉴定Fig.2 Identification of Streptococcus salivarius strainsA: Ss在BHI琼脂平板的菌落形态;B: 1 000倍油镜下Ss的革兰染色;C: 菌落PCR电泳图,1、2: Ss,M: DL5 000 DNA标记,NTC: 阴性对照;D: 序列碱基配对具体情况
2.3 上皮连接蛋白ZO-1,JAM-1在OLP组织和正常组织中的表达情况
为了检测OLP病损组织的上皮屏障功能是否存在变化,通过免疫组化染色观察上皮连接蛋白ZO-1,JAM-1在组织中的表达。ZO-1在正常组织中主要在上皮角化层、颗粒层和基底层细胞的胞膜和胞质中表达,见图3A。OLP组织上皮层中ZO-1的表达明显低于正常组织(P<0.05),见图3B、图4A。JAM-1在正常组织中上皮颗粒层和棘层细胞的胞膜和胞质中呈强阳性表达,见图3C。OLP组织上皮层中JAM-1的表达显著低于正常组织(P<0.000 1),见图3D、图4B。
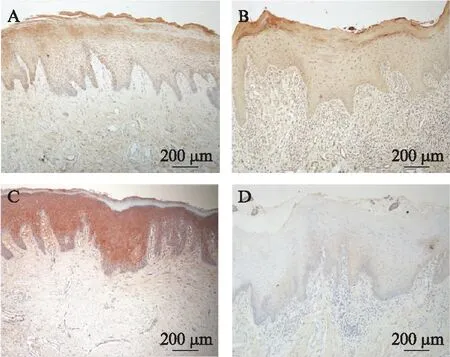
图3 ZO-1和JAM-1在正常组织和OLP 组织中的表达情况Fig.3 Expression of ZO-1 and JAM-1 in normal and OLP tissue A: 正常组织ZO-1表达(×100);B: OLP组织ZO-1表达(×100);C: 正 常组织JAM-1表达(×100);D: OLP组织JAM-1表达(×100)

图4 正常组织和OLP组织中ZO-1和 JAM-1蛋白半定量表达比较Fig.4 Comparison of semi-quantitative expression of ZO-1 and JAM-1 in normal tissue and OLP tissue A: ZO-1在正常组织和OLP组织中的相对表达量;B: JAM-1在正常组织和OLP组织中的相对表达量,*P<0.05;****P<0.000 1
2.4 Pm对HOK细胞屏障功能的影响
为了明确Pm对HOK上皮细胞屏障功能的影响,应用不同浓度的Pm与HOK在上室共培养后4 h 后,在上室加入荧光素FD4,1 h后检测从上室中渗透至下室的FD4的吸光度。吸光度值越高,提示上皮细胞屏障受损越严重。Pm(1、2、5、10 μL)各组与对照组Pm(0 μL)相比,下室中FD4的吸光度均明显增强,差异有统计学意义(P<0.05),见图5A。以Ss为对照菌与HOK细胞共培养。Ss(1、2、5、10 μL)各组与对照组Ss(0 μL)相比,下室中FD4的吸光度差异均无统计学意义(P>0.05),见图5B。
2.5 不同浓度Pm刺激HOK细胞后紧密连接蛋白mRNA的表达变化
将不同浓度的Pm与HOK细胞共培养,应用RT-qPCR检测HOK细胞ZO-1、JAM-1、Occludin、Claudin-2、Claudin-3和Claudin-4的含量变化情况。Pm(1、10、50 μL)刺激HOK细胞24 h后ZO-1的表达均显著减少(P<0.001);JAM-1在Pm(50 μL)的刺激下表达显著减少(P<0.05)。而Occludin、Claudin-2、Claudin-3和Claudin-4在不同浓度Pm刺激下无明显变化(P>0.05)。见图6。
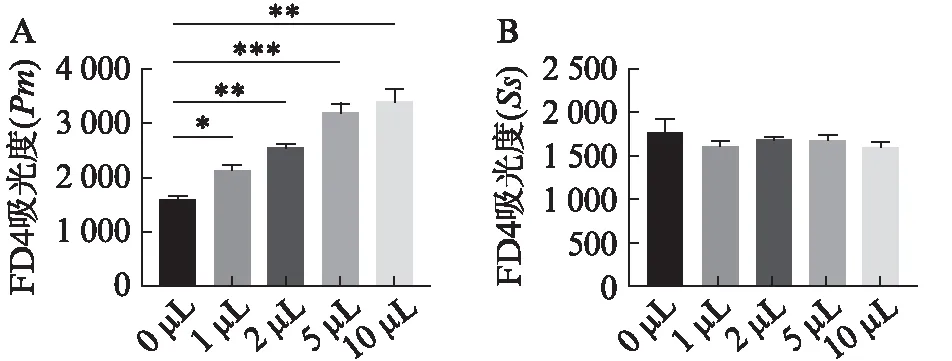
图5 Pm和Ss对HOK细胞屏障功能的影响Fig.5 Effects of Pm and Ss on barrier function of HOK cellsA: 从含Pm的DMEM中分别吸取0、1、2、5、10 μL刺激HOK细胞后,下室FD4吸光度的强度变化;B: 从含Ss的DMEM中分别吸取0、1、2、5、10 μL刺激HOK细胞后,下室FD4吸光度的强度变化;*P<0.05;**P<0.01;***P<0.001
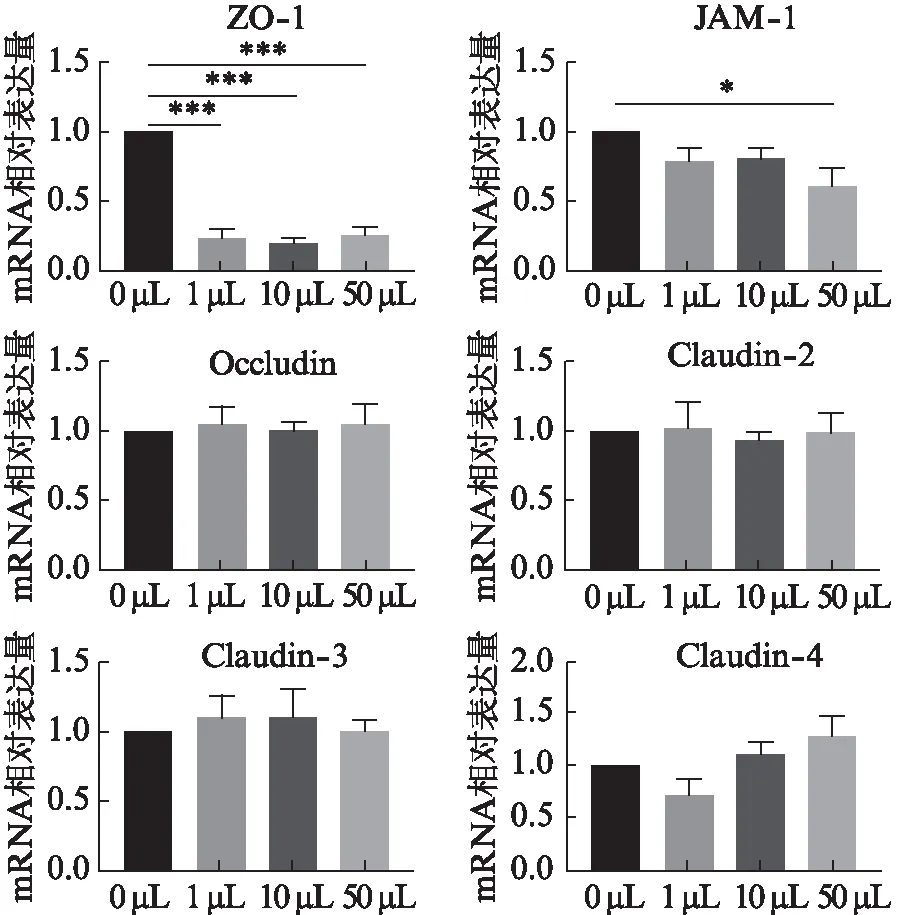
图6 不同浓度Pm对HOK细胞紧密 连接蛋白mRNA表达的影响Fig.6 Effects of different concentrations of Pm on the expression of tight junction proteins mRNA in HOK cells从含Pm的DMEM中分别吸取0、1、5、50 μL与HOK细胞共培养24 h后ZO-1、JAM-1、Occludin、Claudin-2、Claudin-3和Claudin-4的表达情况;*P<0.05;**P<0.01;***P<0.001
2.6 相同浓度Pm刺激HOK细胞不同时间下紧密连接蛋白mRNA的表达变化
将相同浓度的Pm与HOK细胞共培养不同时间,应用RT-qPCR检测HOK细胞ZO-1、JAM-1、Occludin、Claudin-2、Claudin-3和Claudin-4的mRNA表达变化情况。在50 μLPm刺激HOK细胞0、4、10、24 h的情况下,ZO-1的表达在4、10、24 h均显著减少(P<0.01);JAM-1的表达在4、10、24 h同样明显减少(P<0.05)。而Occludin、Claudin-2、Claudin-3和Claudin-4在Pm刺激不同时间的情况下无明显变化(P>0.05)。见图7。

图7 相同浓度Pm在不同时间对HOK细胞紧密 连接蛋白mRNA表达的影响Fig.7 Effects of the same concentration of Pm on the expression of tight junction proteins mRNA in HOK cells for different duration从含Pm的DMEM中均吸取50 μL与HOK细胞共培养0、4、10、24 h后ZO-1、JAM-1、Occludin、Claudin-2、Claudin-3和Claudin-4的表达情况;*P<0.05;**P<0.01;***P<0.001
3 讨 论
口腔中存在700多种细菌,这些细菌定植于龈沟、口腔黏膜以及牙齿表面。口腔黏膜上皮主要组成细胞为口腔上皮角质形成细胞。口腔上皮细胞时刻抵御微生物的入侵,维持黏膜组织的完整和健康。OLP组织的病理表现包括上皮萎缩、角化过度以及基底细胞液化变性,这些均提示OLP上皮屏障遭到破坏[15]。有研究证实OLP组织上皮层和固有层均存在细菌的入侵,并且固有层的细菌与浸润的CD3+、CD4+、CD8+细胞呈正相关[16]。细菌及其产物可能作为一种外界抗原被基底角化细胞和抗原提呈细胞识别并激活自身,招募和诱导T淋巴细胞在固有层的浸润[17]。
本课题组前期通过高通量测序检测OLP颊黏膜病损表面菌群,发现Pm在OLP颊黏膜表面构成比显著增加,且在目、科、属、种各层次上的差异均有统计学意义[5]。OLP病损组织中Pm含量也显著高于正常组织,且Pm与IL-6的表达呈正相关[10]。并通过荧光原位杂交实验(fluorescence in situ hybr-idization, FISH)发现在61.54%的OLP病损组织中可以检测到Pm信号,该菌可入侵至上皮层及固有层,且在上皮与固有层连接的上皮乳突处大量存在,但在正常口腔黏膜组织中并未发现Pm的侵入[11]。然而Pm侵入OLP组织内部的机制目前尚不清楚。
上皮屏障主要由细胞连接调控,其中细胞连接之一的紧密连接负责调控离子、溶质和水的细胞旁运输,维持着上皮屏障的稳定。ZO-1和JAM-1则是构成上皮紧密连接的主要蛋白。ZO-1是第一个被确定的紧密连接相关蛋白,是连接跨膜蛋白Occludin和细胞骨架肌动蛋白的桥梁,在稳定细胞间连接复合体,维持上皮屏障稳定方面起到重要作用[18]。JAM-1是一种免疫球蛋白超家族蛋白,能够控制营养物质和溶质穿过上皮表面[19],此外还具有调节细胞迁移、细胞极性、细胞旁通透性和增殖的作用[20]。
本研究通过对OLP病损组织和正常组织中紧密连接蛋白ZO-1,JAM-1进行免疫组化染色,结果发现ZO-1和JAM-1在OLP组织中的蛋白表达明显减少,提示OLP组织的上皮屏障的完整性遭到破坏。唾液链球菌Ss在正常口腔中大量存在,是口腔微生物群中的优势菌之一[21]。因此本研究选择Ss作为对照菌来检测其对上皮细胞屏障功能的影响。Transwell上皮屏障渗透性实验中,下室FD4吸光度随着Pm浓度的增加而增加,Ss浓度增加则未导致FD4吸光度的变化,说明Pm能够损伤细胞形成的屏障,促进FD4穿过上室进入下室。人口腔角质形成细胞HOK是研究OLP疾病最常用的正常口腔上皮细胞。因此将Pm与HOK共培养,发现ZO-1、JAM-1的mRNA相对表达量随着Pm浓度的增加和刺激时间的延长均显著减少,而其他紧密连接蛋白Occludin、Claudin-2、Claudin-3和Claudin-4的mRNA表达在Pm的作用下无明显改变。以上提示Pm能够抑制紧密连接蛋白ZO-1和JAM-1表达,导致上皮屏障功能损害。
Pm是一种革兰阴性厌氧球杆菌,与根管内、根尖周感染[22]以及牙周炎[23]密切相关。Pm含有与牙周主要致病菌牙龈卟啉单胞菌同源的IX型分沁系统(type IX secretion system, T9SS)[24]。牙龈卟啉单胞菌可通过T9SS分泌其牙龈蛋白酶降解牙龈上皮细胞之间的紧密连接蛋白Claudin1和JAM-1,导致上皮屏障功能受损[25-26]。紧密连接紊乱将导致细胞极性丧失,而细胞极性的丧失是上皮组织损伤的早期标志之一[27]。因此,推测Pm亦可通过T9SS分泌蛋白酶降解紧密连接蛋白ZO-1,JAM-1,导致OLP组织上皮渗透性增加,完整性受损。促使Pm及其毒性因子进入上皮深层组织,作为靶抗原被抗原呈递细胞识别,促使炎症通路激活,诱导炎症因子和趋化因子表达,募集T淋巴细胞在上皮固有层浸润,使基底细胞液化变性,上皮屏障进一步破坏,从而导致OLP慢性炎症的发生。
综上所述,Pm可能通过抑制紧密连接蛋白ZO-1、JAM-1的表达破坏OLP上皮组织屏障,从而侵入上皮组织导致慢性炎症。Pm可能在OLP疾病的发生发展中起到重要作用。

