5-羟色胺4受体激动剂对糖尿病小鼠结肠黏膜巨噬细胞极化的影响
寇玥婷, 成颖莹, 王 娟, 戎伟芳, 张国花
(上海交通大学医学院解剖学与生理学系,上海 200025)
糖尿病是一种慢性代谢性疾病,其消化道并发症比较常见,如胃轻瘫、便秘、腹泻等[1-2]。巨噬细胞主要分为促炎M1型和抗炎M2型[3],M1型巨噬细胞产生促炎型介质一氧化氮合酶(inducible nitric oxide synthase, iNOS)和肿瘤坏死因子(tumor necrosis factor-α, TNF-α),在宿主防御中发挥作用,但是也会引起炎症反应和组织破坏;M2型巨噬细胞的主要产物是白介素10(interleukin 10, IL-10)和精氨酸酶1(arginase 1, Arg1),并在抑制炎症和促进损伤修复中发挥作用[4]。有研究报道糖尿病可引起肌层巨噬细胞向M1型极化,从而导致小鼠出现胃轻瘫[5]。5-羟色胺(5-hydroxytryptamine, 5-HT)及其受体对消化道正常生理功能及病理生理发生均有重要的调控作用[6-12]。其中,5-HT4受体(5-HT4receptor, 5-HT4R)存在于消化道的肠神经系统、黏膜层的上皮细胞以及杯状细胞中[12],主要参与肠道神经保护、免疫反应和炎症调控[6,8,11]。本研究旨在探讨糖尿病结肠黏膜层巨噬细胞表型的变化及5-HT4R激动剂对巨噬细胞功能变化的影响。
1 材料与方法
1.1 实验动物
CX3CR1-GFP+C57BL/6小鼠(巨噬细胞基因报告小鼠[13-14])由上海交通大学医学院高小玲研究员提供,在上海交通大学医学院实验动物中心繁殖饲养,自由进食饮水,光照时间为每天8:00~20:00。恒温25 ℃。取2~3月龄、体重20~25 g的雄性小鼠30只进行实验。
1.2 试剂与仪器
1.2.1 主要药品与试剂 链脲佐菌素(strepto-zotocin, STZ)购于美国Sigma公司;RS67333购于英国Tocris公司;RNAscope®荧光检测试剂盒购于美国Advanced cell diagnosis(ACD)公司。
1.2.2 主要仪器 罗康全活力型血糖仪及血糖试纸购自德国罗氏诊断有限公司;冰冻切片机、激光共聚焦显微镜购自德国Leica公司;HybEZTM Ⅱ Oven购自美国ACD公司。
1.3 方法
1.3.1 1型糖尿病模型的建立 将STZ溶解于0.01 mol/L预冷的pH=4.0的柠檬酸-柠檬酸钠缓冲液,小鼠禁食24 h后腹腔注射给予STZ(150 mg/kg)[15-16],对照组小鼠注射等体积的缓冲溶液。3 d后检测血糖水平,血糖浓度≥20 mmol/L的小鼠用于后续实验。实验过程期间连续监测小鼠的体重和血糖变化。
1.3.2 5-HT4R激动剂给药方案 将实验动物随机分为3组: 非糖尿病组、糖尿病对照组和糖尿病给药组,每组10只。根据本研究组工作[17]和预实验,在小鼠糖尿病模型建立2周后开始给药,腹腔注射5-HT4R激动剂RS67333(1 mg/kg),隔天1次,共6次;对照组注射等体积的生理盐水。在实验过程中,死亡和血糖出现明显波动的动物不进行后续检测。
1.3.3 免疫荧光检测巨噬细胞标记物的表达 药物处理结束后第2天用4%PFA 经心脏灌流固定,取出远端结肠组织(1 cm)在4%PFA中后固定,然后经30%蔗糖溶液脱水后用OCT包埋冻存。将冰冻组织切片(15 μm)后贴于黏附载玻片上,用0.05 mol/L 的PBS冲洗3次,用10%羊血清于1% PBST在室温下封闭1 h,一抗为大鼠抗F4/80,APC(1∶100,eBioscience)或兔抗iba1(1∶1 000,DAKO)室温4 h后4 ℃孵育过夜,用Alexa fluro 568标记的羊抗兔(1∶1 000)和DAPI(1∶1 000)常温下孵育1 h。0.05 mol/L PBS清洗后用封片剂封片。使用激光共聚焦显微镜拍照。
1.3.4 小鼠结肠组织巨噬细胞形态数量变化检测 药物处理结束后第2天,用4%PFA经心脏灌流固定,取出远端结肠组织(1 cm)在4%PFA中后固定,然后经30%蔗糖溶液脱水后用OCT包埋冻存。将冰冻组织切片(15 μm)后贴于黏附载玻片上,用0.05 mol/L的PBS冲洗3次,用含有DAPI的封片剂封片。使用激光共聚焦显微镜拍照,每组4只动物,随机选取每只动物结肠标本2~3个视野,使用Image J软件计数单位面积下CX3CR1-GFP+的细胞数目,统计时每组例数为动物数×视野数,即每组n=9。
1.3.5 RNAscope检测Arg1和iNOS的表达变化 慢性给予RS67333后第2天经心脏灌流4%PFA进行前固定,取出远端结肠组织(1 cm)继续在4%PFA中后固定,然后经30%蔗糖脱水后用OCT包埋冻存。将冰冻组织切至15 μm后贴于黏附载玻片上。根据说明书要求,用双氧水处理,并进行靶标修复以及酶消处理。在40 ℃的杂交炉内进行探针杂交。探针为购于美国ACD公司的RNAscope®Probe-Mm-Nos2-C2和RNAscope®Probe-Mm-Arg1。最后ddH2O清洗后,滴加封片剂封片。使用共聚焦显微镜拍照,每组3~4只动物,随机选取每只动物结肠标本2~3个视野,使用Image J软件计算结肠组织中Arg1和iNOS荧光面积的变化,统计时每组例数为动物数×视野数,即每组n=8。
1.4 统计学处理
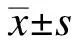
2 结 果
2.1 外源性给予5-HT4R激动剂对糖尿病小鼠体重及血糖的影响
如图1所示,糖尿病小鼠相对于非糖尿病小鼠出现明显体重降低和血糖增高,而外源性给予5-HT4R 激动剂RS67333不能改变糖尿病小鼠的体重下降(P>0.05)和血糖升高(P>0.05)。
2.2 巨噬细胞标记物F4/80和iba1的表达
如图2所示,利用免疫荧光方法检测发现,在结肠黏膜层中,两种巨噬细胞标记物F4/80和iba1免疫阳性表达的细胞与CX3CR1-GFP+细胞基本共定位。
2.3 外源性给予5-HT4R激动剂对糖尿病小鼠结肠黏膜层巨噬细胞活化的影响
如图3所示,利用CX3CR1-GFP+巨噬细胞基因报告小鼠检测发现,糖尿病小鼠相对于非糖尿病小鼠结肠黏膜层中的巨噬细胞(CX3CR1-GFP+细胞)形态发生明显改变,由成纤维样变为卵圆不规则形,出现了活化(图3箭头所示细胞);给予RS67333处理的小鼠结肠黏膜层中的巨噬细胞既有成纤维样也有卵圆不规则形。利用Image J软件分析糖尿病小鼠结肠黏膜层活化(横径≥7 μm)的巨噬细胞数目明显多于非糖尿病小鼠(P<0.001),而慢性(隔天1次,共6次)给予RS67333可以明显抑制糖尿病小鼠结肠黏膜巨噬细胞的活化(P<0.001)。
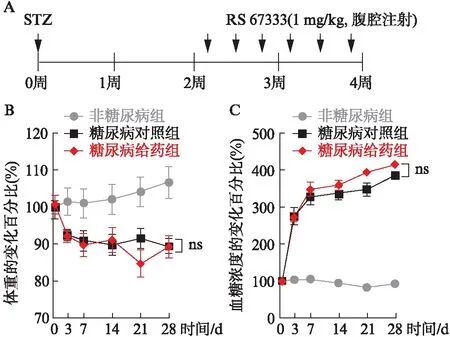
图1 5-HT4R激动剂对糖尿病小鼠体重和血糖的影响Fig.1 The effects of 5-HT4R agonist on the body weight and blood glucose of diabetic miceA: 给予动物外源性5-HT4R激动剂RS67333方案;B~C: 外源性5-HT4R激动剂对糖尿病小鼠体重与血糖的影响;糖尿病对照动物体重下降和血糖升高,外源性给予5-HT4R激动剂对糖尿病小鼠体重下降和血糖升高没有影响(P>0.05)

图2 巨噬细胞标记物F4/80和iba1在结肠组织 黏膜层的表达例图Fig.2 The example of microphotographs for the expression of F4/80 and IBA1, macrophage biomarkers, in the mucosa of colon不管是F4/80免疫阳性细胞还是iba1免疫阳性细胞,与CX3CR1-GFP+细胞基本共定位
2.4 外源性给予5-HT4R激动剂对糖尿病小鼠结肠黏膜Arg1和iNOS表达的影响
如图4A所示,非糖尿病小鼠结肠组织中Arg1(M2型巨噬细胞产物)信号点在结肠的黏膜固有层、黏膜下层以及肌层均有分布;糖尿病小鼠结肠黏膜固有层Arg1信号点明显减少;与糖尿病对照组小鼠相比,给予RS67333处理的小鼠结肠黏膜固有层Arg1信号点有所增加。利用Image J分析发现糖尿病小鼠结肠黏膜层Arg1阳性表达的面积明显低于非糖尿病小鼠(P<0.001),而慢性给予RS67333可以减弱糖尿病小鼠Arg1的表达下调(P<0.05),见表1和图4C。如图4B所示,非糖尿病小鼠iNOS(M1型巨噬细胞产物)信号点主要分布在结肠黏膜层肠腔边界表面和基底部的上皮细胞中;糖尿病小鼠iNOS信号点主要分布在黏膜层腔侧的上皮细胞和固有层中;给予RS67333处理的小鼠iNOS信号点主要分布在黏膜层基底部的腺上皮细胞中。利用Image J分析发现糖尿病小鼠结肠黏膜层腔侧iNOS阳性表达的面积明显高于非糖尿病小鼠(P<0.001),而慢性给予RS67333可以明显减弱糖尿病小鼠黏膜层腔侧iNOS的表达上调(P<0.01),见表1和图4C。
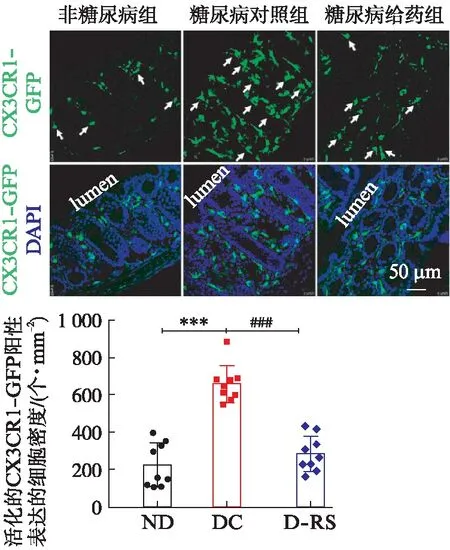
图3 5-HT4R激动剂对糖尿病小鼠结肠黏膜 巨噬细胞活化的影响Fig.3 The effects of 5-HT4R agonist on the macrophage activation in colonic mucosa of diabetic miceND: 非糖尿病组; DC: 糖尿病对照组;D-RS: 糖尿病给药组;箭头表示横径≥7 μm的部分活化细胞;与ND组相比, ***P<0.001;与DC组相比,###P<0.001

表1 Arg1和iNOS的表达变化
图4 5-HT4R激动剂对糖尿病小鼠结肠黏膜 Arg1和iNOS表达的影响Fig.4 The effects of 5-HT4R agonist on the expression of Arg1 and iNOS in colonic mucosa of diabetic miceA: Arg1在结肠黏膜固有层表达变化例图;B: iNOS在结肠黏膜层表达变化例图;C: Arg1和iNOS表达变化的统计图;ND: 非糖尿病组;DC: 糖尿病对照组;D-RS: 糖尿病给药组;与ND组相比,***P<0.001,与DC组相比,#P<0.05,##P<0.01
3 讨 论
中国人群糖尿病患病率的最新全国流行病学调查结果表明,成人总糖尿病患病率为11.2%,总人数估计为1.298亿,依旧呈持续上升趋势[18]。糖尿病是全球重要的健康问题,其并发症严重影响患者的生活质量,临床治疗有限,尚需深入研究。
糖尿病常常引起肠道动力障碍[17]、黏膜屏障功能损伤[19]、肠道菌群紊乱[20]和肠道免疫功能异常[21]。有研究报道糖尿病引起肌层巨噬细胞向促炎型M1极化导致胃排空减慢[5]。巨噬细胞是异质免疫细胞群,具有不同的起源和功能[22]。在精氨酸代谢的基础上可以将M1和M2巨噬细胞区分开,其中M1巨噬细胞通过iNOS优先将精氨酸代谢为一氧化氮(nitric oxide, NO);而M2巨噬细胞则通过Arg1优先将精氨酸代谢为鸟氨酸。与M1巨噬细胞的大多数圆形/卵形形态相反,M2巨噬细胞具有伸长的成纤维细胞样形态。NO的产生与微生物或肿瘤细胞的杀伤有关,并表征M1型巨噬细胞应答;而精氨酸酶的表达(鸟氨酸的产生)与修复有关,并表征M2型巨噬细胞应答[23]。本次首先验证CX3CR1-GFP+的细胞基本与巨噬细胞标记物表达阳性的细胞共定位,因此可以利用CX3CR1-GFP+报告鼠检测巨噬细胞的结构和功能变化。接下来,利用CX3CR1-GFP+报告鼠观察到糖尿病时结肠黏膜层巨噬细胞的形态发生了改变,大部分细胞呈卵圆不规则形,与M1型巨噬细胞形态一致。另外,利用新一代RNA原位杂交技术RNAscope检测iNOS和Arg1的表达,发现糖尿病时固有层中Arg1表达明显下降;而iNOS在糖尿病时主要是分布在黏膜层腔侧处的表达会上调,并出现在固有层中。有研究报道上皮细胞也表达iNOS[24],与本研究中的结果一致。然而,本研究发现糖尿病时黏膜层基底侧上皮细胞中的iNOS表达下调、腔侧固有层中的iNOS表达上调,这一结果提示糖尿病时上皮细胞分泌的iNOS与巨噬细胞分泌的iNOS作用可能不同,需要进一步的实验验证。以前的研究均采用qPCR方法检测Arg1和iNOS的表达,无法看到它们的空间分布;而RNAscope方法能够可视化这些信号的空间位置。但是,今后尚需进一步优化这一技术,能更加明确这些信号的细胞来源。
肠嗜铬细胞(enterochromaffin cells, EC细胞)只占肠上皮细胞的1%,但却产生超过90%的体内5-HT。EC细胞不仅可以感受菌群代谢产物和各种刺激物等肠腔微环境的变化[9],而且释放的5-HT作用其受体调节消化道运动、消化液分泌、免疫细胞功能和血管舒张[25-28]。5-HT4R激动剂在临床上已有广泛的应用,可用于治疗功能性消化不良、胃轻瘫、慢性便秘以及肠易激综合征[26,29-32]。有研究报道5-HT4R激动剂可以调节肠道肌层中巨噬细胞的功能: 在术前患者体内注射5-HT4R激动剂普鲁卡必利引起肌间神经丛的胆碱能神经元释放乙酰胆碱(acetylcholine, ACh)来介导抗炎作用,即ACh激活肌层巨噬细胞上的a7nAChR以抑制肠道手术后引起的炎症反应[11]。本研究旨在探讨5-HT4R激动剂对糖尿病引起的肠道黏膜层巨噬细胞功能变化的影响。本次研究发现慢性5-HT4R激动剂处理可以减弱糖尿病引起的结肠黏膜层M1型巨噬细胞样形态改变;而RNAScope检测结果进一步验证了5-HT4R激动剂抑制糖尿病引起的结肠黏膜层M2型巨噬细胞向M1型极化。
糖尿病会引起肠道屏障功能的损伤和肠通透性的增加,又称“肠泄漏”[19],并且引起肠道菌群的丰度及种类发生变化,如粪肠球菌会引起巨噬细胞向M1型极化,这些因素都会导致巨噬细胞向M1型极化[33]。而给予5-HT4R激动剂可以抑制巨噬细胞向M1型极化,推测可能是5-HT4R激活改善了肠道黏膜屏障功能从而抑制肠道菌群促进巨噬细胞向M1型极化的改变: (1) 5-HT4R不仅存在于黏膜下和肌间神经丛,更多分布在黏膜层的肠上皮细胞以及杯状细胞中[12];(2) 研究表明肠上皮细胞的5-HT4R的激活可以通过促进上皮增殖及迁移能力以及抵抗氧化应激诱导的细胞凋亡从而对肠道屏障功能起到保护作用[8];(3)杯状细胞通过分泌黏液阻挡有害物质和肠菌对上皮细胞的侵袭,此类细胞上5-HT4R的激活可以促进杯状细胞脱颗粒进而分泌黏液,起到保护黏膜作用[34]。
综上,糖尿病时结肠黏膜层巨噬细胞发生M1极化,而5-HT4R激动剂可以抑制糖尿病引起的巨噬细胞M1极化。这些结果提示5-HT4R参与调节糖尿病肠道巨噬细胞功能。

