巢湖铜绿微囊藻的分离鉴定及其生长特性研究
王 然, 朱传雪, 岳俊阳, 刘永胜
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
巢湖位于安徽省中部,隶属长江水系下游湖泊,是我国五大淡水湖之一。由于近年来工业、农业及生活废水的大量排放,使得巢湖水体中氮、磷等元素严重超标,富营养化程度加剧,从而导致湖水中藻类生物(主要是蓝藻)的异常繁殖,形成水华现象[1-2]。已有研究显示巢湖蓝藻水华的分布具有明显的季节性,并且极易受到天气和风向的影响,但主要集聚于西部水域的湖滨带[3]。每年夏季,巢湖大面积暴发的蓝藻水华不仅造成水体功能下降和水质性缺水,而且还会散发强烈的异味,严重影响周边的农业生产和居民的身心健康[4]。
目前,用于巢湖蓝藻治理的主要技术包括物理方法、化学方法和生物方法三大类[5-7]。其中,物理方法(如人工打捞)仍然是水华集中暴发时的主要除藻手段,却无法从根本上缓解水华现状。生物方法因其灵敏长效、环境友好、生态安全性高而被认为是一种最具前景的预防治理途径,但能够成熟应用的技术还不多,往往处于初始研究阶段。因此对巢湖蓝藻水华集中暴发时优势种群的分离、鉴定和生长特性研究至关重要。
微囊藻属于蓝藻门色球臻科徽囊藻属,是一类全球性分布的蓝藻,也是淡水水华中常见的优势藻类[8-9]。巢湖蓝藻水华中,微囊藻在数量和发生频率上均占优势,并且呈现季节性特征。文献[10]研究表明在夏、秋两季微囊藻在水华蓝藻中占绝对优势,其生物量可达7.96×108个/L。微囊藻是小型且没有鞘包裹的球状细胞,但在自然水体中,微囊藻细胞通常会相互聚集在一起,形成肉眼可见的群体菌落。根据其在水华发生过程中是否产生毒素,微囊藻可分为产毒微囊藻和非产毒微囊藻两类。其中,产毒微囊藻释放的微囊藻毒素(microcystin,MC)会影响水体中动物和植物的正常生长,甚至能够通过饮用水和食物链等途径进入人体,引发肝炎等疾病,严重威胁人类的身心健康[11-15]。
本文通过将巢湖水华暴发时水华区域的蓝藻进行分离、纯化鉴定得到巢湖蓝藻中的优势菌株铜绿微囊藻,并研究了铜绿微囊藻的产毒特点及在光照、温度和pH值等不同条件下的生长特性,以探索不同生态条件对巢湖水华的影响。为预测巢湖水华爆发时间及多发水域,并改善巢湖水体的富营养化现状,减轻水华污染提供理论依据。
1 材料与方法
1.1 材料
1.1.1 蓝藻的收集
蓝藻采集于巢湖水华暴发时西湖岸周边的巢湖水体(北纬N31°34′46″,东经E117°18′39″),取样地点如图1所示,图1红色箭头指示为取样地点。

图1 蓝藻水体采样地点示意图
1.1.2 培养基的配置
本文共使用了3种不同的培养基,包括BG-11、MA和Knop培养基,3种培养基的pH值分别为7.0、8.0、7.5。培养基配方分别见表1~表3所列。其中,表1中母液质量浓度应稀释100倍使用。若配置固体培养基,则在相应的液体培养基基础上添加1.5%的琼脂。所有培养基都经121 ℃高温高压条件下灭菌20 min,而后冷却备用。
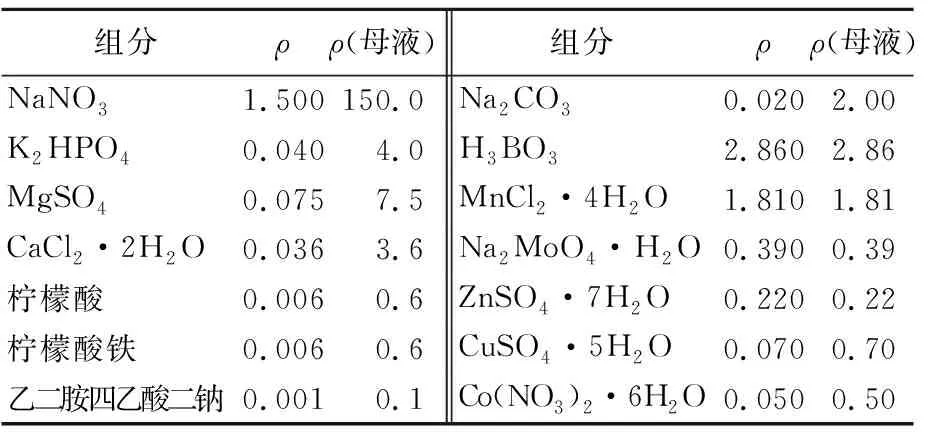
表1 BG-11培养基 单位:g/L

表2 MA培养基 单位:mg/L

表3 Knop培养基
1.2 方法
1.2.1 藻类的分离和纯化培养
对采集自巢湖蓝藻水华暴发时的水样进行离心(5 000 r/min),使湖水、浮渣和藻细胞分层,除去湖水和浮渣,并利用低浓度碳酸氢钠溶液重悬藻细胞沉淀以洗涤藻类,弃去上清,反复多次至上清透亮为止。最后,用无菌水对获得的藻细胞重悬,并进行梯度稀释后,置于BG-11固体培养基上进行分离培养。对于菌落形态一致,生长占优势的单一菌落进行富集培养,而对有杂菌共生、尚未纯化的菌落继续稀释划线,直至菌落形态一致。
1.2.2 菌种细胞形态观察
肉眼观察液体培养基中藻的形态、颜色和生长情况等;同时观察固体培养基上生长的菌落形态,包括菌落生长速度、形状、大小、表面质地、隆起程度、透明度、边缘和颜色等;借助光学显微镜观察有无细胞核或其他细胞器等藻类形态,以大致区分到“门”,并拍照记录。
1.2.3 菌种分子水平鉴定
利用聚合酶链式反应(polymerase chain reaction, PCR)技术,分别使用细菌通用引物16S rRNA/23S rRNA和藻蓝蛋白基因间隔序列ITS的特异引物对分离到的纯种藻细胞进行目的基因的扩增,引物信息见表4所列。然后,对PCR扩增产物进行测序,并将测序结果提交NCBI核酸序列数据库进行Blast比对。下载比对得分最高的9条结果记录,并保存为“fasta”格式文件,用MEGA 10.0[16]制作基因进化树,进一步对分离到的藻细胞进行分类。

表4 引物信息
1.2.4mcyB目的基因的克隆
使用Primer5软件,设计微囊藻合成酶基因(Mcy)中的关键DNA片段mcyB的上下游引物,见表4所列,并进行体外聚合酶链式扩增反应(PCR),分离纯化PCR产物,并连接到PEASY-Blunt载体上,挑取单克隆进行阳性鉴定,最后送测序。
1.2.5 藻细胞计数
藻细胞的数量采用XB-K-25型血球计数板进行计数。在血球计数板的两边各滴加10 μL的藻细胞溶液,置于Olympus显微镜视野下对其中25个、大格400个小格进行计数,采用每边各计1次,取平均值记录(计数方法为记上不记下、记左不记右,单位为104个/mL)。
1.2.6 统计分析
本文采用Microsoft Excel 2013软件对实验中所测数据进行统计分析和图表制作。所有处理均重复3次,分析结果以(平均值±标准差)表示。
2 结果与分析
2.1 巢湖蓝藻优势菌种的分离、纯化和鉴定
2.1.1 蓝藻的分离纯化和形态观察
采取稀释划线法,经不断反复纯化转接,共获得3个单一菌落,根据时间依次编号为CH1、CH2和CH3。通过光学显微镜观察(放大40倍),3株藻细胞均呈深绿色,形状为球形,群体内细胞大小相似,原生质体为灰绿色,未见细胞核,如图2所示。将获得的菌株回接到液体培养基中培养数天后,藻细胞溶液呈现均匀分布的绿色,且静置生长始终无沉淀形成。本实验观察到的结果符合铜绿微囊藻(M.aeruginosa)的形态特征和生长情况。
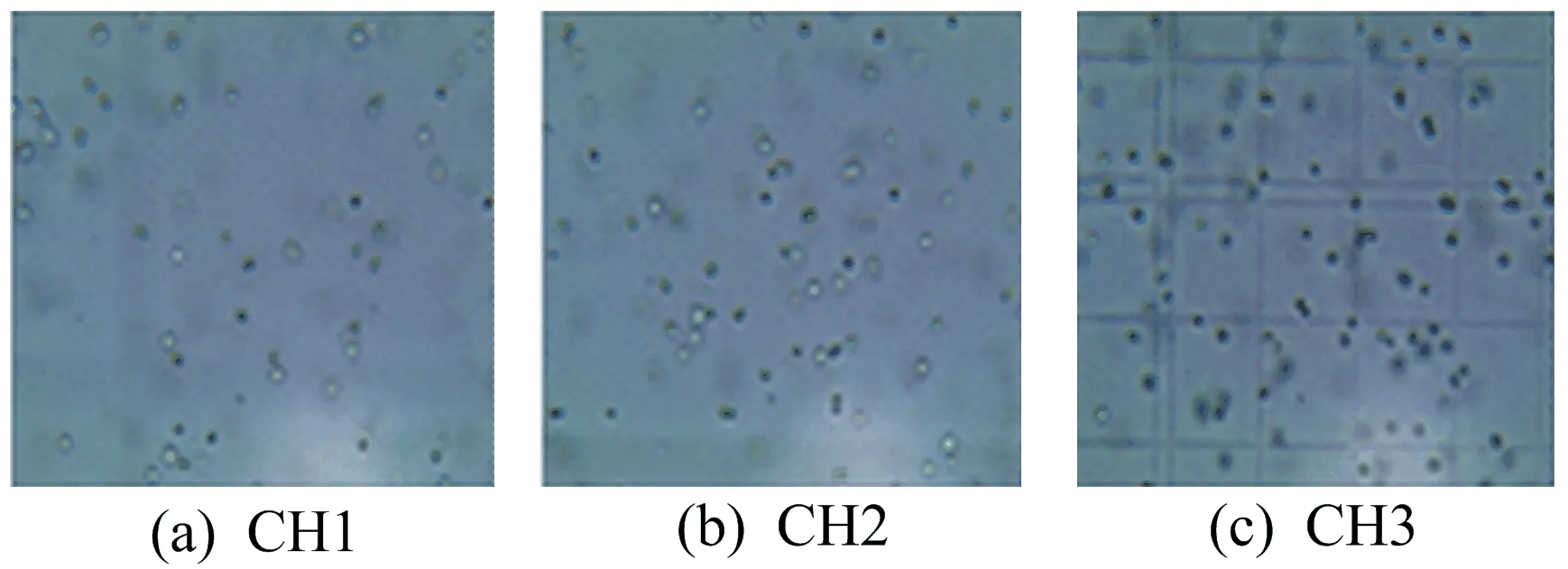
图2 CH1、CH2和CH3在显微镜下的形态
2.1.2 铜绿微囊藻的分子鉴定
使用16S通用引物、16S rRNA-23S rRNA引物和藻蓝蛋白基因间隔序列ITS的特异引物分别对3株藻细胞进行体外PCR扩增后送测序。所获得序列经DNAMAN比对完全一样,统一取名为CHSEQ,并提交NCBI数据库进行序列比对,进一步确定这3株藻细胞均为铜绿微囊藻(M.aeruginosa)。下载序列比对得分最高的9条结果记录,使用MEGA软件(版本10.0)构建进化树,如图3所示。

图3 基于藻蓝蛋白基因间隔区序列的系统发育分析
从图3可以看出,本实验所获得的CHSEQ序列与铜绿微囊藻M.aeruginosaUAM-VMA-7处于同一分支,表明它们的序列同源性最高。
2.2 铜绿微囊藻的生长特性研究
2.2.1 铜绿微囊藻标准曲线的制定
将生长至对数期的铜绿微囊藻进行梯度稀释,并用分光光度计逐一测量,同时在显微镜下进行计数,以不同藻细胞的数量及其吸光度值作标准曲线,如图4所示。通过计算,得出铜绿微囊藻的细胞数和吸光值之间换算的标准曲线方程式为:

图4 铜绿微囊藻吸光度与个数换算标准曲线
y=3 144.7x+2.234 7。
2.2.2 培养基对铜绿微囊藻生长的影响
本文分别使用BG-11、MA和Knop 3种不同培养基对铜绿微囊藻进行培养。12 d后统计不同培养基中单位体积的藻细胞数如图5所示。由图5可知,BG-11培养基中,藻细胞在第3天即进入对数生长期,同时对数期内藻细胞增长率为217.3%;而MA和Knop培养基中,藻细胞则分别在第4天和第6天进入对数生长期,且增长率仅为143.4%和150.8%。此外,在BG-11培养基中,铜绿微囊藻的细胞数最终可达到每单位体积1.6×107个,而MA和Knop培养基中藻细胞数最终为每单位体积1.0×107和8.0×106个。由此表明BG-11培养基更适于铜绿微囊藻的生长。

图5 不同培养基对铜绿微囊藻生长的影响
2.2.3 光照时间对铜绿微囊藻生长的影响
由于一天内最大光照时长为16 h,本实验比较了光照6、8、10、12、14、16 h对铜绿微囊藻生长的影响,如图6所示。由图6可知,铜绿微囊藻在6 ~16 h的不同光照时长下藻细胞增长率分别为31.6%、47.1%、91.5%、109.9%、125.0%、132.4%。表明光照时间与铜绿微囊藻的生长呈现正相关,光照时间的延长会促进铜绿微囊藻的生长,当光照时间达16 h时,铜绿微囊藻生长速度最快。因而在探究温度条件的实验中采用光照16 h。

图6 光照时间对铜绿微囊藻生长的影响
2.2.4 培养温度对铜绿微囊藻生长的影响
固定光照时间为16 h,比较培养温度分别为20、25、30、35 ℃对铜绿微囊藻生长的影响如图7所示。由图7可知,铜绿微囊藻的最适生长温度为30 ℃,平均增长率达到162.5%。

图7 温度对铜绿微囊藻生长的影响
2.2.5 光照和温度对铜绿微囊藻生长的影响
为了比较光照和温度对铜绿微囊藻生长的协同作用,设计了光照(12、14、16 h)及温度(20、25、30 ℃)的两因素三水平试验,结果如图8所示。统计培养基中单位体积藻细胞数,由图8可知,藻细胞在培养条件为光照时长16 h、温度30 ℃时增速最快。
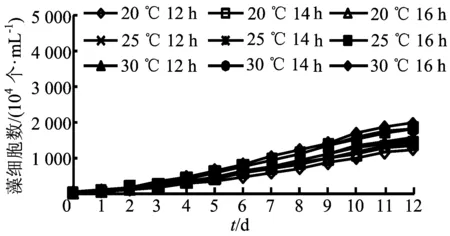
图8 温度、光照对铜绿微囊藻生长的影响
2.2.6 pH值对铜绿微囊藻生长的影响
通过向培养基中加入盐酸或氢氧化钠,调节培养基pH值由5.0到9.0变化,比较培养基中单位体积铜绿微囊藻细胞数,如图9所示。由图9可知,随着培养基pH值的增加,铜绿微囊藻藻细胞的平均增长速率分别为0、16.5%、118.5%、103.5%和53.9%。由此可知,pH值为7.0的培养条件更适合铜绿微囊藻生长。在此条件下藻细胞密度最大,为1.5×107个/mL。而在pH值为5.0的条件下,藻细胞增速几乎为0,说明铜绿微囊藻的生长基本被抑制。

图9 不同pH值培养基对铜绿微囊藻生长的影响
2.2.7 铜绿微囊藻对不同抗生素的抗性
向BG-11培养基中分别加入卡纳霉素(Kana)、利福平(Rif)、四环素(Tet)、氨苄霉素(Amp)和庆大霉素(Gen)5种抗生素,比较铜绿微囊藻的生长情况如图10所示。

图10 不同抗生素对铜绿微囊藻生长的影响
由图10可知,铜绿微囊藻对抗生素比较敏感,5种抗生素均能不同程度地抑制其生长。但是研究发现,铜绿微囊藻对四环素的抗性较强,比空白组而言被抑制率仅为5.75%,而其余4种抗生素抑制率则高达95.08%~99.86%。
2.3 铜绿微囊藻生长曲线的测定
依据2.2节中的结果,选用BG-11培养基培养铜绿微囊藻,将培养基pH值调至7.0,于30 ℃恒温培养箱内光照16 h/d,每隔24 h测定1次藻细胞个数,连续测定12 d直到生物量增长小于5%,绘制生长曲线如图11所示。由图11可知,铜绿微囊藻符合典型的细菌生长曲线,并在培养第2天进入对数期,在第11天进入稳定期。
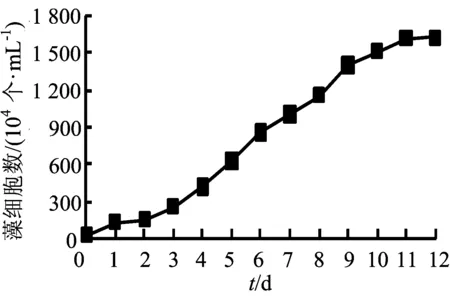
图11 铜绿微囊藻生长曲线
2.4 铜绿微囊藻的毒性鉴定
用TOX1P/TOX1M引物对分离所得的铜绿微囊藻进行扩增,电泳检测结果如图12所示,由图12可知,1 500 bp区域可扩增出条带,经测序比对发现,与mcyB基因序列一致,说明从巢湖分离的微囊藻属的铜绿微囊藻含mcyB基因,具有产生微囊藻毒素的能力。

图12 mcyB基因片段的克隆
3 讨 论
本实验通过稀释涂布平板法从巢湖蓝藻水华暴发时的水体中分离到3株单一菌落,经细胞形态和特异基因鉴定,表明所分离的3株菌落为同一种铜绿微囊藻株系。进一步对分离得到的铜绿微囊藻单一藻株进行生长特性的研究,确定了该铜绿微囊藻的最适生长条件为pH=7.0、温度30 ℃下光照16 h,这与巢湖蓝藻水华暴发的主要因素相一致。在自然水体中,温度和光照的变化是影响水生生物生长繁殖的重要生态因子。铜绿微囊藻作为暖水性种藻类,它的最适生长温度在30 ℃左右。而巢湖处于北纬30°左右,水温季节性变化明显,但在夏季6—10月其水温基本能够维持在20~30 ℃,这也是巢湖蓝藻集中暴发、迅速生长的时期[17]。同时,光照影响藻类的垂直分布,研究表明,不同藻类对于光照强度的要求不同,铜绿微囊藻对光强需求较高,一般生活在水体表层,并且光照时间越长越有利于其生长。
温度和光照作为藻类生长繁殖的重要影响因子,它们在现实水体中往往是协同发挥作用[18]。在夏季,巢湖水体不仅温度高,而且光照强度大、时间长。本实验通过设定温度梯度(20、25、30 ℃)和光照时间梯度(12、14、16 h)两因素试验,发现同一温度条件下,光照时长对铜绿微囊藻的生长具有显著影响。当培养温度为铜绿微囊藻的适宜生长温度(25~30 ℃)时,光照时长每增加2 h,藻细胞数可增加2.5×106个/mL;而培养温度为20 ℃时,光照时长每增加2 h仅能增加藻细胞数9.7×105个/mL。很多研究表明,在低温(20 ℃以下)和高温(35 ℃以上)条件下,铜绿微囊藻的光合作用相关酶类的酶活性降低,且光合系统Ⅱ的电子传递速率下降,导致其光合利用率下降,最终使得单位时间光照下藻细胞的生长能力较低[19-21]。
此外,每年巢湖水质调查结果表明,巢湖水pH值在7.5~8.2之间,呈现弱碱性。本实验结果显示铜绿微囊藻的最适生长pH值为7.0~8.0,而当pH值降至酸性条件时,铜绿微囊藻的生长量会急剧降低,这也进一步阐明了铜绿微囊藻作为巢湖水华优势藻种的原因[22]。在铜绿微囊藻对抗生素抗性的研究中,发现常见抗生素几乎能显著抑制藻细胞的生长,唯有四环素没有明显的效果。文献[23]研究发现,由于生活中抗生素的滥用以及污水处理厂无法将其有效去除,巢湖水域呈现严重的抗生素污染现状,尤其是四环素类抗生素,其在水体中的残留量最高,已达3.5~42.3 ng/L。随着逐年物种进化,巢湖铜绿微囊藻极可能对四环素类抗生素产生了很强的抗性,这与本实验的研究结果一致。
文献[24]通过基因分型和代谢物化学分型深入探究了微囊藻的种群多样性和不同种微囊藻藻毒素(MC)产生的变化,揭示了种群差异的根源是基因水平差异。一般地,藻细胞中MC的产生与否是由微囊藻合成酶基因(Mcy)决定。本实验通过PCR技术以Mcy基因内部的关键DNA片段mcyB对所获得的铜绿微囊藻藻株进行扩增和测序,发现结果呈现阳性,说明该藻株中含有Mcy基因,具有产生MC的潜在危险。文献[25]经固相萃取和高效液相色谱检测,也证实巢湖水体中的铜绿微囊藻菌株可产生毒性最强的MC-LR,与本实验的分子生物学实验结果一致。
4 结 论
本文通过一系列实验对巢湖蓝藻的优势菌种铜绿微囊藻的生长特性进行了研究,表明铜绿微囊藻的生长和繁殖主要受到外部环境(如温度、光照和pH值等)的影响。其中,温度和光照对铜绿微囊藻生长的影响具有明显的协同效应。在抗生素干扰实验室中,发现铜绿微囊藻对四环素类抗生素具有极强的抗性,或许与近年来巢湖水体中大量积累的四环素有关。因此,在巢湖水治理过程中应加大管控力度,减少抗生素类物质的残留,避免蓝藻抗性的产生。另外,通过分子生物学手段,成功克隆到微囊藻合成酶基因的片段mcyB,证实巢湖铜绿微囊藻具有产毒能力,会对巢湖周边居民的身体健康产生危害。了解巢湖铜绿微囊藻的基本生长特性,将有助于政府及相关部门科学地、有针对性地防治巢湖水华。

