TePPO基因克隆及表达分析
张恩启, 谭永毅, 云俊文, 孙甲玲, 聂 婧, 牛向丽
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
万寿菊(TageteserectaL.)是原产于墨西哥的一种一年生菊科草本植物,适应性较强,适于春天播种,夏天开放。其茎直立,具有较小的根部以及含腺体的叶片。顶部生长单生花序,花梗长而中空,花色有乳白、黄、橙黄和橘红等[1-2]。中国是万寿菊种植面积最大的国家之一,在我国山东、云南、东北等地均有色素万寿菊品种种植,用于植物天然色素提取[3]。同时,由于万寿菊花色绚丽多变,它也是一种重要的观赏植物,花色是观赏植物的一个重要特性。一般来说,类胡萝卜素、类黄酮及花青素是花中的主要色素成分[4],其含量、比例与花色密切相关。此外,在一些花中由于含有叶绿素而使花色呈现更多变化。万寿菊花中主要色素成分为类胡萝卜素,但在花的发育早期,尤其在一些浅色系万寿菊花中由于叶绿素的存在,使其花色多彩渐变,进一步增加了万寿菊的观赏性。
叶绿素是参与植物光合作用的重要色素,同样也是组成观赏林木的色素成分之一。叶绿素的生物合成自L-谷酰胺-tRNA开始,共需15 步反应,涉及相应15种酶[5-6]。其中,原卟啉原氧化酶(protoporphyrinogen oxidase,PPO)将原卟啉原Ⅸ氧化成为原卟啉Ⅸ,是四吡咯生物合成的最后一个酶。随后原卟啉Ⅸ再与镁螯合最终生成叶绿素[7]。目前对植物PPO基因的研究主要以拟南芥为主[8],在其他植物物种中的报道并不多,特别是万寿菊的相应催化酶基因序列。本文依据转录组组装数据结果,进一步对万寿菊PPO(TageteserectaPPO,TePPO)基因进行克隆、测序和生物信息学分析、表达分析,探讨其在万寿菊花色形成中的作用。
1 材料与方法
1.1 主要实验材料
1.1.1 植物材料
万寿菊(TageteserectaL.)栽培品种‘marvel yellow’(黄色花)、‘marvel orange’(桔黄色花)购于泛美种子公司,种植于合肥工业大学植物培养室。
1.1.2 试剂药品
Trizol购于Invitrogen公司;高保真Pfu DNA 聚合酶、dNTPs、DNA marker、反转录酶、实时荧光定量聚合酶链式反应(real time quantitative polymerase chain reaction,RT-qPCR)试剂盒均购于北京全式金生物技术有限公司;质粒提取试剂盒、DNA纯化试剂盒均购于天根生化科技有限公司;T4 DNA Ligase购于Thermo Scientific公司;引物设计采用Primer Premier 5.0软件,由上海生工生物工程技术服务有限公司合成;其他试剂均为国外原装或国产分析纯。
1.1.3 载体与菌株
pEASY-Blunt克隆载体、大肠杆菌(Escherichia coli)菌株DH5α,均由本实验室保存。
1.2 实验方法
1.2.1 RNA 提取、反转录
将所采集的万寿菊组织样品液氮研磨,进行总RNA 提取,并对RNA的纯度、浓度进行检测。取总RNA 2 μg进行反转录合成cDNA。
1.2.2TePPO基因扩增
根据万寿菊转录组组装注释结果,设计TePPO基因巢式PCR引物[9],分别为:
TePPOF1 5’-ACACAAAAATAGCAATGTGGATA-3’
TePPOR1 5’-TTTCACTCTTCATTTACTGTTCCT-3’;
TePPOF2 5’-CAATCAAGATGACACAATGACAAT-3’
TePPOR2 5’-GTCCTTATGAAGCTCGAACCA-3’。
以上述反转录cDNA为模板,对TePPO基因进行扩增,扩增后的PCR产物经1%琼脂糖凝胶电泳分离检测。
1.2.3TePPO基因克隆
利用DNA纯化试剂盒对扩增产物进行纯化;然后将纯化后的扩增产物与克隆载体pEASY-Blunt进行连接,转化大肠杆菌感受态细胞,涂布于带有卡那霉素的培养皿中37 ℃培养;挑取单克隆进行菌落PCR鉴定;取阳性克隆菌液进行质粒提取、送样测序,比对测序序列结果。
1.2.4TePPO基因生物信息学分析
利用蛋白组学分析平台(ExPASy,https://www.expasy.org/)对TePPO编码蛋白的理化性质进行分析。使用同源建模方法[10](SWISS-MODEL)对TePPO蛋白三维结构进行预测。同时,将TePPO基因序列在NCBI数据库进行对比,利用MEGA 7.0软件,使用Neighbor Joining遗传算法构建基因进化树进行进化分析。
1.2.5 叶绿素量的测定
分别取黄色、桔黄色万寿菊品种‘marvel yellow’、‘marvel orange’的不同发育时期的花组织样品0.10~0.15 g(以直径5 mm花蕾开始定为DP0,取随后第10、15、21天的万寿菊花组织,分别记为DP10、DP15、DP21),立即以液氮冷却并快速研磨。然后加入丙酮5 mL,4 ℃避光浸提24 h,提取叶绿素。过滤、定容至合适浓度后以紫外可见分光光度计测定645、663 nm吸光值[11]。根据经验公式计算总叶绿素的量。具体公式为:叶绿素的量=(20.2A645+8.02A663)×稀释倍数/质量。
1.2.6TePPO基因表达分析
分别以万寿菊‘marvel yellow’、‘marvel orange’的叶片和DP10、DP15、DP21花组织样品所反转录cDNA为模板,以已知在万寿菊不同组织中稳定表达的TIF6 (translation initiation factor 6) 作为内参基因[12],利用荧光定量PCR对TePPO表达水平进行检测。其中TePPO基因定量PCR引物为:
TePPORTF 5’-TATGTGTGTGGGGATTATCGGAC-3’
TePPORTR 5’-ATCTTTCAACAACGCCTCTGC-3’;
TIF6基因引物为:
TIF6 F 5’-TAAGACCTGGTGGTGGAAATAGA-3’
TIF6 R 5’-CAGCACCATGAGGACGAAGA-3’。
2 结果与分析
2.1 TePPO基因克隆结果
以万寿菊未成熟花组织的反转录cDNA为模板,利用特异性巢式PCR引物对TePPO基因进行扩增,琼脂糖凝胶电泳结果如图1所示,由图1可知,获得与预期大小(1 699 bp)基本一致的目的条带,且条带清晰,没有其他明显的非特异扩增产物。将此扩增产物纯化后与pEASY-Blunt 克隆载体连接,转入大肠杆菌细胞,然后将菌落PCR鉴定的阳性克隆进行测序验证。测序结果显示克隆获得了TePPO基因,其与转录组组装序列仅有少数碱基的差异。表明转录组组装结果较为准确,由此克隆分离得到TePPO基因全长序列。

M. DNA Marker 1.TePPO基因图1 TePPO基因PCR扩增产物
2.2 TePPO基因生物信息学分析结果
通过蛋白组学分析平台(ExPASy)对TePPO编码蛋白的理化性质分析。结果显示,TePPO基因编码493个氨基酸,相对分子质量约为54 KDa;等电点为6.74;不稳定系数为30.11,属于稳定蛋白;亲水性平均值为-0.08,属于亲水性蛋白。通过同源建模方法预测TePPO蛋白的三维结构,如图2a所示。利用TePPO基因序列所构建的系统进化树如图2b所示,图2b中,TePPO为万寿菊(Tageteserecta)PPO基因;AtPPO为拟南芥(Arabidopsisthaliana)PPO基因;AhPPO为花生(Arachishypogaea)PPO基因;AiPPO为花生(Arachisipaensis)PPO基因;AdPPO为蔓花生(Arachisduranensis)PPO基因;ZjPPO为枣(Ziziphusjujuba)PPO基因;HaPPO为向日葵(Helianthusannuus)PPO基因;MsPPO为紫花苜蓿(Medicagosativa)PPO基因;CsPPO为亚麻芥(Camelinasativa)PPO基因;SmPPO为卷柏(Selaginellamoellendorffii)PPO基因;GhPPO为棉花(Gossypiumhirsutum)PPO基因;ZmPPO为玉米(Zeamays)PPO基因;GsPPO为大豆(Glycinesoja)PPO基因;CpPPO为西葫芦(Cucurbitapepo)PPO基因;CmPPO为笋瓜(Cucurbitamaxima)PPO基因;MdPPO为苹果(Malusdomestica)PPO基因。
从图2b可以看出,TePPO与其他植物物种PPO基因具有同源性,其中与向日葵和紫花苜蓿同源基因的一致性最高。
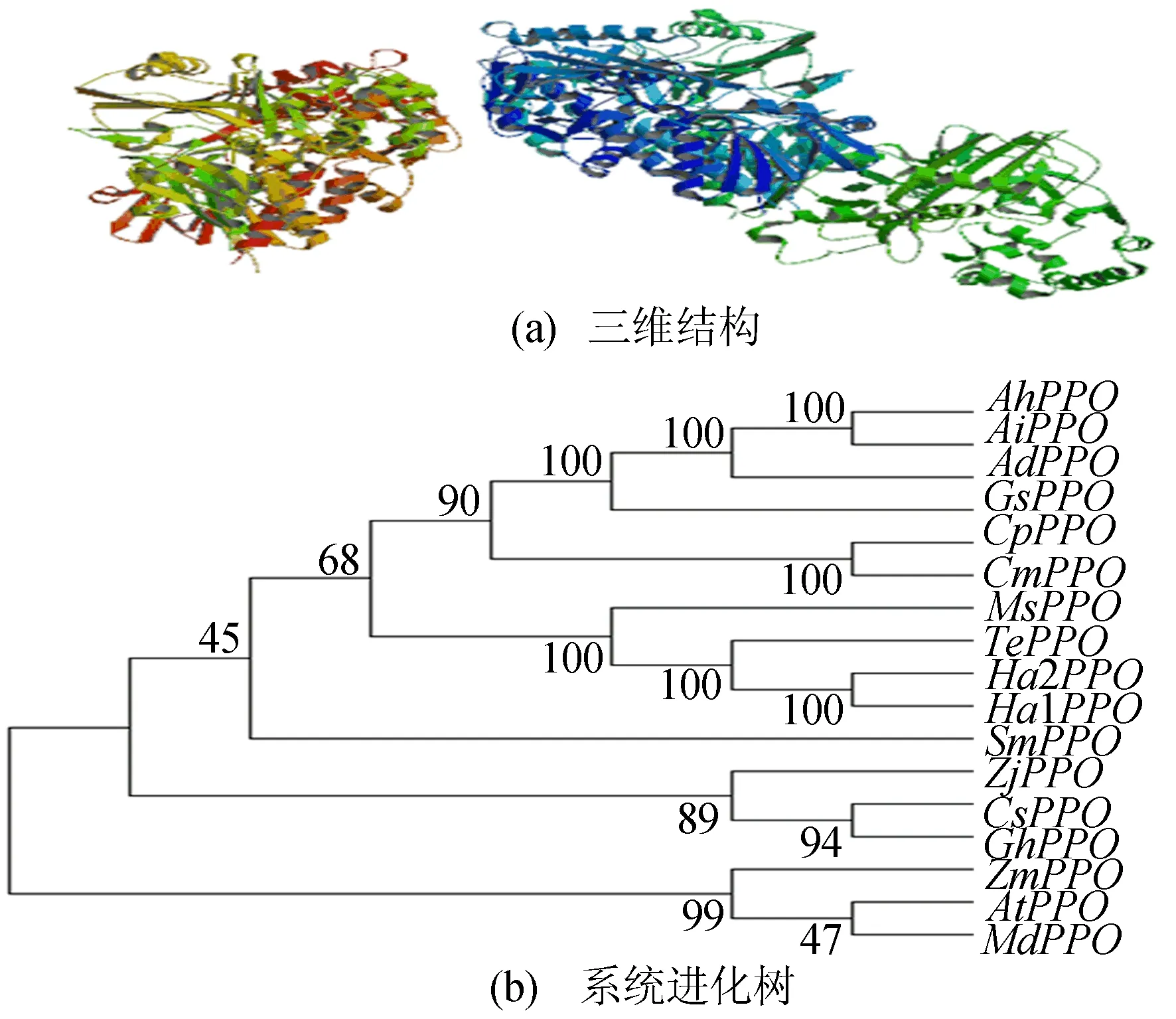
图2 TePPO蛋白质的三维结构预测和系统进化树分析
2.3 万寿菊花中叶绿素量的测定结果
对万寿菊品种‘marvel yellow’、 ‘marvel orange’的3个发育时期(DP10、DP15、DP21)的花组织进行收集并测定叶绿素的量,如图3所示,由图3可知,在黄色品种‘marvel yellow’的DP10、DP15、DP21花组织中,每g鲜重中叶绿素的质量分别为23、19、8 μg;而在桔黄色品种‘marvel orange’3个对应时期花组织中每g鲜重中叶绿素的质量分别9、5、3 μg。在黄色、桔黄色万寿菊花发育早期(DP10、DP15),花中叶绿素的量均明显高于成熟花(DP21);在花色呈现更明显绿色的‘marvel yellow’中,其DP10、DP15、DP21花组织中叶绿素的量均显著高于桔黄色品种‘marvel orange’3个对应时期花组织(P<0.05)。表明叶绿素参与万寿菊的花色形成,并随着花组织的成熟其所含叶绿素的合成减少、降解加快,从而呈现多色渐变。


图3 不同发育时期万寿菊花和叶绿素的量
2.4 TePPO基因表达分析结果
对‘marvel yellow’、 ‘marvel orange’不同发育时期(DP10、DP15、DP21)的花组织中TePPO基因的表达水平进行RT-qPCR检测,结果如图4所示,从图4可以看出,与叶片相比,TePPO在花中表达水平较高,表明TePPO基因可在万寿菊花组织中转录,发挥功能。TePPO基因在万寿菊花发育早期丰度更高,随花组织的成熟,TePPO基因转录表达降低。在花色中绿色更明显、叶绿素含量更高的品种‘marvel yellow’中,不同发育时期的TePPO表达量也明显高于‘marvel orange’品种。结合花中叶绿素量变化,万寿菊花中TePPO基因表达水平与叶绿素量呈现一致的变化趋势,基因表达与叶绿素量有较高的相关性。因此,TePPO基因的表达水平分析提示其可能参与万寿菊花中叶绿素的合成及花色形成。

图4 不同发育时期万寿菊花中TePPO基因的表达水平
3 讨 论
植物叶绿素的合成过程较为复杂,需要多种不同的酶催化完成,其中原卟啉原氧化酶PPO是催化最后步骤合成叶绿素的关键限速酶。在大多数真核生物和许多需氧或兼性细菌中,PPO是氧依赖性的。PPO蛋白结构包括黄素腺嘌呤二核苷酸(FAD)结合域、底物作用结合域和膜结合域。通过FAD的黄素环(PPO辅助因子)从原卟啉原Ⅸ接收电子[13],并将电子转移到氧分子,原卟啉原Ⅸ通过氧分子被氧化为原卟啉Ⅸ。PPO通过自身不同结构域与底物、辅酶和蛋白之间发生相互作用调控叶绿素的合成[14]。已有报道认为,原卟啉原氧化酶PPO催化形成原卟啉Ⅸ的酶促步骤在原核和真核生物生命形式中都是保守的。在植物中,叶绿素的产生也取决于该酶促步骤[15]。利用这一催化酶的关键性,通过开发可与PPO结合的底物,从而抑制PPO与体内原卟啉原Ⅸ的结合,使叶绿素不能合成、原卟啉原Ⅸ积累而导致细胞死亡,可以达到新型生物农药除草剂的作用,因而也使PPO成为除草剂的一个特异靶标[13-16]。PPO除了在催化叶绿素的生物合成中起到关键作用之外,还通过与多种有机体RNA编辑因子(MORF)家族蛋白相互作用,在调控质体RNA编辑中发挥重要作用[8]。
近年来也有一些报道对叶绿素整个合成途径进行综述[17],但对具体基因功能的深入研究相对较少。对PPO基因的报道部分是以细菌、蓝藻等微生物为载体,在植物中主要以拟南芥为主[18]。
4 结 论
本研究依据前期转录组信息,对TePPO基因进行了克隆,经测序验证其编码序列与其他植物物种PPO基因具有同源性,其中与向日葵和紫花苜蓿PPO的一致性最高。
万寿菊花中所含主要色素成分为类胡萝卜素,由于类胡萝卜素成分含量和组成的差异而呈现丰富的花色,而且其他色素成分(如叶绿素)进一步增加了万寿菊花色的多彩渐变和观赏性。本文在对TePPO基因表达模式的分析中发现,其在万寿菊花中转录表达水平较高,且在叶绿素量高的花色品种、花发育时期,TePPO的表达量也相应明显升高,表明其参与万寿菊花中叶绿素的合成与花色形成。因此,本研究工作可为植物花色遗传改良提供基因资源和参考依据。

