经导管主动脉瓣植入术4例
黄尹霞,李 敏,陈鑫昊,刘星佑,贺继刚
1.昆明理工大学附属医院心脏大血管外科(昆明 6532001)
2.云南省第一人民医院心脏大血管外科(昆明 6532001)
3.云南中医药大学中西医结合学院(昆明 650500)
经导管主动脉瓣植入术(transcatheter aortic valve implatation,TAVI)是一种主动脉瓣植入微创手术。1965年英国医生Davis率先提出TAVI的设想[1],1992年丹麦Anderson等进行了全球首例相关动物实验,将人工瓣膜经导管逆行植入猪升主动脉,证实了该方法的可行性[1]。随后多种不同形态的用于经导管植入的瓣膜被发明。2002年4月,法国Cribier等首次为1例主动脉瓣狭窄(aortic stenosis,AS)男性患者成功进行了TAVI手术,成为该技术发展的里程碑[2]。2010年10月TAVI技术引入我国,并在复旦大学附属中山医院完成国内首例TAVI手术,截至目前国内已有多家医院开展该项技术。云南地处我国西南边陲,医疗发展较为缓慢,省内未见相关技术开展的报道。本次云南省第一人民医院心脏大血管外科TAVI团队首次尝试为4例主动脉瓣病变患者行TAVI手术并取得良好效果,现报道如下。
1 临床资料
4例患者中,3例为主动脉瓣重度狭窄,1例为主动脉瓣重度关闭不全。患者术前基本情况、查体、胸腹主动脉血管成像、超声心动检查与美国胸外科医师协会(The Society of Thoracic Surgeons,STS)评分情况见表1。本研究经云南省第一人民医院伦理委员会批准,4例患者均已签署知情同意。

表1 4例患者相关资料Table 1.Relevant data of 4 patients
TAVI术前应对病人进行解剖因素与临床因素两方面的标准化评估,包括病人体质及合并症等内容,以评估外科主动脉瓣置换术(surgical aortic valve replacement,SAVR)的风险[2]。首先,采用食道超声确认AS的严重程度,一般情况下AS应达到重度狭窄合并跨膜压差>40 mmHg的标准,若食道超声可实现充分评估,则无需进行有创评估,同时还应考虑导丝、导管跨主动脉瓣膜时,发生脑部栓塞的潜在风险[3-4]。其次,通过多排双源CT对瓣膜的钙化程度进行评分。对于房颤患者合并低射血分数,或反常低流量(<35 ml/m2)、轻度狭窄(<40 mmHg),或左室射血分数正常的还应该充分评估心输出量[5]。若食道超声表明肺动脉高压,则应采用右心导管评价肺动脉压力。本研究4例患者术前均采用了食道超声与CT进行了评估,并向家属交代了手术的风险及优缺点。此外,对主动脉瓣关闭不全患者应从主动脉根部结构、行TAVI手术的可行性以及是否会造成严重的瓣周漏等方面进行评估。
解剖因素方面,目前经股动脉入路成为优先选择,超过90%的患者采用此入路方式[6],一般要求股动脉直径应至少≥5 mm并能安放14F的鞘管,术前应对主动脉根部、瓣环径进行评估。临床因素方面,主动脉瓣病变患者普遍采用STS评分与欧洲心脏手术风险评分系统(EuroSCORE)或EuroSCORE II进行评估。最近由STS/ACC TVT注册研究和瑞典TAVI注册机构共同研发的预测风险模型也进入了试行阶段[7-8]。另有些研究对体质参数与TAVI术后死亡风险的预测指标进行了报道,如患者总的身体功能状况,是否有营养不良或先天性疾病等,尤其是老年患者若营养状态差或有先天性疾病则手术风险更高[9]。本研究术前采用STS评分对4例患者进行了评估,其中2例为高危患者,2例为中危患者。
经颈内静脉植入临时漂浮电极至右心,左侧股动脉穿刺,放入6F猪尾导管至无冠窦窦底进行定标。植入6F股鞘,经6F股鞘植入0.35的导丝至主动脉瓣开口处,再植入AL1导管,将AL1导管顺势送入左心室,将塑形的lunderquist导丝送入左心室。缓慢将股鞘更换为19Fr的大鞘,对于AS患者,需要进行球囊扩张(球扩),将球囊送至主动脉瓣处,调试起搏器使其正常快速起搏至180次/分,促使血压下降至60 mmHg后迅速球扩,完成后将瓣膜输送系统送至主动脉瓣处,调节最佳DR造影投射角度。手术强调两点:一是人工瓣膜上的mark点必须和主动脉瓣瓣环平面保持水平,准备释放瓣膜,术者需持续保持输送器张力;二是缓慢释放瓣膜至mark点与胶囊管上金属环重合,快速起搏至120次/分,继续缓慢释放瓣膜,瓣膜张开时大力提拉瓣膜,继续保持mark点平瓣环,缓慢释放瓣膜上1/3时后稳住,快速起搏至140~160次/分,接着快速释放瓣膜至2/3,此刻人工瓣膜已经稳定并开始工作,立刻停止起搏,最后缓慢释放瓣膜后1/3,并确认3个TIP头已经弹出,此时缓慢退出输送系统,交换猪尾,进行造影,测跨瓣压差,术中超声检查有无反流、瓣周漏、跨瓣压差,根据结果决定后扩时机或其它处理。缓慢退出大鞘,确认股动脉无特殊损伤,将伤口进行闭合。对于行瓣中瓣方法治疗的患者,手术操作步骤基本一致,只是在退出第一个瓣膜输送系统后,再放入第二个瓣膜。4例患者成功放入瓣膜后造影图片见图1。
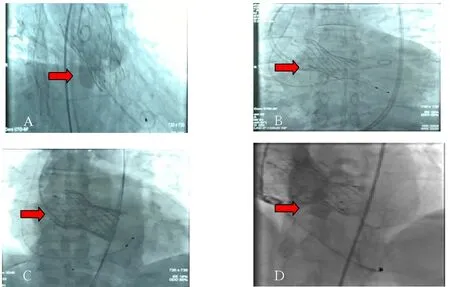
图1 4例患者放入瓣膜后造影图片Figure 1.Angiography pictures of 4 patients after inserting the valve
3例主动脉狭窄患者术后5天复查心脏彩超均提示,主动脉瓣生物瓣回声清晰,位置固定,启闭灵活,瓣叶及瓣周未见明显异常回声附着,瓣膜功能正常。心电图示3例患者术后心电图为窦性心率,未见III度房室传导阻滞。随访至2020年10月,3例患者恢复顺利,未见异常。病例4为主动脉瓣关闭不全患者,采用瓣中瓣技术完成治疗。术后心脏彩超提示,主动脉瓣位生物瓣植入术后,主动脉瓣周可见残余分流,大小约0.24 cm,为轻度返流。24小时心电图示窦性心律,完全性左束支传导。患者无自觉症状,患者活动量明显改善,随访至2020年10月,患者恢复顺利,随访心脏彩超显示人工瓣膜工作正常,未见返流。
2 讨论
Bonow等研究显示,SAVR曾是具有中、高等手术风险并具有明显临床症状的原发性AS患者治疗的金标准[10]。但近年开展的研究显示,TAVI已成为治疗重度AS但无法行SAVR的高危患者的首选替代方法[11]。现已开展的随机对照试验已证实TAVI可降低相关死亡率与术后并发症的发生率[12-19]。Möllmann等收集了德国强制性全国质量控制计划中2018年度所有主动脉瓣植入的数据[11],根据新版的德国主动脉瓣评分对患者进行分层评估,结果显示TV-TAVI已取代iSAVR成为AS患者提高预后的首选手术方法[20]。随着研究的逐渐深入,TAVI被公认是治疗高危、中危甚至低危AS患者的有效疗法[21],据相关数据报道,欧洲中等手术风险的患者行TAVI的比例为50%,低手术风险患者则为10%[22]。近期研究发现,即使在低风险患者中,TAVI也较SAVR预后效果良好[23],其术后每年死亡率及术后并发症发生率均呈下降趋势[24-25]。
本团队意识到术前评估的重要性。本研究4例患者经严格的术前评估后被认为可行股动脉入路,术中再次造影进一步明确股动脉是可行的入路,术后4例患者恢复良好,术后10小时开始下床活动,术后5天复查各项指标满意,随访至2020年10月,所有患者未见不适,反映经股动脉入路患者创伤极小,有利于患者的术后恢复。本研究中病例4为云南省第一例采用瓣中瓣技术完成的主动脉瓣关闭不全患者,研究团队认为手术过程中若患者符合窦管交界足够小,可卡住人工瓣的腰部,或者患者的左室流出道足够小,可将放入瓣膜的瓣环卡住的条件时,即可尝试利用瓣中瓣的技术治疗主动脉瓣关闭不全患者。

