南瓜籽蛋白酶法改性及其功能特性研究
卢臣 张玉申 仝文君 胡振阳 都立辉


摘要:为深入开发南瓜籽蛋白、改善其乳化性能,利用胰蛋白酶对南瓜籽蛋白进行不同程度的酶解改性,将酶解蛋白与大豆油经高压均质制备蛋白乳液并研究其稳定性。通过测量溶解性、分子量、疏水性、乳化性观察酶解对蛋白性质的影响,测定乳液乳析指数、粒径分布、界面蛋白浓度等研究酶解蛋白对乳液稳定性的影响。结果表明,胰蛋白酶提高了南瓜籽蛋白的溶解性、疏水性、乳化活性,且酶解后的蛋白乳液乳滴粒径较小、分布均匀,界面蛋白浓度显著增加,尤其是水解度为5%的蛋白乳液稳定性最佳。改性后的南瓜籽蛋白是一种良好的天然乳化剂。
关键词:南瓜籽蛋白;酶法改性;乳液;穩定性
中图分类号:TS229;TQ936.2文献标识码:ADOI:10.16465/j.gste.cn431252ts.20210624
南瓜籽含有丰富的油脂与蛋白质,榨油后的南瓜籽粕蛋白质含量可达到50% ~ 60%,是一种天然蛋白质材料[1]。南瓜籽蛋白氨基酸组成平衡性好,包括人体必需的8种氨基酸和儿童必需的组氨酸[2]4。与棉籽粕和菜籽粕相比,南瓜籽粕中不含对人体有害或有毒成分,是一种比较安全的蛋白质来源[3]。但由于其溶解性较差,大部分南瓜籽粕被用作动物饲料[4]2,造成了蛋白资源的浪费,研究南瓜籽蛋白有利于深入开发其增值产品,提高其利用率。
蛋白质具有亲水亲油的性质,能够通过在油一水界面形成吸附层降低界面张力而起到乳化作用[5],具备开发成安全性高、乳化性强的绿色乳化剂的潜力。而天然蛋白质的乳化性质往往受其结构、理化性质以及环境因素的影响,在食品加工应用上受到一定程度的限制[6]。目前,蛋白改性方法主要有物理改性、酶法改性、化学改性等[4]5-6。其中酶法改性条件温和,产生的副产物少,对环境友好。但蛋白改性受酶的特异性、蛋白质酶解程度以及蛋白自身特性的影响,过度酶解蛋白质会产生大量的游离氨基酸和小肽,反而降低蛋白质的乳化,有效控制蛋白水解程度,可以改善蛋白质的两亲性,增强其乳化性[7]。胰蛋白酶是一种特异性蛋白酶,可以对精氨酸和赖氨酸的竣基末端进行高效水解网。曾有学者利用胰蛋白酶对大米蛋白[7]、脱壳核桃蛋白[8]进行限制性酶解,改善了其乳化性能。
南瓜籽蛋白以植物贮藏蛋白为主,类似于大豆蛋白、豌豆蛋白。其中,12 S球蛋白和2 S白蛋白两种蛋白占南瓜籽总蛋白含量的59%%南瓜籽分离蛋白经酶促水解能够吸附在油一水界面上,但易受乳脂化不稳定性的影响[10]。本实验利用胰蛋白酶酶解南瓜籽蛋白,研究不同水解度的南瓜籽蛋白经过高压均质处理形成乳液的稳定性影响,为南瓜籽蛋白作为乳化剂应用于食品工业中提供理论基础。
1材料与方法
1.1材料与试剂
脱脂南瓜籽蛋白粉(粗蛋白61.7%、总糖12.4%、水分7.2%、灰分10%、淀粉4%)、大豆油:市售;胰蛋白酶1:300(300 U/mg):生工生物工程(上海)股份有限公司;BCA蛋白浓度测定试剂盒:北京索莱宝科技公司;其他试剂均为分析纯。
1.2仪器与设备
AMF-10型超高压微射流均质机:安拓思纳米技术有限公司;ULTRA-TURRAX T18型高速分散器:德国IKA公司;Nano-ZS90型纳米激光粒度仪:英国马尔文公司;ZeissAxioScopeA1型荧光显微镜:德国奥伯科兴卡尔蔡司公司;UV-VIS2401PC紫外分光光度计:日本岛津公司。
1.3方法
1.3.1酶解蛋白制备
将南瓜籽蛋白溶于超纯水中,配置成40 mg/mL 浓度的分散液,磁力搅拌2 h,4 ℃放置12 h,使其充分水化。用1 mol/L NaOH溶液将上述分散液调节至胰蛋白酶最适酶解条件,pH为8,水浴加热,酶解温度为37 ℃。加酶量为3 000 U/g,蛋白酶溶于少量超纯水,直至蛋白酶完全溶于水后再加入到待酶解的蛋白分散液。酶解期间保持分散液pH为8,制备不同水解度的蛋白溶液。酶解结束后沸水浴5 min灭酶,待其恢复至常温用1 mol/L HCl调节蛋白水解液液pH至7,转速10 000×g离心15 min 两次取上清液,真空冷冻干燥。
1.3.2水解度(DH)
在酶解过程中,每隔一段时间取20 mL酶解液,沸水浴5 min灭酶,冷却至室温后调节酶解液至pH 7,离心(10 000xg,15 min)取上清液。邻苯二甲醛法[11](OPA)测定水解度。丝氨酸标准品的制备:将40 mg丝氨酸溶于100 mL去离子水,分别稀释成浓度为0.025、0.05、0.1、0.2、0.3、0.4 mg/mL,制作标准曲线。将200μL稀释10倍的样品与1.5 mL OPA试剂精确混合2 min,并用紫外可见分光光度计记录340 nm处的吸光度。DH计算公式:
式中:DH为水解度,%;Serine NH2为丝氨酸氨基当量;α为α-NH2的平均解离度,0.970;β为0.342;htot为每克蛋白质中肽键的毫摩尔数,8.35 mequv/g。
1.3.3蛋白溶解性
南瓜籽蛋白水解液中的可溶性蛋白含量用BCA试剂盒测定,将含有Cu2+和BCA试剂的200 μL工作液添加到含有20μL梯度标准溶液(0.0 ~ 0.5 mg/mL的牛血清白蛋白)的96孔板,37 ℃保温30 min,酶标仪在562 nm 条件下测量[2]36-37。总蛋白利用凯式定氮法测定。按式(3)计算蛋白溶解性。
式中:
c——蛋白溶解性,%;
m1——水中溶解蛋白质含量,g;
m2——样品中总蛋白含量,g。
1.3.4SDS-PAGE分析
将蛋白质加样缓冲液与蛋白水解液按比例配置,迅速放于沸水浴2 min,每个上样孔体积取20 μL,使其最终样品上样蛋白含量为8μg。电泳仪设置测参数为120 V,90 min。将胶浸泡在考马斯亮蓝溶液中摇床染色1 h,电泳脱色液脱色24 h。
1.3.5表面疏水性
制备不同浓度的3 mL蛋白溶液(0.01 ~ 0.50 mg/mL)与20μL 8 mmol/L 1-苯胺基-8-萘磺酸钠(ANS-Na)溶液混合;将荧光强度FI1在荧光分光光度计(370 nm激发,5 nm狭缝;465 nm 發射,5 nm狭缝)上测量,而没有ANS-Na的样品的荧光强度称为FI0。通过线性回归分析FI1和FI0之间的差异图获得的斜率相对于蛋白质浓度作为H0的指标,所得结果R2>0.99。
1.3.6乳化活性
取18 mL溶液,分别加入2 mL大豆油进行20 000 r/min剪切2 min得到乳状液,取30 μL乳液加入3 mL 1 mg/mL浓度的十二烷基硫酸钠(SDS)溶液稀释,在500 nm波长处测吸光度A0。静置5 min 后,再次从底部各取30μL样品,同上测定吸光度A5[12]。乳化活性和乳化稳定性计算公式:
EAI=2×2.303×A0×100/(C×Φ×10000)(4)
ESI=A0/(A0-A5)(5)
式中:EAI为乳化活性,m2/g;ESI为乳化稳定性,min;N为稀释倍数,100;C为乳化液形成前蛋白质水溶液中蛋白质质量浓度,g/mL;Φ为乳化液中油相体积分数;A0为0min时的吸光值;A5为5min时的吸光值。
1.3.7乳液制备及其稳定性分析
将不同水解度的蛋白冻干粉配置成质量浓度为5mg/mL的蛋白溶液,加入体积分数为10%大豆油作为油相,混合液经过转速20000r/min剪切2min预乳化,30MPa高压均质3次处理。
(1)乳析指数:将均质乳化好的南瓜籽乳液分别分装在20mL的透明玻璃瓶中,加入0.02g/L叠氮化钠防止微生物生长,4℃静置30d观察乳液分层状态。乳析指数是评价乳液稳定性的一个重要指标[13],公式如下:
CI=(Hs/Ht)×100%(6)
式中:CI为乳析指数,%;Hs为下层清液高度,mm;Ht为整个乳液的高度,mm。
(2)粒径及电位:粒径大小以及其分布展示了乳液体系的分布状态,是衡量乳液稳定性的重要指标[13]。将南瓜籽蛋白乳液各取3组平行样品,稀释液超水稀释100倍后,参考Sarkar等[14]的方法用Nano-ZS90纳米粒度仪进行粒径分布、电位测定。Nano-ZS90纳米粒度仪通过动态光散射和173°检测器测定乳液的平均流体动力学直径。另外,稀释液1% SDS溶液稀释100倍,用Nano-ZS90纳米粒度仪进行界面表面积的测定。
(3)吸附蛋白浓度、界面蛋白含量:参考陈先鑫等[15]将新鲜乳液以15 000×g离心30 min,水相部分再次离心30 min。用带有针头的注射器将离心后的水相部分小心的取出,通过0.22μm的过滤膜过滤。用BCA法测定过滤液的蛋白浓度。
1.4数据处理
所有实验均重复3次,采用Origin 8.0和SPSS 16.0对实验数据进行统计分析,样品平均值之间的差异性通过Duncan法比较(P<0.05)。
2结果与分析
2.1酶解蛋白性质
2.1.1水解度及溶解性
如图1所示,水解度、溶解性均随酶解时间增加逐渐增大而后趋于平缓。由于蛋白酶具有较强的专一性[16],随着酶解时间的增加,酶切位点逐渐减少,水解度、溶解度也趋于稳定。溶解性是蛋白质重要的物理性质,对乳化性有着较大的影响。蛋白经过酶解后,空间结构被局部展开,大分子的蛋白被水解成分子量较小的肽段或者氨基酸,蛋白比表面积增加,溶解性增强[2]38-39。水解度(DH)是反映蛋白质酶解肽链断裂程度的重要参数,不同水解度的酶解蛋白乳化性质可能不同[17]。依照酶解时间与水解度的关系,分别各选取3个不同水解度DH 2%、DH 5%、DH 8%的蛋白酶解液进行研究。
2.1.2分子量
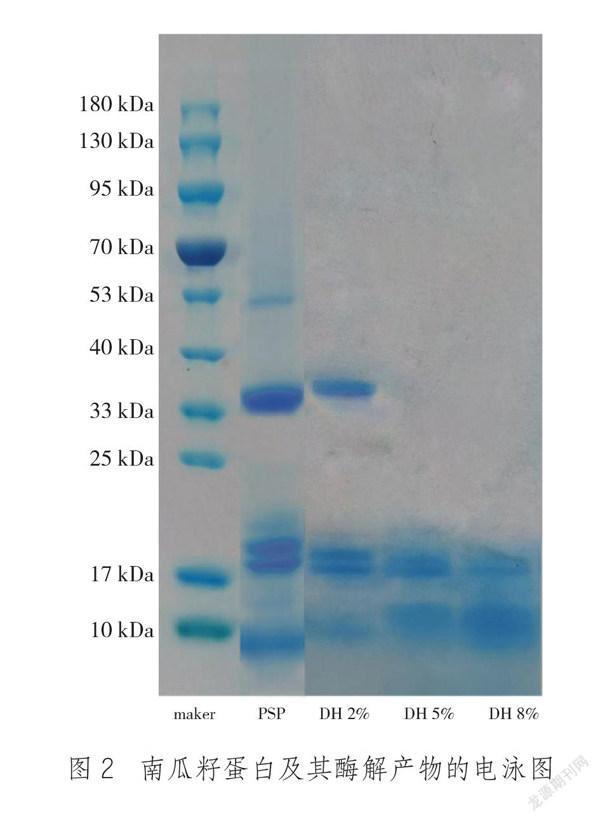
蛋白酶能将结构复杂的蛋白质转变成低分子量的蛋白肽。如图2所示,南瓜籽蛋白(PSP)分子量主要集中在70 kDa以下,最明显的条带出现在分子量在33 ~ 40 kDa和10 ~ 25 kDa,与Bucko 等[10]研究的南瓜籽蛋白分子量一致。在DH 2%的酶解蛋白中,胰蛋白酶将分子量为53 kDa的蛋白条带酶解成小于40 kDa的蛋白。随着水解程度的增加,40 ~ 33 kDa的蛋白条带逐渐消失,被酶解成分子量更小的蛋白质。低分子量的蛋白质具有良好的溶解性,同时酶解会暴露出蛋白内部的疏水基团,疏水基团的增加可能会改善蛋白乳化性能[7]。
2.1.3疏水性
由图3可知,经过胰蛋白酶酶解的南瓜籽蛋白疏水性明显增加,疏水性随着水解度增大而逐渐增大而后降低,在DH为5.7%时疏水性最大达到2 504±13,比未酶解蛋白的疏水性增加了7.4倍,可知胰蛋白酶酶解南瓜籽蛋白对疏水性有显著影响,疏水性的提升可能使蛋白功能性质改变[18]50-51。酶解使南瓜籽蛋白疏水位点暴露,疏水性增加,而随着酶解程度越来越高,蛋白逐渐被酶解成小肽或者氨基酸,亲水性增加从而使其疏水性降低。
2.1.4乳化性及乳化穩定性
乳化活性反映蛋白质形成油水界面的能力强弱,乳化稳定性是指乳液乳滴保持分散不聚结、絮凝或乳脂化的能力[12]。如图4所示,酶解蛋白具有比天然蛋白更好的乳化活性及乳化稳定性,且DH 5%的乳化活性比DH 2%、DH 8%水解程度的乳化活性高。由于南瓜籽蛋白经过适当的酶解,蛋白溶解性增加、疏水基团从内部释放,从而使乳化性增力口。但随着酶解时间的增加,大量小肽以及氨基酸含量逐渐增加,导致其在油一水界面的两亲性下降,乳化活性降低[7]。乳化活性与上述疏水性的趋势一致,疏水性的增加有助于蛋白乳化活性的提升。
2.2乳液稳定性
2.2.1乳析指数
乳析指数可以从宏观角度评价乳液物理稳定性,是关于油相和连续相之间平衡稳定状态的指标,乳析指数越低,乳液状态越稳定[19]。由表1可观察到PSP乳液乳析现象严重,出现明显的乳液分层,不能稳定乳液均一状态;经过胰蛋白酶酶解后的蛋白乳析指数显著性降低,说明胰蛋白酶对南瓜籽蛋白改性有助于形成稳定的乳液,而DH 5%的蛋白乳液30 d内未出现乳析现象,表明DH 5%乳液油水界面平衡性最佳。
2.2.2粒径分布及Zeta电位
粒径大小及其分布展示了乳液体系的分布状态,是衡量乳液稳定性的重大指标[20]。如表1所示,酶解后的蛋白乳液粒径显著性小于PSP乳液,粒径越小油滴难以聚集,乳液状态也越稳定[13]。图5 中,PSP、DH 2%蛋白乳液的粒径曲线图出现双峰现象,表明乳滴分布不均匀且有两种大小不同的粒径,5皿左右出现峰的乳滴所占比例较小,但这些大乳滴往往影响了乳液稳定性。这主要由于乳液表面蛋白的乳化性较差,导致形成的乳液不能包埋成均一稳定的油滴颗粒[18]18-20。DH 2%和DH 8%的蛋白乳液比DH 5%乳液的平均粒径较大且分布较宽,可能与酶解程度不同有关[16],适当水解有助于将包埋在蛋白内部的疏水性基团暴露,使蛋白达到两亲性从而稳定乳液[7]。Zeta电位反映了胶体颗粒之间的电荷排斥作用,是表征乳液稳定性的重要指标。Zeta电位值为负值说明乳液表面存在阴离子,当电位的绝对值较高时,表面净电荷越多,乳滴之间静电斥力越大,乳液往往具有较高的稳定性和较小的颗粒[21]。表1中DH 5%的乳液电位绝对值最大,且与其他乳液电位值存在显著性差异,表明DH 5%的蛋白乳液最稳定。
2.2.3吸附蛋白含量与界面蛋白
界面蛋白含量和蛋白吸附含量对乳液的稳定性有重要影响。蛋白吸附含量表示界面吸附蛋白的覆盖率,蛋白吸附量越高,蛋白吸附至水一油界面的能力越强,乳液也越稳定[21]。如图6显示蛋白吸附含量随着水解度增加先增加而后降低,DH 5%吸附蛋白含量最高且与其他蛋白乳液具有显著性差异,表明DH 5%吸附至油一水的界面能力较强。界面蛋白浓度取决于吸附蛋白含量和乳滴的比表面积,界面蛋白浓度越高,乳液液滴对抗聚集的能力越强[15]。酶解蛋白的界面蛋白浓度均比PSP显著性增加,表明胰蛋白酶酶解南瓜籽蛋白对其乳化性有着明显改善。界面蛋白含量、吸附含量与蛋白的疏水性、乳化活性趋势一致,与乳液的乳析指数、粒径及电位趋势相反,说明胰蛋白酶对南瓜籽蛋白改性有助于形成稳定的乳液,且DH 5%的蛋白乳液稳定性最佳。
3结论
本实验利用胰蛋白酶对南瓜籽蛋白进行限制性酶解改性,酶解改性后的南瓜籽溶解度增加,蛋白分子量主要分布在25 kDa以下。不同酶解程度的蛋白影响其乳化性能,适当的水解程度有利于蛋白乳化性能的提高,疏水基团的有效暴露是提高乳化性能的关键。研究发现,DH 5%乳化性最高,能够形成稳定的乳液,表明改性后的PSP在开发食品级乳液方面具有广阔的应用前景。在此研究基础上,胰蛋白酶酶解改善南瓜籽蛋白乳化性的机理还需从结构层面进一步探究,通过胰蛋白酶改善PSP乳液体系稳定性为南瓜籽蛋白在食品乳液加工中的应用提供借鉴与指导。
参考文献
[1] VINAYASHREE S,VASU P. Biochemical,nutritional and functional properties of protein isolate and fractions from pumpkin (Cucurbita moschata var. Kashi Harit)seeds[J]. Food Chemistry,2021,340:128177.
[2]张妮.南瓜籽蛋白及多肽制备的研究[D].武汉:武汉轻工大学,2019.
[3] SA AMANDA G A,DA SILA D C,PACHECO MARIA T R,et al. Oilseed by-products as plant-based protein sources:Amino acid profile and digestibility[J]. Future Foods,2021,3:100023.
[4]王思程.南瓜籽蛋白的提取及其改性的研究[D].长春:吉林农业大学,2019.
[5]卢筠梦,赵雪,徐幸莲.蛋白界面膜及其评价方法研究进展[J].食品与发酵工业,2021,47(1):285-292.
[6]陈雯烨,王志高,鞠兴荣,等.纳米乳的研究进展与潜在局限性[J].粮食科技与经济,2020,45(3):79-83.
[7]马晓雨,陈先鑫,胡振瀛,等.限制性酶解对大米蛋白结构、功能特性及体外抗氧化活性的影响[J].中国食品学报,2020,20(11):53-62.
[8] JIN F,WANG Y P,TANG H K,et al. Limited hydrolysis of dehulled walnut (Juglans regia L.)proteins using trypsin:functional properties and structural characteristics[J]. LWT - Food Science & Technology,2020,133:110035.
[9] BUCKO S,KATONA J,POPOVIC L,et al. Investigation on solubility,interfacial and emulsifying properties of pumpkin (Cucurbita pepo)seed protein isolate[J]. LWT - Food Science and Technology,2015,64(2):609-615.
[10] BUCKO S,KATONA J,POPOVIC L,et al. Influence of enzymatic hydrolysis on solubility,interfacial and emulsifying properties of pumpkin (Cucurbita pepo)seed protein isolate[J]. Food Hydrocolloids,2016,60:271-278.
[11] NIELSEN P M,PETERSEN D,DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal of Food Science,2001,66(5):642-646.
[12]曾琪,胡淼,王歡,等.pH值处理对黑豆分离蛋白结构、流变特性及乳化性能的影响[J].食品科学,2020,41(22):15-21.
[13]侯克洪,冯潇,高成成,等.肉桂精油纳米乳液的抑菌性和稳定性研究[J].中国粮油学报,2020,35(11):86-92.
[14] SARKAR A,HANNAH K,ANNIE B,et al. Emulsion stabilization by tomato seed protein isolate:Influence of pH,ionic strength and thermal treatment[J]. Food Hydrocolloids,2016,57:160-168.
[15]陈先鑫,马晓雨,朱雯婷,等.乳清蛋白乳液界面性质及其物理稳定性和氧化稳定性的研究[J].食品工业科技,2016,37(4):155-159+164.
[16]许英一,王彪,王宇,等.限制性酶解燕麦蛋白功能特性和抗氧化活性[J].食品工业,2020,41(6):198-201.
[17]李皖光,汪桃花,王新文,等.4种大米蛋白水解度测定方法比较[J].粮食科技与经济,2017,42(5):35-37.
[18]李燕.超声波处理对酪蛋白酸钠预乳化液稳定性影响及机制研究[D].郑州:郑州轻工业大学,2021.
[19]刘竞男,徐晔晔,王一贺,等.高压均质对大豆分离蛋白乳液流变学特性和氧化稳定性的影响[J].食品科学,2020,41(1):80-85.
[20]田格.藜麦蛋白的提取及其功能特性改善研究[D].西宁:青海师范大学,2020:20.
[21]李颖,李保玲,范鑫,等.脂肪氧合酶催化亚油酸氧化对猪肌原纤维蛋白乳化性能的影响[J].食品与发酵工业,2021,47(13):85-91.
Enzymatic Modification of Pumpkin Seed Protein and Its Functional Properties
Lu Chen,Zhang Yushen,Tong Wenjun,Hu Zhenyang,Du Lihui
(School of Food Science and Engineering,Nanjing University of Finance and Economics / Jiangsu Provincial Center for Synergy Innovation in Modern Grain Circulation and Safety/Jiangsu University Key Laboratory of Grain and Oil Quality and Safety Control and Deep Processing,Nanjing,Jiangsu 210023)
Abstract:Pumpkin seed protein was modified by trypsin in order to further develop pumpkin seed protein and improve its emulsifying properties. The protein emulsion was prepared by high pressure homogenization of enzymolysis protein and soybean oil and its stability was studied. The effects of enzymatic hydrolysis on the protein were observed by measuring solubility,molecular weight,hydrophobicity and emulsifying properties. The effects of the hydrolysate on the stability of the emulsion were investigated by emulsion index,particle size distribution and interfacial protein concentration. The results showed that trypsin improved the solubility,hydrophobicity and emulsifying activity of pumpkin seed protein. The size of protein emulsion droplets after enzymatic hydrolysis was smaller and distributed evenly,and the concentration of interfacial protein increased significantly. Especially,the stability of protein emulsion with a hydrolysis degree of 5% was the best. The modified pumpkin seed protein is a good natural emulsifier.
Key words:pumpkin seed protein,enzymatic modification,emulsion,stability

