索磷布韦/维帕他韦治疗慢性丙型肝炎患者的临床疗效及安全性分析
曹欣 冯倩嫦 余卫华 陈燕清
广州医科大学附属市八医院 510060
不同性别、年龄、种族人群均对丙型肝炎病毒(HCV)易感,据世界卫生组织(WHO)估计,2015年全球7 100万人有慢性丙型肝炎(CHC)感染,39.9万人死于HCV感染引起的肝硬化或肝细胞癌[1]。我国在全球范围内属HCV低流行地区,感染者约为0.43%,有将近1 000万的慢性感染者尚需治疗。HCV目前可至少分为6个基因型及多个亚型,国内主要以1b型为主,但中国南部以基因3型和6型占比高,20%~30%的CHC患者10~20年后可能演变为肝硬化、肝衰竭或肝细胞癌[2-3]。既往CHC治疗多给予聚乙二醇干扰素-α联合利巴韦林方案(PR方案),但此方案不良反应多、禁忌证不少、患者耐受性欠佳,导致约30%的患者未接受过PR方案治疗[4],且使用标准PR方案,实现持续病毒学应答(SVR)成功率在44%~70%,临床疗效不甚满意。近几年,直接抗病毒药物(DAA)时代来临,让越来越多的CHC患者获得SVR,临床结局明显好转。目前国际上获批的DAAs大部分已经在我国获批准,已基本取代PR方案,成为推荐方案[5-7],但部分药物却受限于基因分型、有无肝硬化等基础,其后出现了泛基因型方案。索磷布韦/维帕他韦(SOF/VEL)抗病毒作用强,存在较高耐药屏障,体外研究显示可高效抑制基因1~6型HCV RNA复制。本研究对1~6基因型的初治或复发CHC使用SOF/VEL,部分联合利巴韦林,对短期疗效进行回顾性分析,现将结果分析报道如下。
1 资料与方法
1.1 一般资料 选取广州医科大学附属市八医院2019年1月至2020年6月就诊 的55例CHC患者 为 研 究对象,采用回顾性研究方法,回顾性总结分析使用SOF/VEL或联用利巴韦林的临床疗效及安全性分析。所有患者均符合中华医学会肝病学会及感染病学分会《丙型肝炎防治指南(2019年版)》的诊断标准。(1)抗-HCV和HCV RNA阳性6个月以上;(2)年龄≥18岁;(3)初治:之前未使用PR方案或其他DAA治疗,经治:曾使用PR方案或其他DAA治疗后复发;(4)患者及家属知情同意,并签署知情同意书。
1.2 方法 所有患者均口服SOF/VEL(Gilead Sciences Ireland UC,批号20SXG00PD,每片含SOF 400 mg/VEL 100 mg)1片/d,疗程12周,均完成了预定的治疗;部分联用利巴韦林(广东华南制药有限公司,批号191101),<75 kg者1 000 mg/d,≥75 kg者1 200 mg/d,疗程12周。
1.3 观察指标 观察治疗前、治疗4周、治疗12周血常规、血清肌酐(Scr)、肝功能[总胆红素(TBil)、谷丙转氨酶(ALT)、谷草转氨酶(AST)]、HCV RNA定量、HCV基因型、乙型肝炎病毒表面抗原(HBsAg)、HIV抗体,彩超或CT或MRI,治疗前及治疗12周的肝脏瞬时弹性硬度,合并疾病以及合并用药情况。计算治疗前及治疗12周的肝纤维化指数4(FIB-4)=年龄(岁)×AST(U/L)/[血小板计数(×109/。
1.4 检测方法 使用美国罗氏公司COBAS的全自动病毒载量仪,并采用荧光探针法检测血清HCV RNA载量(美国罗氏公司试剂盒),检测值下限为15 IU/ml。采用基因芯片法检测HCV基因分型(雅培公司);肝脏瞬时弹性硬度检测(FibroScan,法国Echosens公司)。
1.5 临床疗效 依据《丙型肝炎防治指南》评估临床疗效。快速病毒学应答(RVR):治疗4周时,血清HCV RNA定量<1×103IU/ml或下降≥2 log10 IU/ml;治疗结束时病毒学应答(ETVR):抗病毒治疗结束时,血清HCV RNA低于检测下限。SVR:抗病毒治疗结束后随访12周时,血清HCV RNA低于检测下限。
1.6 统计学处理 采用SPSS 19.0软件进行统计学分析,符合正态分布的计量资料采用均数±标准差(±s)表示,使用方差分析进行组间比较,计数资料采用χ2检验;P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况55例患者中,男40例,女15例;年龄范围为27~68岁,年龄(49.6±3.2)岁。主要为1b型17例,3a型18例,6a型12例,另有2a型3例,3b型5例。14例有肝硬化病史:3例失代偿期肝硬化,11例代偿期肝硬化。初治患者53例,经治患者2例(1例曾服用艾尔巴韦格拉瑞韦片,1例曾PR方案)。合并其他慢性疾病:7例慢性乙型肝炎感染,4例高脂血症、脂肪肝,4例糖尿病,1例高血压,2例原发性肝癌。所以患者均完成12周SOF/VEL治疗,其中18例联合利巴韦林(9例肝硬化,2例经治,7例HCV:3例3a型、2例3b型、2例6a型),37例单用SOF/VEL治疗。
2.2 临床疗效55例患者中,共有47例(85.5%)达到RVR;至治疗12周55例(100.0%)达到ETVR,包括2例DAAs经治患者;53例(96.4%)达到SVR 12周,其中2例复发(1例代偿期肝硬化,1例失代偿期肝硬化,均未联用利巴韦林)。治疗4周:有8例(14.5%)HCV RNA水平仍高于检测值下限,其中1b型3例(2例为肝硬化),2a型1例(肝硬化),3a型3例,6a型1例;16例肝功能恢复正常,6例仍异常;治疗12周:2例肝功能仍异常(1例肝硬化、1例脂肪肝)。治疗4周及治疗12周的TBil、Scr、白细胞(WBC)、血红蛋白(Hb)、血小板(PLT)与治疗前比较,差异均无统计学意义(均P>0.05);ALT、AST与治疗前比较,差异均有统计学意义(均P<0.05)。见表1。了解肝纤维化变化情况,分析患者治疗前与治疗12周的FIB-4、肝脏瞬时弹性成像水平,差异均有统计学意义(均P<0.05),见表2。
表1 55例慢性丙型肝炎患者各时间点的检测指标比较(±s)

表1 55例慢性丙型肝炎患者各时间点的检测指标比较(±s)
注:TBil为总胆红素,ALT为谷丙转氨酶,AST为谷草转氨酶,Scr为血清肌酐,WBC为白细胞,Hb为血红蛋白,PLT为血小板
时间治疗前治疗4周治疗12周F值P值TBil(µmol/L)30.89±3.86 28.76±1.54 27.99±4.76 4.675 0.253 ALT(U/L)72.19±48.34 30.13±19.66 22.80±3.52 31.025<0.001 AST(U/L)62.07±33.31 26.19±17.53 17.45±2.24 31.083<0.001 Scr(µmol/L)71.16±25.12 69.08±12.34 69.13±15.45 0.074 0.843 WBC(×109/L)6.86±0.14 6.74±0.46 6.68±0.53 0.081 0.856 Hb(g/L)135.14±4.26 133.24±3.87 130.16±3.75 0.821 0.625 PLT(×109/L)195.39±38.74 211.67±16.86 211.47±15.93 0.342 0.853
表2 55例慢性丙型肝炎患者治疗前、治疗12周的FIB-4及肝硬度比较(±s)
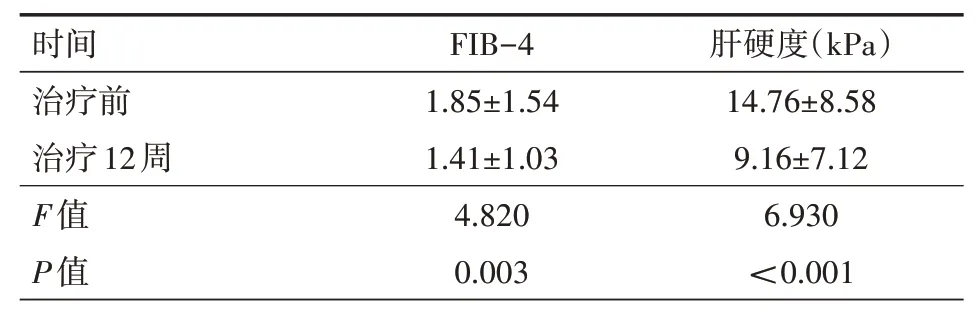
表2 55例慢性丙型肝炎患者治疗前、治疗12周的FIB-4及肝硬度比较(±s)
注:FIB-4为肝纤维化指数4
时间治疗前治疗12周F值P值FIB-4 1.85±1.54 1.41±1.03 4.820 0.003肝硬度(kPa)14.76±8.58 9.16±7.12 6.930<0.001
2.3 不良反应 患者均没有发生因不良事件终止治疗的患者,没有发生严重不良反应。治疗期间的不良反应包括头晕、乏力、转氨酶升高,1例因转氨酶升高调整治疗方案(停药护肝2周继续完成疗程);7例患者合并慢性乙型肝炎感染,其中1例长期服用恩替卡韦,7例治疗前、治疗12周检测HBV DNA均低于检测范围。
3 讨 论
近几年,国家重视DAAs的卫生经济学研究,已采取相应措施大幅降低价格,提高治疗可普及性,目前首先推荐无干扰素的泛基因型方案,治愈率都是非常可观的[8-9]。
本组患者全疗程DAAs后,可以显著改善肝功能,减轻肝脏炎症活动;FIB-4、肝脏瞬时弹性成像水平得到明显改善,提示可以逆转肝纤维化,期望对长期预后有改善。另有报道指出,SOF/VEL治疗成人的HCV感染者(基因1~6型)具有良好的疗效,SVR能达到95%~98%[10-12],与本报道结果相符;南部地区基因3型高达70%,基因3型对其他DAAs耐药率偏高,但SOF/VEL治疗基因3a、3b型有效率高。有报道指出,达到SVR的患者肝脏弹性检测值平均下降7.0 kPa[4],与本研究结果相符,获得一定程度肝纤维化的逆转,改善肝脏储备功能,可降低门静脉高压[13-16]。相比PR方案,出现不良事件的概率低,患者可耐受药物的不良反应,其安全性好[17]。本研究有1例出现治疗中转氨酶继续升高,建议DAAs治疗前评估肝功能情况,待肝细胞炎症活动减轻后再治疗。目前观点,除了基因3型代偿期肝硬化或者3b型、失代偿期肝硬化、DAAs治疗失败等少数特殊人群以外,可以单用SOF/VEL,建议可不需要联合利巴韦林治疗,本组2例肝硬化患者未达到SVR 12周,均未联用利巴韦林,何种情况需联用利巴韦林,尚需更多数据分析。因此,泛基因型方案的应用可减少治疗前和治疗中的监测,更加适合于基层医院对慢性HCV感染者实施治疗和管理。CHC患者中,接受DAAs治疗患者中HBV再激活引起肝炎发生率为0.2%~33.2%。因此,DAAs治疗期间和治疗后,密切监测HBV DNA水平,若HBV DNA水平升高,应加用核苷(酸)类似物抗HBV治疗[18-19]。对获得SVR的CHC患者,仍需定期长期规范随访管理,特别是代偿期肝硬化患者,仍需继续抗肝纤维化治疗。
综上所述,SOF/VEL的临床意义值得充分肯定。但此次研究仍存在一定不足,如停药12周观察时间较短,为早期临床观察的结论,对肝硬化及肝细胞癌发生风险评估时间较短,DAAs治疗代偿期或失代偿期肝硬化的长期获益有待长期规范随访研究;其他基础疾病合并用药的监测评估等病例数量偏少,因此,需要继续扩大样本量,进行多中心的长期临床观察研究是非常必要的。
利益冲突:作者已申明文章无相关利益冲突。

