载3PO脂质体-微泡复合物制备及其控制释放研究
伍巍兰 吴华君 吴 莎 陈 君 李健豪
恶性肿瘤目前已严重危害人类的健康,肿瘤血管新生理论指出肿瘤的生长和转移取决于新生血管形成,其所需的ATP 85%来自糖酵解。磷酸果糖激酶-2/果糖-2,6-二磷酸酶(PFKFB3)作为糖酵解途径中的一个关键限速酶,其小分子抑制剂3PO可以显著降低糖酵解速率,抑制内皮细胞的增殖和迁移,减少血管萌芽及新生[1-3],抑制肿瘤新生血管生成,从而发挥抗肿瘤作用。然而抗肿瘤药物缺乏靶向性且存在一定程度的毒副作用,降低了药物的疗效,限制了其临床应用。超声脂质体-微泡复合物作为一种良好的药物载体,具有载药量高和声学性能良好的优点,可以将药物靶向输送到局部组织,并结合超声破坏技术局部释放药物,进而提高药物的靶向性和治疗效果,减少全身毒副作用[4]。本实验拟通过生物素-亲和素系统将载3PO脂质体连接到普通微泡表面,获得载3PO脂质体-微泡复合物(3PO-LMC),观察其一般特征,探讨其体外超声显影及控制释放能力,旨在为联合超声辅助给药体系在肿瘤治疗领域提供一种新的、有效的药物载体。
材料与方法
一、主要实验材料
二硬脂酸磷脂酰胆碱(DSPC)、二棕榈酰磷脂酰胆碱(DPPC)、生物素化脂质(DSPE-PEG 2000-Biotin)、聚乙二醇(PEG)-40硬脂酸酯、胆固醇(美国Avanti公司);异硫氰酸荧光素(FITC)、链亲和素、Triton X-100(美国Sigma公司);3PO(美国Selleck公司);氯仿(CHCl3)、甲醇、丙二醇、甘油(上海化学试剂厂);乙腈、磷酸盐(国药集团化学试剂有限公司);细胞膜红色荧光探针(DiI,中杉金桥);磷酸盐缓冲液(PBS)粉末(广州尚鸿生物科技有限公司);全氟丙烷(C3F8,广东华特气体股份有限公司);生理盐水(广东大冢制药有限公司);三氟乙酸(TFA,上海吉至生化科技有限公司)。
二、主要实验仪器
倒置荧光显微镜(BX51,日本Olympus公司);透射电子显微镜(HT770,日本Hitachi公司);低温高速离心机(Avanti JXN-30,美国Beckman Coulter公司);激光粒度仪(Mastersizer 3000,英国马尔文仪器有限公司);库尔特分析仪(MultisizerⅢ,美国Beckman Coulter公司);高效液相色谱仪(SHIMADZU/LC-16,日本岛津公司);水浴超声清洗仪(PS-80,深圳洁康超声波科技有限公司);银汞调和器(YJT,上海医疗器械股份有限公司);彩色多普勒超声诊断仪及超声成像系统(Acuson Sequoia 512,德国西门子公司);反相色谱柱(Zorbax RP-C18,美国Agilent公司)。
三、主要实验方法
(一)3PO-LMC的制备
1.生物素化载3PO脂质体(3PO-LPs)的制备及其特征检测:将DPPC、胆固醇和DSPE-PEG 2000-Biotin按摩尔比60∶40∶5溶解于CHCl3中,然后加入5 mg 3PO,通过氮气吹干形成磷脂膜,于45℃真空干燥箱内去除残余CHCl3,将PBS(pH值7.4)加入试管中,置于62℃水浴超声清洗仪中直至脂质体澄清,磷脂最终浓度为10 mg/ml。采用激光粒度仪测定脂质体的粒径及Zeta电位;高效液相色谱(HPLC)法测定脂质体的包封率。
2.生物素化普通微泡(MBs)的制备及其特征检测:应用机械振荡法制备核心气体为C3F8的脂质微泡。将DPPC、PEG-40硬脂酸酯和DSPE-PEG 2000-Biotin按摩尔比82∶10∶8溶解于装有丙二醇的三角锥形瓶中,另加入适量的生理盐水和甘油(体积比95∶5),分别置于70℃水浴锅中至溶液变澄清透明时混合,以恒量持续通入氮气至混合液再次变清澈,即可制得磷脂分散液。然后分装于西林瓶中加盖密封,C3F8气体置换,使用银汞调和器机械振荡45 s后制得微泡悬浮液。采用库尔特分析仪测定微泡的粒径及浓度。
3.3PO-LMC的制备:通过生物素-亲和素连接方式偶联MBs和3PO-LPs,向MBs中加入0.5 mg/ml亲和素蛋白孵育15 min后,使用PBS离心洗涤3次去除未结合的亲和素蛋白,再加入200μl 3PO-LPs孵育30 min,PBS离心洗涤3次后获得3PO-LMC。
(二)一般特征检测
1.形态学观察:取100μl微泡浓度为1×108/ml的MBs和100μl 3PO-LPs各用PBS稀释至1 ml,分别与FITC、DiI孵育30 min,PBS洗涤、纯化后获得FITC标记的MBs和DiI标记的3PO-LPs,然后再通过上述3POLMC制备方式获得双荧光标记的3PO-LMC。于荧光显微镜下观察并拍照。
2.浓度及粒径:采用库尔特分析仪测定3PO-LMC的粒径和浓度。作为对照,测定MBs的粒径和浓度。
3.载药量测定:①药物3PO标准曲线绘制。精密称取3PO至容量瓶中,加入甲醇充分溶解并定容配置成1 mg/ml储备液,用甲醇逐步稀释,配置成浓度为120.0μg/ml、60.0μg/ml、30.0μg/ml、15.0μg/ml、7.5μg/ml
溶液。分别吸取以上溶液20μl,过滤后采用高效液相色谱仪测定样品在304 nm波长处的吸收峰面积。具体色谱条件为:流动相为乙腈-水(体积比2.5∶97.5)添加0.1%TFA,Zorbax RP-C18反相色谱柱(4.6 mm×250.0 mm,5μm),流速1.0 ml/min,柱温25℃,绘制3PO浓度-吸收峰面积的标准曲线。②3PO-LMC载药量的测定。将1 ml微泡浓度为1×108/ml的3PO-LMC烘干,加入CHCl3以溶解并释放出脂质体内容物,待挥发后加入甲醇稀释溶解,通过HPLC和标准曲线法测定3PO-LMC中3PO的含量。
(三)体外超声显影效果评估
取200μl微泡浓度为1×106/ml的MBs和3PO-LMC分别置于琼脂模型中,以PBS为对照,使用彩色多普勒超声诊断仪(15L8-S探头,频率7.0 MHz,机械指数0.18,帧频16 Hz)进行对比成像后,使用MCE 2.7软件获取超声显影强度(VI),评估其体外超声显影效果。
(四)体外超声控释药物能力检测
将3PO-LMC分为11组,每组3份(每份1 ml,1×108/ml),分别为空白对照组(不做任何处理)、裂解组(用1%Triton X-100溶液完全裂解微泡),余9组进行超声相应处理,超声强度分别为0.35、0.70、1.00 MPa,辐照时间分别为10、30、60 s,采用频率1 MHz的聚焦探头,占空比为1%的脉冲波辐照。辐照后离心去除上层液,再将各组溶液定容至1 ml,采用HPLC法测定3PO药物的含量。释放率=(CUS-C0)/(Ctx100-C0),其中CUS为超声辐照后药物的浓度,C0为空白对照组药物的浓度,Ctx100为经1%Triton X-100溶液完全裂解微泡后药物的浓度。
四、统计学处理
结 果
一、3PO-LPs的粒径、Zeta电位及包封率
由激光粒度仪测得3PO-LPs的粒径为(174.77±3.62)nm,分散性良好,Zeta电位为(-22.75±0.63)mV,包封率为(90.74±1.67)%,制备重复性良好。
二、3PO-LMC的表征
制备的3PO-LMC混悬液为乳白色,微泡镜下表现为球形,大小分布均匀,分散度较好,无明显粘连和聚集;荧光显微镜下可同时见红、绿色荧光(图1),表明DiI标记的3PO-LPs成功连接到FITC标记的生物素化微泡表面。库尔特分析仪测得MBs制备成3PO-LMC后,粒径由(2.10±0.12)μm增大至(2.54±0.15)μm,而浓度由(1.33±0.08)×109个/ml减少至(0.86±0.06)×109个/ml,表明在制备的过程中微泡存在一定的耗损。

图1 MBs、3PO-LPs及3PO-LMC显微镜下观(×200)
三、3PO-LMC载药量测定
采用标准曲线法测定3PO-LMC中3PO的浓度。在0.5~120.0μg/ml浓度范围内,3PO浓度与吸收峰面积呈良好的线性关系,见图2;线性回归方程为:y=99.009x-224.07,R2=0.9989。根据标准曲线法测得3PO-LMC载药量为(99.58±6.63)μg/108个复合物。

图2 3PO浓度-吸收峰面积的标准曲线
四、体外超声显影特征
超声对比成像探头下,琼脂模型中MBs和3POLMC的回声较PBS明显均匀强化,显示出良好的超声造影效果(图3);MBs和3PO-LMC的VI分别为(120.20±6.68)IU和(119.40±6.21)IU,均较PBS的VI[(17.68±5.53)IU]明显升高,差异均有统计学意义(均P<0.05);3PO-LMC与MBs的VI比较差异无统计学意义。

图3 MBs、3PO-LMC及PBS在琼脂模型中的超声造影图
五、体外超声控释药物
低频超声可以靶向破坏3PO-LMC释放出药物,在相同超声强度下,药物释放率随着超声作用时间延长而增加(P<0.05);在相同超声作用时间下,药物释放率随着超声强度的增加而增加(P<0.05);当超声强度为1.00 MPa、作用60 s时,3PO-LMC的药物释放率达到最高,为(90.93±1.79)%。见图4。
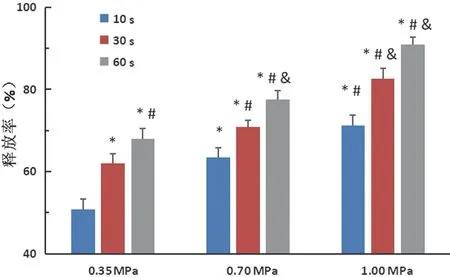
图4 3PO-LMC体外超声控释药物柱状图
讨 论
肿瘤新生血管已成为肿瘤治疗的靶点,目前阻断血管内皮生长因子(VEGF)是减少新生血管形成的主要策略,然而即使同时使用多种阻断剂,其临床疗效也有限,且存在明显的毒副作用[5-7]。因此,需要寻找一种新的抗血管新生治疗靶点,考虑到内皮细胞85%的能量依赖于糖酵解[8],以内皮细胞代谢为目标可能会成为一种抑制新生血管形成的新策略。3PO作为一种PFKFB3的小分子抑制剂,在内皮细胞增殖过程中可以降低内皮细胞的糖酵解,抑制内皮细胞的能量供应[9],从而抑制内皮细胞的增殖和迁移,减少血管的萌芽及新生血管的形成,进而抑制肿瘤的生长达到治疗肿瘤的目的[1-3]。但是目前相关动物实验[1,3]的给药方式均为腹腔注射,其水溶性低,需与一些增溶剂如二甲基亚砜、无水乙醇等一起使用,易引起机体的局部组织坏死、神经毒性甚至死亡,而且长期全身使用药物存在一定程度的毒副作用,限制了该药物未来的临床应用。因此,如何将3PO药物安全、有效、高选择性地传输到肿瘤部位成为治疗研究的难点。
超声微泡作为一种超声造影剂,不仅具有疾病诊断的作用,而且可以作为化疗药物或基因载体,在一定强度的超声辐照下,局部发生空化效应破裂,从而靶向控制释放化疗药物或基因[9-10]。但是由于造影剂微泡外壳为较薄的脂质膜或蛋白膜,在膜上能携带的药物量或基因量有限,而且微泡中心为惰性气体所占据,减少了微泡携带药物或基因的能力,难以达到临床治疗的有效剂量。脂质体-微泡复合物作为一种良好的声敏药物载体,具有无创安全、有效、靶向等特点,研究[11-13]表明,该复合物载体对脂溶性药物和水溶性药物均具有较高的载药量,不但满足临床肿瘤治疗的用量需求,还可以将抗肿瘤药物或基因特定传输到肿瘤部位,以增强肿瘤治疗效果,体现了该复合物在体内治疗肿瘤的临床意义。本实验拟采用生物素-亲和素非共价键结合方式制备3PO-LMC,并探讨其一般特征、体外超声显影效果及超声控制释放能力。结果显示,制备的3PO-LMC具有普通微泡形态,粒径约(2.54±0.15)μm,符合临床上微泡的使用要求,可以顺利通过肺循环,而且实验中所采用的磷脂材料具有生物相容性良好的特性,保证了临床使用的安全性;其中脂质体-微泡复合物制备所采用的生物素-亲和素连接系统为高强度的非共价结合方式,难以被体内蛋白溶解酶解离,具有高效、稳定的特点,可以保证药物的靶向输送。理想的超声造影剂应具有良好的超声显影增强效果以实现体内有效的识别追踪,本实验制备的3PO-LMC在体外琼脂模型中可显示出与普通微泡一致的超声显影效果,具有良好的超声声学特性,可为进一步体内实验提供有效的识别追踪及效果评价。
微泡在超声波的作用下会产生空化效应[14],即微泡周期性振荡、膨胀、收缩以致内爆等一系列动力学过程,并伴随着多种能量释放。空化效应的大小与超声能量密切相关,能量越高,空化效应越明显,对病变及周围正常组织所造成的损伤越严重,从而造成严重的病理生理后果。对于载药超声造影剂,期望能在保证体内局部药物释放率的同时,尽量避免或减少因超声辐照对机体正常组织造成损害,保证使用的安全性。因此,在超声介导载药脂质体-微泡复合物的治疗过程中,超声相关参数的合理选择尤其重要。本实验中,在相同超声强度条件下,药物释放率与超声辐照时间呈正相关(P<0.05);而在相同超声辐照时间下,药物释放率也与超声强度呈正相关(P<0.05),与既往研究[15-16]结果相符。而且本实验结果显示,超声强度1.00 MPa、作用60 s时药物释放率达到最大[(90.93±1.79)%],为后续低能超声介导载3PO脂质体微泡的体内外治疗研究提供超声条件参考。
本实验的局限性:①3PO-LMC在制备时需经过多次离心洗涤,消耗较大,使得制备出的3PO-LMC浓度低于普通微泡造影剂;②尽管生物素-亲和素连接方式是目前最有效的靶向结合系统,但是亲和素受内源性生物素竞争,存在免疫原性,在临床应用可能会产生排异反应;③3PO-LMC的治疗效果尚有待体内外实验的进一步验证;④超声参数有待于今后治疗研究的进一步优化及评估,尤其对于体内实验,需评估不同超声参数对于周围正常组织的损伤情况,以提高超声使用的安全性。
综上所述,本实验成功构建了3PO-LMC,其不仅在体外显示出良好的超声显影效果,在超声辐照下还可获得良好的药物释放,为后续体内外治疗研究奠定了基础,有望为体内肿瘤治疗提供一种新的、安全、有效的药物载体和方法。

