向日葵抗列当基因Or5的抗性遗传及分子标记筛选
张曼 孙墨可 田娟 董玉迪 贾云峰 李慧英 牛庆杰


摘要 以向日葵高感列当E的自交系09110-21264162A为母本,与抗病自交系J-09R进行杂交构建F2群体,分析了向日葵抗列当E的抗性遗传规律,并且采用SSR技术在亲本和F2代群体中筛选与抗列当基 因Or5连 锁的分子标记。结果表明:F2群体的抗感比符合3∶1的分离规律,筛选出与抗列当基因 Or5 连锁的1个分子标记ORS1036。经F2分离群体验证,该标记的表型鉴定结果与分子检测结果的一致性为94%。将该标记对84份自交系进行筛选,获得了15份可能携带 Or5 基因的抗列当资源,为抗性育种提供宝贵资源。
关键词 向日葵;抗列当;SSR分子标记
中图分类号 S 565.5 文献标识码 A
文章编号 0517-6611(2021)14-0089-04
Abstract The study was carried out by crossbreeding between sunflower broomrape E susceptible inbred line 09110-21264162A and the resistant inbred line J-09R as parents to construct the F2 population.The parents,F1 and F2 generations were inculated with broomrape and the inheritance of resistance to the plant was analyzed according to the results of phenotype observation.The linked marker was screened with two parents and a F2 population by SSR technology.The results revealed that the identification result of the individual plant of the F2 population was in line with the antiinfection ratio of 1R:3S.The Molecular Marker,ORS1036,which was linked to Or5, was screened from F2 population and the parents by SSR technique.The results of phenotypic identification was 94% consistent with the molecular detection.This marker ORS1036 was used to screen 84 inbred lines and 15 materials which contained the marker were obtained,which could provide valuable resources for resistance breeding.
Key words Sunflower;Broomrape resistance gene;SSR marker
基金項目 国家现代农业产业技术体系和吉林省科学技术厅重点科技研发项目(20180201070NY)。
作者简介 张曼(1987—),女,河北辛集人,助理研究员,在读博士,从事分子育种研究。*通信作者,研究员,从事向日葵育种研究。
收稿日期 2020-11-27
向日葵列当( Orobanche cumana) 是1年生全寄生性杂草,依靠短须状假根寄生在向日葵根系上存活,被列当寄生后的向日葵植株茎秆低矮细弱,向日葵产量和品质明显降低[1-4]。
危害向日葵的列当群体中有很多生理小种,已鉴定出编号为A~H的8个向日葵列当小种[5-6]。在我国D小种出现的频率最高,是我国向日葵列当的优势生理小种。E小种主要分布于新疆和内蒙古的不同区域[7]。
在世界范围内,列当的防除一直以来都是一大难题。目前在生产上防御和控制向日葵列当最经济、最有效的方法就是推广培育向日葵抗列当品种。国内外向日葵育种家通过室内盆栽鉴定、田间病圃鉴定等方法已筛选得到一些向日葵抗列当资源,成功培育出部分抗列当品种。但是通过常规育种方法筛选的过程费力,很难针对性地培育出具体抗生理小种的向日葵品种,且育种时间长,人力成本较大,选择效率较低[8]。分子标记辅助选择育种随着植物分子生物技术的发展应运而生,为育种家在亲本和后代筛选中提供了新的技术和方法。列当抗性一般认为是由单显性基因控制。数量性状基因座定位分析表明,列当抗性受位于向日葵连锁群LG3的主要基因 Or5 影响[9-11],还受其他4个QTL的轻微影响。另外一些学者通过组织学和基因学研究发现,减少列当种子萌发的刺激物或者快速拔除病株体能够有效抗列当小种,认为抗小种E是由多基因组成,因此在实际工作中,应根据具体的组合进行抗性遗传的相关分析。
Tang等[9]采用BSA的方法针对生理小种E的抗性基因 Or5 进行了分子标记筛选,结果表明,抗性基因 Or5 位于遗传图谱连锁群Linkage group 3的端粒或近端粒区域,与标记CRT392的遗传距离为6.2 cM,与ORS1036的遗传距离为7.5 cM。Imerovski等[12]通过对4份向日葵材料进行基因 Or5 的分子标记筛选,认为ORS1036和ORS1114与该研究的基因型中 Or5 基因没有密切联系,说明不同遗传背景的材料对分子鉴定具有很大影响。
目前国内基于抗列当基因 Or5 的分子标记的筛选仍处于空白。该研究拟利用抗列当E亲本和感列当E亲本配制的杂交组合及F2群体为研究材料,研究在该组合中的抗性遗传规律,采用SSR技术筛选与向日葵 Or5 连锁的分子标记,并且利用获得的分子标记进行种质资源的初步筛选,旨在为今后育种工作奠定基础。
1 材料与方法
1.1 试验材料
利用向日葵感列当E自交系09110-21264162A(以下简称09110-A)和高抗E自交系J-09R为双亲,配制F2代群体,在白城市农业科学院温室进行种植管理及抗性鉴定。亲本、F2群体及种质资源筛选的向日葵自交系,均由吉林省白城市农业科学院向日葵研究所提供。
向日葵列当为吉林省白城市农业科学院生物技术实验室保存的经鉴定为E类型的生理小种。
1.2 试验方法
1.2.1 材料接种及鉴定。
采用列当抗性鉴定的常用方法进行鉴定。按营养土∶蛭石∶砂子=2∶1∶1的比例配制成培养土,将列当种子与土壤混合均匀后,转入播种盆中,种植向日葵材料,诱导列当种子对向日葵根系的寄生。温度20~25 ℃,植株生长期间适时适量浇水,土壤湿度不宜过大,否则不利于列当种子对向日葵根系的寄生。
出苗后35 d,小苗长出7~9片真叶,此时列当根瘤大量出现。将被测植株从杯中取出,用水冲洗干净根部,被侵染的向日葵根系上可发现有“根瘤”状突起或根状茎,通过肉眼即可鉴定。鉴定标准参照牛庆杰等[13]的方法,确定各材料的抗性并分析F2群体的抗/感分离比例。
1.2.2 向日葵DNA提取。
将向日葵幼苗真叶叶片放入研钵中,用液氮迅速研磨成粉末状,移取至1.5 mL微量离心管中,加入2×CTAB 提取液600 μL,振荡摇匀,于65 ℃水浴锅中水浴1 h,期间轻缓颠倒混匀。加入等体积氯仿∶异戊醇(24∶1),经12 000 r/min离心10 min,吸取上清转入新的1.5 mL 微量离心管中,加入等体积的氯仿,经12 000 r/min离心10 min,重复1次。加入2倍体积的无水乙醇(在-20 ℃冰箱中预冷),轻缓颠倒,弃上清,留下沉淀。再用70%乙醇溶液洗涤2遍,自然条件下干燥,加入适量ddH2O溶解。提取的DNA用紫外可见光分光光度计测定浓度,浓度统一稀释至50 ng/μL后,置于4 ℃冰箱,保存备用。
1.2.3 PCR反应。
PCR反应条件为20 μL体系中含2 μL模板DNA,上下游引物各1 μL,10 μL 2×PCRmix。
扩增程序:95 ℃预变性5 min,95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸30 s,共35个循环,最后72 ℃延伸10 min,4 ℃保存。
1.2.4 SSR分子标记筛选。
根据向日葵的抗感病情况,分别选取10株抗病和10株感病的单株,分别构建抗、感池后,将2个混池和亲本一起用于SSR分子标记的筛选。所有引物的合成由生工生物工程(上海)股份有限公司承担。
1.2.5 标记在种质资源的初步应用。
筛选出来的分子标记在56份向日葵自交系中进行分子标记鉴定,获得了有价值的种质资源。
2 结果与分析
2.1 抗性遗传规律
向日葵高抗自交系J-09R接种列当后,没有“根瘤”状突起或根状茎;易感09110-A接种列当后,植株生长弱小,表现为高感列当材料;以易感自交系09110-A与自交系J-09R为双亲配制F2代群体,对群体的单株进行抗性鉴定,结果F1群体均表现为抗列当,F2群体的抗感比率为207∶58,按照 F2 为 3∶1的抗感比率,通过卡平方( χ2)测验,χ2 值为 1.369 8,小于 χ20.05 =3.84,说明符合一对显性基因控制的理论分离比率3∶1(表1)。
2.2 亲本间多态性分子标记的筛查
利用67对SSR在抗、感列当亲本进行多态性分子标记筛查,共获得15对在亲本间具有多态性的分子标记(图1)。
2.3 多态性标记在F2群体中的验证
在F2群体中选取10株高抗单株与10株高感单株,提取 DNA 后,构建抗、感混池,利用筛选获得的亲本间具有多态性的15个SSR分子标记进行分析,获得5个可能与抗列当基因 Or5 紧密连锁的SSR分子标记ORS533、ORS57、ORS878、 ORS752、 ORS1036(图2)。引物序列见表2。进一步利用获得的这5对分子标记,对 F2群体中115个单株进行进一步验证。由于抗列当基
因是显性基因,如果引物与抗病基因紧密連锁,纯合与杂合抗病株都能扩增出与抗性亲本相同的条带,而纯合感病植株则扩增出与感病亲本相同大小的条带。经过分子标记ORS1036检测,F2代群体中有31个纯合抗列当单株,有58个杂合抗列当单株和26个感列当单株,部分检测结果见图3。
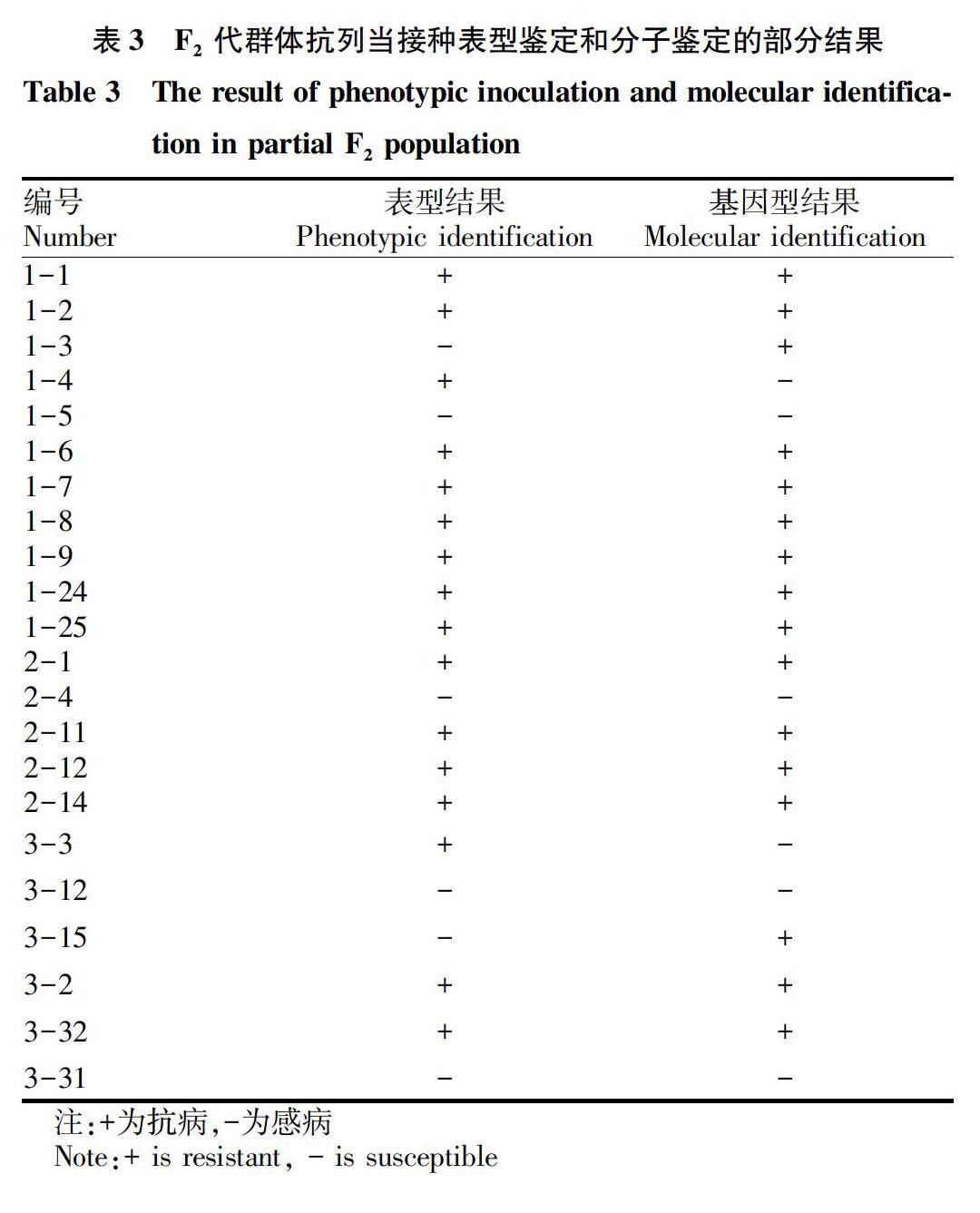
2.4 F2群体列当抗性鉴定结果
对列当抗性亲本、感列当亲本和115个向日葵F2单株人工接种向日葵列当生理小种E,进行抗病性鉴定。部分F2代群体分子检测结果与接种鉴定的结果比较见表3。经过对2种鉴定结果比较分析,115个向日葵F2植株有7个单株的鉴定结果不同,由表3可知,编号为1-4、1-3、3-3和3-15植株的人工接种鉴定结果与分子检测结果不同。其他植株的2种方法鉴定结果一致,在表型中鉴定为抗列当的,分子检测多表现为杂合带型。结合抗列当鉴定的试验结果,ORS1036的分子标记鉴定结果的准确率为94%,表型鉴定与分子鉴定的相关系数为0.60,具有一定的应用价值。
2.5 种质资源筛选
对84份向日葵材料进行分子标记鉴定,结果表明(图4),共有5个向日葵不育系含有标记ORS1036的244 bp条带(占总不育系的17.24%);7个向日葵恢复系含有标记,占总恢复系的35.00%;3个向日葵保持系含有标记,占总保持系的37.50%。经分子标记检测共得到15份含有该标记的种质资源。从图4可以看出,部分材料在ORS1036位点出现了杂合带型,后期需要对亲本材料进一步筛选纯化。
ORS1036标记引物鉴定获得可能携带 Or5 基因的抗列当资源,后续将对这些材料进行抗列当性鉴定,这些材料将成为今后育种工作中的宝贵资源。
3 讨论
用于辅助选择育种的分子标记,一般需要具备3个条件:①分子标记与目的基因紧密连锁;②标记需实用性强,重复性好,且能够经济简便地检测大量个体;③不同遗传背景选择有效。与向日葵抗列当基因连锁紧密的分子标记较少,加之育种单位间技术发展不平衡,真正开展分子标记辅助选择育种的单位较少。
该研究运用分子标记法和遗传图谱主要针对生理小种E和F抗性进行了研究,结果表明:小种E的抗性基因 Or5 存在于连锁群LG3的向日葵遗传图谱。然而,有关显性基因的抗性机理尚不清楚,尽管它被假设成一串可识别的抗性基因编码蛋白质,其特点是富含亮氨酸的重复图谱(LRR)和一个核苷酸结点(NBS)氨基点到LRR的位置,通过绘制NBS-LRR位点到 Or5 紧密相连的LG3上表明,有2个来自 H.tuberosus ,该结论进一步证明有关显性基因抗性机理的假设[14],并作为抗列当基因被广泛应用[15]。数量性状基因座(QTL)定位分析表明,除主要基因 Or5 外,抗生理小种E还受4个QTL的轻微影响,某些情况下为非小种特性,主要与每株寄主植物上列当的数量有关;组织学和基因学研究发现,减少列当种子萌发的刺激物或者快速拔除病株体能够有效抗列当小种,证明抗小种E是由多基因组成的。在该试验中,通过对亲本、F1代和F2群体对列当E小种的抗性鉴定,F1代植株都抗病,F2代的表现型符合一对显性等位基因控制的分离比率,符合单基因显性遗传规律,说明抗病性是由显性单基因控制。
在栽培向日葵中,不同密度和完整度的分子遗传图谱已经被建立,但具有实际应用价值的图谱仍较少,而且存在标记与抗列当基因间的遗传距离过大,选择准确性差或标记可重复性差等问题,而且目前尚无基于基因突变的功能标记能够100%准确预测所有遗传背景下的表型。该试验获得了与向日葵 Or5 抗列当紧密连锁的分子标记 ORS1036,在 F2群体中进行了验证,表型结果和分子检测结果的吻合率为94%,可能是由于ORS1036这个标记与 Or5 基因连锁不是很紧密,有些材料抗病,但是未扩增出特异条带,因此期待能开发出更加精准的SSR标记或者SNP标记,为今后进行抗列当种质创新及新品种选育提供了高效的技术支持。
参考文献
[1] 何付丽,黄长权,尹克鑫,等.向日葵列当萌发机理的研究[J].作物杂志,2012(6):105-110.
[2] ANTONOVA T S,ARASLANOVA N M,STRELNIKOV E A,et al.Distribution of highly virulent races of sunflower broomrape ( Orobanche cumana Wallr.) in the southern regions of the Russian Federation[J].Russ Agric Sci,2013,39(1):46-50.
[3] RODRGUEZOJEDA M I,FERNNDEZMARTíNEZ J M,VELASCO L,et al.Extent of crossfertilization in Orobanche cumana Wallr.[J].Biol Plant,2013,57(3):559-562.
[4] 赵刚,段维,侯东生,等.向日葵列当的生物学特性及防治技术研究[J].安徽农业科学,2015,43(12):123-124.
[5] BCHVAROVA R.Investigating the diversity and pathogenicity of sunflower broomrapes from five sources[J].Rastenievudni nauki,1978,15:164-169.
[6] BCHVAROVA R.Physiological specialization in broomrape ( Orobanche cernua Wall.) and the resistance of inbred sunflower lines[J].Rastenievudn nauki,1979,17:127-132.
[7] 石必显,雷中华,向理军,等.中国4省区向日葵列当生理小种鉴定[J].中国油料作物学报,2016,38(1):116-119.
[8] 王鹏,李万云,刘胜利,等.列当生理小种和向日葵抗列当种质选育进展[J].作物杂志,2014(4):10-16.
[9] TANG S X,HEESACKER A,KISHORE V K,et al.Genetic mapping of the Or5 gene for resistance to Orobanche race E in sunflower[J].Crop Sci,2003,43(3):1021-1028.
[10] PREZVICH B,AKTOUCH B,MATEOS A,et al.Dominance relationships for genes conferring resistance to broomrape ( Orobanche cumana Wallr.) in sunflower[J].Helia,2004,27(40):183-192.
[11] LU Y H,MELEROVARA J M, GARCATEJADA J A,et al.Development of SCAR markers linked to the gene Or5 conferring resistance to broomrape ( Orobanche cumana Wallr.) in sunflower[J].Theor Apply Genet,2000,100(3/4):625-632.
[12] IMEROVSKI I,DIMITRIJEVIC A,MILADINOVIC D,et al.Identification of PCR markers linked to different Or genes in sunflower [J].Plant Breed,2013,132(1):115-120.
[13] 牛慶杰,于学鹏,李慧英,等.向日葵抗列当材料的实验室鉴定方法[J].吉林农业科学,2010,35(1):21-22.
[14] RADWAN O,GANDHI S,HEESACKER A,et al.Genetic diversity and genomic distribution of homologs encoding NBS-LRR disease resistance proteins in sunflower[J].Mol Genet Genom,2008,280(2):111-125.
[15] FERNNDEZMARTNEZ J M,VELASCO L,PREZVICH B.Progress in research on breeding for resistance to sunflower broomrape[J].Helia,2012,35(57):47-56.

