载脂蛋白C1在甲状腺乳头状癌中的临床表达及生物信息学分析
李超友,罗亚星,孙新民,薛刚,吴靖芳
(河北北方学院 1.耳鼻咽喉头颈外科; 2.组织胚胎学教研室,河北 张家口 075000)
甲状腺癌是头颈部肿瘤中最为常见的内分泌性肿瘤之一,其发病率和死亡率逐年升高[1]。甲状腺乳头状癌(thyroid papillary carcinoma,PTC)作为甲状腺癌最常见的病理分型,女性的发病率比男性高出3倍左右[2]。虽然PTC恶性程度低、手术效果好,但伴随颈淋巴结转移或远处转移的PTC患者通常预后较差,约10%~15%PTC患者可演变为致命的复发性疾病[3-4]。目前PTC具体分子发病机制,尤其是特定基因对PTC的免疫调节机制尚不明确[5]。有学者指出, PTC的进程伴随着巨噬细胞和T淋巴细胞介导的免疫调节和癌细胞免疫浸润;免疫调节蛋白如细胞程序性死亡-配体1(programmedcell death ligand1,PDL1)、PDL2、程序性死亡受体1(programmed death receptor1,PD1)、淋巴细胞活化基因-3(lymphocyte activation gene-3,LAG-3)和T细胞免疫球蛋白黏蛋白分子3(T cell immunoglobulin and mucin-containing molecule 3,TIM-3)均在PTC中异常表达[6]。
载脂蛋白C1(apolipoprotein C1,APOC1)是载脂蛋白C家族的成员之一,主要表达于肝脏,可参与高密度脂蛋白(high-density lipoprotein, HDL)和极低密度脂蛋白(very low-density lipoprotein, VLDL)的代谢,并且在单核细胞向巨噬细胞分化时被激活[7]。另有研究指出,因APOC1蛋白N端序列与一种可以抑制胆固醇酯转移蛋白的多肽的序列相似,使其在血浆中具有抑制HDL向低密度脂蛋白(lowdensity lipoprotein,LDL)的转变作用。既往研究表明,APOC1与阿尔茨海默病、肾小球硬化、1型或2型糖尿病等多种疾病的进展有关[8-9]。此外,APOC1在乳腺癌、结直肠癌、肾癌和肺癌中出现异常表达并调控其进展[10-13]。然而,APOC1在PTC中的作用尚未阐明。
1 资料与方法
1.1 UALCAN数据库挖掘
基于TCGA数据库的UALCAN分析网站可以在线分析31种常见癌症的临床数据,获得特定基因在不同组织中的表达情况。还可以分析基因生存情况和甲基化水平[14]。本研究数据下载自UALCAN网站,并用GraphPad Prism 7软件重新可视化,分析PTC样本与正常组织中APOC1的mRNA水平差异,分析APOC1的表达在不同临床阶段、年龄、性别、淋巴结转移中的差异及意义。
1.2 Kaplan-Meier Plotter 数据库挖掘
Kaplan-Meier数据库整合了TCGA数据库和GEO数据库中的数据,可以为常见癌症的mRNA、miRNA、蛋白和DNA提供生存分析[15]。本实验使用Kaplan-Meier数据库对TCGA数据库中502例PTC患者APOC1的总生存期(overall survival, OS) 和无复发生存期(relapse-free survival, RFS) 进行了分析。
1.3 HPA数据库和TIMER数据库挖掘
HPA(the human protein atlas)是一个基于组织学技术观察目标蛋白在特定组织中表达情况的数据库。TIMER数据库是基于TCGA数据库根据其独特算法对特定基因进行免疫细胞浸润分析的网站[16]。本实验中,我们通过HPA探索了APOC1在PTC与PC组织中的表达情况,并且通过TIMER数据库分析了在PTC中APOC1与常见免疫细胞的相关性。
1.4 Linked Omics 数据库和GeneMANIA数据库挖掘
Linked Omics数据库通过收集多组学数据完成了对32种癌症数据的整合,可以提供基因表达、甲基化、miRNA相关性分析等多种分析[17]。GeneMANIA数据库可以预测基因的功能并且根据基因功能的优先程度建立蛋白-蛋白相互作用网络[18]。通过Linked Omics数据库分析了与APOC1基因密切相关的Top-50基因,并把与APOC1基因前4正相关的基因作为关键基因,进而利用GeneMANIA数据库分析了APOC1、APOE、APOC1P1、APOC4和FBXW8之间的蛋白-蛋白相互作用网络。
1.5 GSCALite数据库挖掘
GSCALite网站是一个可用于分析基因表达,甲基化,单核苷酸变异,途径活性和药物靶标的多组学数据库[19]。使用GSCALite数据库对PTC中APOC1、APOE、APOC1P1、APOC4和FBXW8的药物靶标和癌症相关通路进行了分析。
1.6 GSEA软件分析
GSEA是一种基于基因集的富集分析方法,根据基因表达数据与表型的相关性对基因的功能进行富集分析。本实验对APOC1基因进行单基因GSEA 分析,以FDR<0.05为标准筛选富集结果。
1.7 统计学分析
UALCAN数据库中APOC1 mRNA 表达差异采用t检验或单因素方差分析;Kaplan-Meier生存采用Log-rank 检验;与APOC1具有正、负相关共表达的基因采用Pearson 相关性分析。所有数据库分析P<0.05为差异具有统计学意义。
2 结果
2.1 APOC1 mRNA 在PTC和PC组织中的表达
利用UALCAN数据库比较APOC1 mRNA在PTC和癌旁(para carcinoma,PC)组织中的表达差异,如图1A所示:PTC组织中APOC1 mRNA表达水平显著高于PC组织。并且APOC1免疫组织化学染色结果与UALCAN数据库结果一致(图1B)。异常高表达的APOC1初步可以作为诊断PTC的潜在生物学标志物。
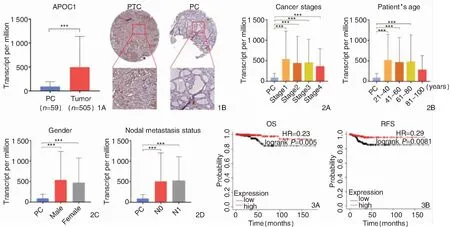
图1 APOC1 mRNA 在PTC和PC组织中的表达 1A: UALCAN数据库中的表达量比较; 1B: 免疫组织化学染色结果 (×100) 图2 APOC1 mRNA的表达与临床病理参数 2A: APOC1 mRNA的表达; 2B: APOC1 mRNA的表达与年龄; 2C: APOC1 mRNA 的表达与性别; 2D: APOC1 mRNA的表达与淋巴结转移 图3 APOC1 mRNA 表达与PTC患者预后的关系 3A: APOC1 mRNA 表达水平与OS的关系; 3B: APOC1 mRNA 表达水平与RFS的关系
2.2 甲状腺癌组织中不同影响因素对APOC1表达的影响
比较不同临床分期、年龄、性别、淋巴结转移情况下PTC组织与PC组织APOC1的表达显示如图2A~D:APOC1 mRNA水平在临床I~IV期PTC患者显著高于PC组织;21~40岁、41~60岁、61~80岁、81~100岁年龄组均高于PC组织、男性和女性患者APOC1 mRNA水平均高于PC组织;N0、N1期淋巴结转移中显著高于PC组织,P<0.001。提示PTC中APOC1 mRNA的异常表达与癌症进程有关,有望成为阻断PTC发展的药物靶点。
2.3 PTC组织中APOC1 mRNA 的表达与预后、免疫细胞的关系
通过Kaplan-Meier数据库对APOC1 mRNA 表达与PTC患者预后的关系分析,如图3所示:低表达APOC1 mRNA与更差的OS (P=0.005,图3A) 和RFS(P=0.0081,图3B) 显著相关。TIMER数据库对APOC1与常见免疫细胞的关联性分析如图4所示:PTC中APOC1与B细胞 (Cor=0.287,P<0.05), CD8+T细胞(Cor=0.161,P<0.05), CD4+T细胞(Cor=0.128,P<0.05),巨噬细胞(Cor=0.186,P<0.05), 中性粒细胞(Cor=0.345,P<0.05)和树突细胞(Cor=0.349,P<0.05)均呈正相关。
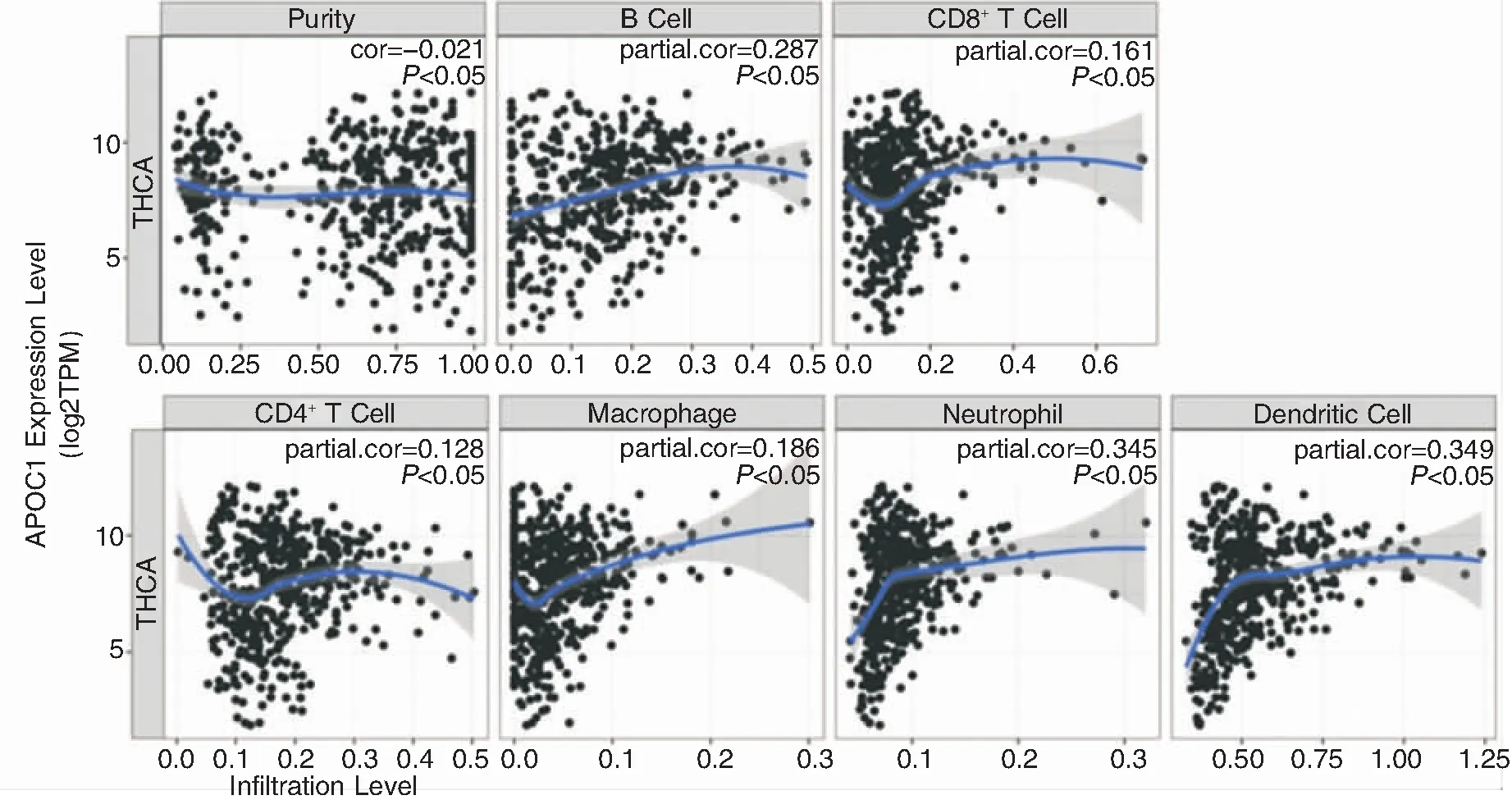
图4 APOC1 mRNA与常见免疫细胞相关性分析
2.4 PTC中APOC1的共表达基因分析
为了从分子层面上揭示PTC的发生机制,我们通过LinkedOmics数据库分析了与APOC1相关正、负相关的前50个基因(图5),并把APOC1基因连同与其最显著正相关的基因(APOE、APOC1P1、APOC4和FBXW8)作为关键基因。为明确这5个关键基因之间存在潜在联系,本实验通过GeneMANIA网站分析了APOC1、APOE、APOC1P1、APOC4和FBXW8之间的蛋白-蛋白互作网络(图6)。
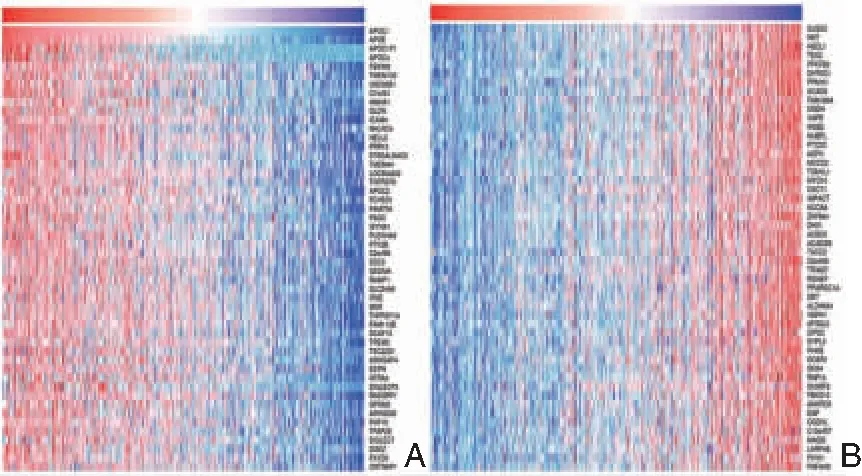
图5 APOC1的共表达基因 A: APOC1的正相关基因; B: APOC1的负相关基因
2.5 APOC1对癌症相关通路及调节药物的影响
对5个关键基因的癌症相关通路进行了分析,APOC1可以激活EMT、Hormone ER、Hormone AR、DNA Damage Response、Cell Cycle、Apoptosis信号通路,抑制 PI3K/AKT、RAS/MAPK、TSC/mTOR和RTK信号通路。并且APOC1可以被一些小分子药物或肽(abiraterone、GSK-J4、SR8278)抑制。见图6。
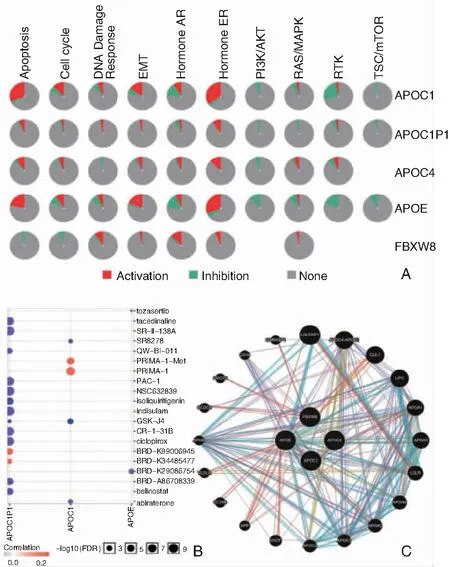
图6 APOC1基因作用分子机制 A: APOC1参与的主要癌症相关通路; B:调节关键基因的药物; C:关键基因的蛋白蛋白互作网络
2.6 GSEA对APOC1基因的功能富集分析
如表1与图7所示:APOC1在PTC中的GSEA分析富集到以下与癌症相关通路:丙酸代谢、缬氨酸和异亮氨酸、三羧酸循环、牛磺酸代谢、JAK-STAT信号通路、自身免疫性甲状腺病、凋亡、癌症信号通路、NOTCH信号通路、MAPK信号通路(P<0.05)。
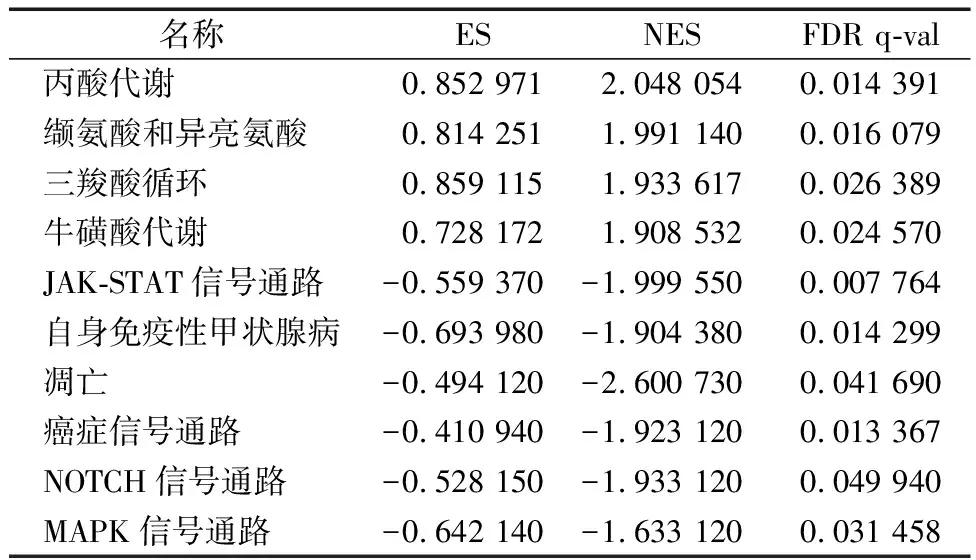
表1 GSEA 分析结果中前10位富集的通路

3 讨论
本研究通过使用UALCAN数据库比较PTC组织和PC组织中APOC1的表达水平,发现与PC组织相比,其在PTC中的表达水平出现异常增高。进一步研究发现,APOC1对PTC患者的预后有指示价值,低表达APOC1 mRNA与更差的OS和RFS显著相关。这些都提示出APOC1可能对PTC中具有诊断价值和治疗价值。为了进一步研究APOC1基因在PTC中进展中的作用,接下对不同临床分期(Ⅰ~Ⅳ)、年龄、性别、有无淋巴结转移情况下APOC1的表达情况进行了分析。结果表明,相比于PC组织,APOC1在不同临床分期、年龄、性别、伴随淋巴结转移时显著升高,这些结果表明,PTC中APOC1 mRNA的异常表达与癌症进程有关,有望成为阻断PTC发展的药物靶点。有学者指出APOC1可在体外促进前列腺癌细胞中的细胞增殖[20]。并且小细胞肾癌中,APOC1具有诊断和预后的价值[11]。监于上述结果都是通过生物信息学从mRNA水平的分析,为了在蛋白水平验证数据库分析的结果,我们使用HPA数据库从组织水平上对APOC1在PTC及PC组织中的表达水平。结果所示,APOC1免疫组织化学染色结果与UALCAN数据库结果一致。所以,APOC1可能参与了PTC的发生、发展。
随着对肿瘤免疫细胞浸润的全面深入研究,免疫逃逸目前被认为是肿瘤发生发展的重要机制之一。有学者指出,免疫细胞浸润在肿瘤的进展和转移中起着重要作用,可以从多方面影响患者的预后[21]。为了进一步明确APOC1对PTC可能的调节作用,首先研究了APOC1与免疫细胞的相关性。本实验对APOC1与常见免疫细胞的相关性分析显示:在PTC中APOC1与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突细胞均呈正相关,提示APOC1基因可能参与了PTC细胞的免疫浸润调节,以增加癌细胞免疫逃逸,加大了癌细胞侵袭的风险。另外,已有文献指出胆固醇的异常代谢参与了癌症的发生[22]。Liu等[23]认为胆固醇可通过诱导KLF5的表达,降低FBXW7的表达来显著促进肾癌细胞增殖、侵袭和迁移的能力。而作为脂蛋白之间的可交换载脂蛋白,APOC1存在于乳糜微粒,VLDL和HDL中,可以直接调节胆固醇水平。APOC1调节胆固醇代谢可能是一种新颖的治疗方法。
另外,考虑到癌症的发生机制是一个多分子共同作用的复杂过程,本研究把APOC1和与其前4个正相关的基因作为关键基因,构建了蛋白蛋白互作网络,并且研究了这5个基因可能参与的相关癌症通路。如结果所示,这5个基因在不同程度上参与了EMT、Hormone ER、Hormone AR、DNA Damage Response、Cell Cycle、Apoptosis信号通路,PI3K/AKT信号通路, RAS/MAPK信号通路, TSC/mTOR信号通路和RTK信号通路的调节。再者,考虑到这5个基因,特别是APOC1可能作为潜在治疗PTC的药物靶点,我们对数据库调查显示abiraterone,GSK-J4,SR8278可以作为抑制APOC1的药物。最后,为了明确APOC1对PTC作用的具体机制,进行了单基因GSEA功能富集分析显示:APOC1基因的功能主要富集在丙酸代谢、缬氨酸和异亮氨酸、三羧酸循环、牛磺酸代谢、JAK-STAT信号通路、自身免疫性甲状腺病、凋亡、癌症信号通路、NOTCH信号通路、MAPK信号通路上。Ren等[12]指出在大肠癌中APOC1可以通过MAPK信号通路传导发挥其增殖活性。而在胰腺癌细胞中MAPK信号通路可以抑制凋亡的发生[24],与我们的部分研究结果一致。综上所述,APOC1也许可用作为PTC的潜在诊断标记和药物靶点,并且结合胆固醇阻断癌症进展,为临床治疗提供了新的思路。

