成都市气温与PM2.5和O3交互作用对疾病死亡人数的影响研究
张 莹,辛金元,马 盼,冯鑫媛,张小玲,3,王式功,张家熙,冯虹玫,郑灿军 (.成都信息工程大学大气科学学院,高原大气与环境四川省重点实验室,气象环境与健康研究院,四川 成都 60225;2.中国科学院大气物理研究所,大气边界层物理和大气化学国家重点实验室,北京 00029;3.北京城市气象研究院,京津冀环境气象预报预警中心,北京 00089;.中国疾病预防控制中心,北京 02206)
四川盆地作为我国五大重污染区域之一,近几年,以细粒子、臭氧污染为主要特征的区域持续性重空气污染发生频次明显增加.自《大气十条》实施以来,当地政府及环保部门采取了多方面强有力措施,使得当地空气质量持续改善,但现阶段四川盆地大气复合污染形势依然严峻[1],具体表现在近年来冬季雾霾超标显著、夏季臭氧污染持续增加,区域空气质量管理与控制已经进入了雾霾和臭氧协同防治的深水区,与公众对空气质量改善的期盼还有差距[2].与此同时,受大气污染的影响,呼吸系统疾病、心脑血管疾病及癌症发病率及死亡率逐年升高[3].2015年全球疾病负担评估报告指出:PM2.5已成为全球第五大致死风险因素,长期暴露于PM2.5造成420万人死亡,O3位于第34,长期暴露于O3造成25万人死亡[4].我国因空气污染所致的人均死亡率居世界前列[5],空气污染对人群健康的不利影响,已引起了我国政府、公众及学者们的广泛关注[6].
已有研究指出 PM2.5对呼吸和心脑血管等系统疾病的急诊就诊、住院和死亡人数均有显著影响,即使低浓度的 PM2.5也会对人群健康产生不利影响[7-11].毒理学研究也证实了 PM2.5可随呼吸进入肺部,对呼吸道产生损伤,并造成肺部及全身性炎症;沉积在血管部分的PM2.5可进入血液循环过程,导致心脑血管系统损伤等[12].此外,O3是一种具有强氧化性的气体,也会对人体造成不良的健康效应[13],与细粒子相比,关于 O3健康效应的研究在我国起步相对较晚,现有的大部分研究结果主要来自欧美国家[14-16],我国 O3暴露对人群健康效应影响的流行病学研究还十分有限[17].
现阶段关于成都市污染物对当地人群健康影响的研究相对较少,覃芳葵等[18]率先开展了 PM2.5质量浓度与呼吸和心脑血管疾病急救人次的关联,曾婕[19]评估了由 PM2.5导致的当地老年人超额死亡风险,关于当地O3健康效应的相关研究还鲜有报道.污染的发生是长期大气污染物过量排放与特殊气象条件共同作用的产物,其对人群健康的影响也体现出其长期慢性影响和短期急性危害共存、污染和气象因素交互作用的复杂特点.我国其它几个大气重污染区关于污染物与气温协同作用对人群健康影响尚处于摸索阶段[20],成都地区也亟待开展该方面的研究.
基于此,本研究采用国际上通用的流行病学统计模型—基于时间序列的分布滞后非线性模型(Distributed Lag Non-linear Model, DLNM)和广义相加模型(Generalized Additive Models, GAMs)相结合,以呼吸和心脑血管疾病死亡数据为健康效应指标,选取人口密度大、PM2.5和O3污染重的成都作为代表,从环境医学与医疗气象相结合的角度,开展气温、污染物(PM2.5或O3)单因素及其二者交互作用分别对当地人群呼吸系统和心脑血管疾病死亡的影响研究,由此揭示双重因素协同致病的成因,对于保护当地居民健康具有重要的科学价值和现实意义,也为当地有效开展空气污染的健康风险评估和制定人群健康促进策略提供科学依据.
1 资料与方法
1.1 资料来源
1.1.1 疾病资料数据 2014年1月1日~2016年12月31日成都市疾病死亡资料来源于中国疾病预防控制中心(CDC)全国疾病监测系统死因监测数据集,首先根据患者家庭住址信息剔除非成都市居住的人群资料,以确保研究对象均为成都市常住人口;其次,根据国际疾病分类标准第10版(ICD-10)[21]对病例资料进行分类整理,提取呼吸系统疾病(ICD-10编码: J00-J99)和心脑血管疾病(ICD-10 编码:I00-I99)死亡人数资料,最终分别收集到呼吸系统和心脑血管疾病死亡病例59676例和76721例.
1.1.2 大气环境监测资料 同期的污染物数据来源于中华人民共和国生态环境部,包括PM2.5日均浓度和每日臭氧最大8h平均浓度(采用O3表示).
1.1.3 气象资料来源 同期的气象资料来源于中国气象科学数据共享服务网,为日常监测收集的成都市气象数据资料,主要包括日平均气温(℃)、相对湿度(%)和日平均风速(m/s)等,气象数据资料已经过国家气象信息中心严格的质量控制,经检查无缺测.
1.2 研究方法
利用R软件(4.0.3版本)中的“dlnm”和“mgcv”程序包进行分布滞后模型(DLNM)和广义相加模型(GAMs)建模.气温与疾病死亡的关联呈非线性,且气温对人群健康的影响存在较长的滞后和累积效应,采用 DLNM 拟合气温的“交叉基”函数,确定气温的最大滞后时间,更好地捕获气温对疾病死亡影响的滞后效应和累积效应[22].GAMs作为国际上通用的流行病学健康效应评估模型,是对气象要素及污染物等环境因素健康影响的独立效应及交互效应进行非线性回归分析的一种较为灵活有效的方法.本研究采用的GAMs包含了独立效应模型、非参数二元响应模型和气温分层模型共三个模型.首先,通过独立效应模型分析气温、PM2.5或 O3的单独效应;其次,采用非参二元响应模型和气温分层模型相结合,来探究气温与PM2.5(或O3)交互作用对疾病死亡风险的影响,其具体步骤如下.
第一步,采用GAMs的独立效应模型估算气温、PM2.5和O3分别对当地呼吸和心脑血管疾病死亡人数影响的独立效应.此处以 O3对成都市心脑血管疾病死亡的影响为例建模,即以心脑血管疾病逐日死亡人数为响应变量,在控制时间的长期趋势、周末效应、节假日效应以及气温的影响后,探讨 O3浓度变化对心脑血管疾病死亡人数的影响,该模型如下:

式中:Yt为第t日心脑血管疾病死亡人数;E(Yt|X)为第t日心脑血管疾病死亡人数的期望值;星期效应和节假日效应分别以哑变量(DOW)和(Holiday)形式纳入模型;随后采用自然立方样条函数 NS()拟合非线性参数,其中包括时间序列(Time)、相对湿度(RH)和平均风速(Wind).T表示日均气温,basis.T表示由DLNM 构建的气温的“交叉基”函数;本团队前期的研究结果已表明成都市气温对当地呼吸和心脑血管疾病死亡影响的最大滞后时间为 21d[23],因此在本研究中气温的最长滞后时间定为 21d,根据AIC(Akaike information criterion)准则确定各参数的自由度(df);α为残差.前人研究表明污染物与疾病死亡的关系近似呈线性[23],本研究将O3以线性形式拟合进模型,由于污染物之间存在较强的共线性,因此,本研究中仅考虑单污染物效应模型,即在研究 O3健康效应的时候,模型仅纳入污染物 O3,而不将其它污染物作为混杂效应纳入模型.同时,考虑到污染物对疾病死亡人数的影响可能存在滞后效应,因此,分别拟合 O3单滞后天数(当天的污染物浓度以及 1~4d前的污染物浓度,依次记为 lag0、lag1、lag2、lag3和 lag4)和累积滞后天数(当天的污染物浓度与前1~4d污染物浓度平均,依次记为lag01、lag02、lag03和lag04)与疾病死亡人数的关系,从而确定对疾病死亡风险最大的滞后天数.本文中lag01的PM2.5和O3健康效应均最显著(结果分析部分),因此,在后续的研究中均使用lag01的PM2.5和O3作为研究对象.
由于不同季节污染物浓度差异较大,在上述研究的基础上,本研究进一步分季节(春季:3~5月;夏季:6~8月;秋季:9~11月;冬季:12~翌年2月)探讨不同季节 PM2.5(或 O3)浓度变化对两种疾病死亡人数的影响.
第二步,在上述污染物独立效应研究的基础上,通过建立非参数二元响应模型,直观给出平均气温与 PM2.5(或 O3)交互作用对疾病死亡人数影响的三维空间图,定性分析平均气温与污染物交互作用对人群健康的风险,以日均气温与O3交互作用为例,具体模型如下:

式中:ST为薄板样条函数(thin-plate spline),COVs同模型(1)中.
第三步,以第一步气温-疾病死亡独立效应给出的气温-疾病死亡曲线关系为基础,找出温度阈值,在此基础上,进一步构建温度分层模型,定量分析不同温度层内污染物(PM2.5或 O3)对疾病死亡的健康风险.具体公式如下:

式中:β1表示在温度层 k内污染物(PM2.5或 O3)对疾病死亡影响的单效应回归系数; β2表示气温对疾病死亡影响的单效应回归系数;β3表示气温和污染物共同作用对疾病死亡影响的回归系数;COVs同模型(1)中.
根据模型(1)估算出的回归系数β和标准差SE,从而对污染物的健康效应做出定量评价.当 PM2.5(或O3)浓度每升高10μg/m3时,通过估算居民每日死亡人数的相对危险度(RR)和超额增加百分比(ER%)及其95%置信区间(95% Confidence Interval, 95%CI)来表示 PM2.5(或 O3)的健康风险,其中 RR、ER 及ER%(95%CI)计算公式见式(4)~(6):

2 结果与分析
2.1 统计分析
由表1可知,2014~2016年成都市呼吸系统和心脑血管疾病日均死亡人数分别为(54±16)例和(70±15)例.成都属于亚热带季风性湿润气候,气候温和,研究时段内,成都市日均气温为(16.6±7.2)℃,变幅为-1.9~29.8℃;日均相对湿度为(81.7±8.2)%,变幅为 42.0~98.0%;日 均 风 速 为(1.3±0.5)m/s,变 幅 为0.3~3.4m/s.此外,研究时段内,成都市 PM2.5和 O3年均浓度分别为(65.4±44.2)μg/m3和(119.9±60.6)μg/m3,PM2.5日均变幅为 10.7~426.4μg/m3,O3日均变幅为 13.2~331.1μg/m3,两种污染物日均浓度变幅范围均较大.且 PM2.5和 O3两种污染物年均浓度均超过世界卫生组织(WHO)颁布的《空气质量准则》[24]的标准 10μg/m3和 100μg/m3.
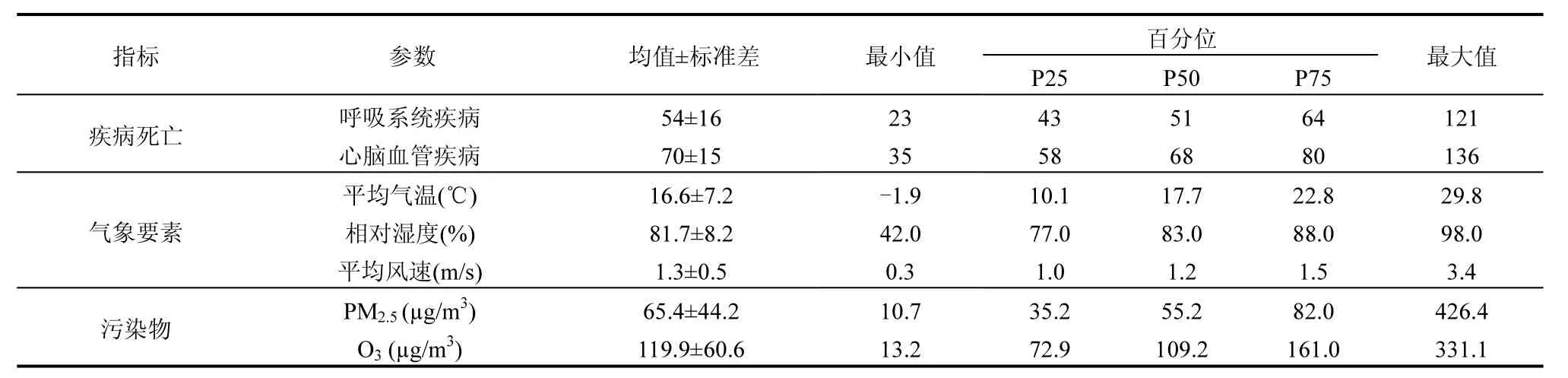
表1 2014~2016年成都市相关疾病死亡人数、气象要素及污染物的描述性分析Table 1 Descriptive statistics on daily mortality, meteorological variables, and air pollutants levels in Chengdu during 2014~2016
2.2 气温变化对疾病死亡风险的影响
由图 1可知,气温与两种疾病死亡人数的累积暴露-反应关系均呈反“J”型分布,最适温度为22.2℃,此时,气温对疾病死亡影响的风险最小.以 22.2℃为临界值,随着气温的进一步升高(或降低),气温对疾病死亡的风险均呈增加趋势,即气温过高或过低均会导致两种疾病死亡人数的增加.

图1 2014~2016年成都市平均气温分别与呼吸和心脑血管疾病死亡人数的累积暴露-反应关系Fig.1 Cumulative exposure-response association of mean temperature with respiratory and cardiovascular mortality in Chengdu 2014~2016
2.3 PM2.5和O3分别对疾病死亡风险的影响
2.3.1 不同滞后时间条件下污染物对疾病死亡风险的影响 污染物对人群健康的影响也存在短时间的滞后和累积效应,由图 2可知,两种污染物对呼吸和心脑血管疾病死亡的影响均在累积滞后1d(lag01)的情况下最为显著.因此,在后续研究中均以lag01的PM2.5和 O3作为研究对象.经计算,lag01的 PM2.5浓度每升高 10μg/m3,呼吸系统和心脑血管疾病死亡风险分别增加0.58% (95%CI: 0.29, 0.88)和0.35% (95%CI: 0.14, 0.56);lag01的O3浓度每升高10μg/m3,呼吸系统和心脑血管疾病死亡风险分别增加0.54% (95%CI: 0.25, 0.83)和0.66% (95%CI: 0.42,0.90).

图2 不同时间滞后条件下(单滞后 lag0~lag4 和累积滞后lag01~lag04)PM2.5和O3浓度变化导致的呼吸和心脑血管疾病超额死亡风险Fig.2 Excess risk of respiratory and cardiovascular mortality associated with PM2.5 and O3 at single lag 0~4days and cumulative lag 01~04days
2.3.2 不同季节污染物对疾病死亡风险的影响 图 3为不同季节两种污染物(PM2.5或 O3)分别对呼吸和心脑血管疾病死亡风险的影响效应.由图可知,PM2.5对呼吸和心脑血管疾病死亡人数的影响在冬季最为显著,冬季PM2.5浓度每升高10μg/m3,呼吸和心脑血管疾病死亡风险分别增加 0.63%(95%CI: 0.36, 0.91)和 0.37% (95%CI: 0.16, 0.58),而其他季节均不显著.就O3季节效应而言,O3对呼吸和心脑血管疾病死亡人数的影响在春秋季节较为显著,均有统计学意义(P<0.05),秋季尤为显著,秋季 O3浓度每升高10μg/m3,呼吸和心脑血管疾病死亡风险分别增加 0.56% (95%CI: 0.22, 0.90)和 0.69%(95%CI: 0.42, 0.97),而冬季不显著.

图3 不同季节PM2.5和O3浓度变化导致的呼吸和心脑血管疾病超额死亡风险Fig.3 Excess risk of respiratory and cardiovascular mortality associated with PM2.5 and O3 at different season
2.4 气温与PM2.5(或O3)交互作用对疾病死亡风险的影响
如图4所示,气温与PM2.5(或O3)交互作用对呼吸和心脑血管疾病死亡风险的影响差异较大,值得注意的是,高温与高浓度PM2.5(或O3)共存的情况下,呼吸系统和心脑血管疾病死亡人数均达到最大,即高温与高浓度 PM2.5(或 O3)对呼吸和心脑血管疾病死亡人数的影响存在协同加强效应.
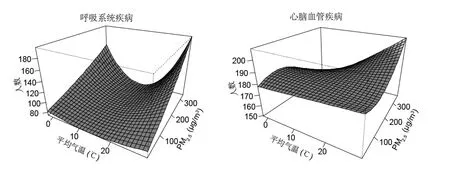

图4 2014~2016 年成都市日均气温与PM2.5或(O3)交互作用对呼吸和心脑血管疾病死亡人数影响的平滑曲面图Fig.4 Bivariate response surfaces of mean temperature and PM2.5 (or O3) for respiratory and cardiovascular mortality in Chengdu during 2014~2016
在上述定性研究气温和 PM2.5(或 O3)交互效应对两种疾病死亡人数影响的基础上,进一步采用温度分层模型,分析气温与PM2.5(或O3)交互作用对两种疾病死亡风险的定量效应.依据气温-疾病死亡的累积暴露反应-关系图(图 1),以 22.2℃为温度阈值,将气温划分为相对高温(>22.2℃)和低温(<22.2℃)两部分,继而分析不同温度条件下,PM2.5和 O3浓度变化对两种疾病死亡的影响效应(表2).由表2可知,高温段污染物的健康效应均高于低温段,且强于独立效应模型中污染物的健康效应.

表2 不同温度水平下PM2.5和O3浓度变化对疾病死亡的影响Table 2 Excess risk in respiratory and cardiovascular mortality with 10ug/m3 increases in PM2.5 and O3 across different temperature levels
3 讨论
3.1 污染物单效应讨论
国内外关于气温及污染物对相关疾病发病率/死亡率的独立效应研究已有很多,但不同区域研究结果差异较大[6,10].就气温而言,成都市气温与两种疾病死亡人数均呈反“J”型分布特征,即冷效应的健康风险大于热效应,主要原因在于高温和低温对人群健康影响的效应不同,高温表现为急性效应,热效应往往在高温发生的当天较强,之后迅速降低;而低温效应在发生当天并不是最强的,随着时间的滞后冷效应开始显现,且持续时间远长于高温,较长的滞后时间从而导致冷效应累积的健康风险较高,即“高温效应即时,低温效应滞后”[10].此外,本研究中成都市最适宜温度为 22.2℃,这与其它城市的最适宜温度存在一定的差异,Yang等[25]采用DLNM模型对我国多个城市的心脑血管疾病死亡人数与气温的关联进行了研究,结果表明哈尔滨、沈阳、长沙和广州市最适宜温度分别为 20.6℃、21.5℃、25.1℃和26.5℃,这说明高温的南方地区最适宜温度要比寒冷的北方地区高.
本研究针对成都市两种污染物(PM2.5和 O3)分别与呼吸和心脑血管疾病死亡人数的关联进行了研究,发现两种污染物均与呼吸和心脑血管疾病死亡存在显著关联,研究时段内 PM2.5(lag01)浓度每升高10μg/m3,对应的呼吸和心脑血管疾病死亡风险分别增加0.58%和0.35%,O3浓度每升高10μg/m3,对应的呼吸和心脑血管疾病死亡风险分别增加0.54%和0.66%,且均有统计学意义(P<0.05).这与前人研究结果较为接近,Shang等[26]对中国城市PM2.5健康风险的 Meta分析研究结果显示 PM2.5浓度每增加10μg/m3,呼吸系统和心血管系统疾病死亡率分别增加0.51%和0.44%.刘涛等[27]对我国珠三角地区部分城市O3对居民死亡风险的Meta分析研究结果显示O3浓度每增加 10μg/m3,该地区居民死亡风险增加0.35%.叶伟鹏等[28]对我国 O3短期暴露于人群死亡之间关系的Meta分析结果表明,大气中O3浓度每增加10μg/m3,呼吸系统疾病死亡率增加0.67%.
分季节研究结果表明,成都市 PM2.5和 O3浓度变化对人群健康的影响存在明显的季节差异.就PM2.5而言,PM2.5浓度与呼吸系统和心血管系统疾病死亡风险的关系仅在冬季显著相关,而其他季节均不显著.经统计,研究时段内春、夏、秋、冬四季的 PM2.5浓度依次为 64.55、40.54、52.69和104.32μg/m3,成都地区冬季PM2.5浓度远高于其他季节,冬季出现持续雾霾污染事件较多,这是造成当地冬季 PM2.5健康风险较高的主要原因.但就 O3而言,研究时段内春、夏、秋、冬四季的 O3浓度依次为146.03、170.40、91.79和 70.26μg/m3,成都市春秋季节O3的健康风险较高,而冬夏季节的健康风险较低.这与现有的国内外研究结果存在一定差异,例如欧美部分国家的研究结果均显示暖季 O3暴露与人群死亡风险显著相关,而在寒冷季节却不显著[29-30].而香港的研究结果表明,在寒冷季节 O3暴露与当地呼吸和心血管系统疾病死亡风险均存在显著地正相关,而暖季却不显著[31].本研究中,春秋季节 O3效应强,而冬夏季节效应较弱.可能原因在于:成都属于亚热带季风性湿润气候,全年气候温和,夏季室外暴晒,人们更习惯于待在室内使用空调,从而大大减少了室外空气的暴露.而春秋季天气温和舒适,人们室外活动频繁且开窗更多,导致人们暴露于室外环境的时间较长,这可能是导致春秋季 O3健康风险较高的原因.说明在冬季预防雾霾造成的健康风险的同时,春秋季节也要关注由 O3导致的呼吸和心脑血管疾病的健康风险.
3.2 气温与污染物协同效应讨论
污染物会对人群健康产生不利影响,然而污染物及其对人群健康的危害并不是孤立存在的,往往是在特定的气象条件下发生的,因此,开展污染物与气温交互作用对人群健康影响的相关研究很有必要.本文尝试性开展了成都市气温、PM2.5(或 O3)及其二者交互作用对呼吸系统和心脑血管疾病死亡人数的影响研究.发现气温与污染物交互作用对疾病死亡人数的影响十分复杂,但值得注意的是:气温与污染物交互作用对人群健康影响风险的最大值均出现在高温与高浓度的污染物共存的条件下,与此同时,温度分层研究结果表明高温段PM2.5(或O3)对两种疾病死亡影响的健康风险均大于低温段,且大于不分层条件下PM2.5(或O3)的独立健康效应.由此说明,高温与高浓度的PM2.5(或O3)对人群健康的影响存在协同放大效应.这与 Zhang等[21]在北京的研究结果较为一致,均发现高温与高浓度的PM2.5对疾病死亡存在协同放大效应.
本团队前期开展了关于气温和 PM2.5交互作用对呼吸和心脑血管疾病的影响研究,也给出了合理的生物解释[20].目前尚无确凿的证据直接揭示气温与 O3对疾病死亡影响的协同加强效应,但生物学理论一定程度上解释了高温和 O3共同作用导致死亡率增加的可能原因.一方面,短期暴露在高温下会引起一系列生理变化,高温可刺激人体体温调节,通过增加散热维持热平衡,此时血液循环加速,加重心脏压力,同时高温使得人体排汗增加,大量的无机盐离子随之排出,导致细胞电解质紊乱和酸碱平衡失调而出现心律失常,水分的过多丢失会引起循环障碍等一系列生理反应,这一系列生理反应会导致生理压发生了改变,从而使得人体更容易受到有毒物质的入侵[32].另一方面,臭氧具有强氧化能力,对生物的粘膜具有很强的刺激性和腐蚀性[15],毒理学证据也表明臭氧可以引起肺部炎症,增加呼吸道反应,甚至导致血液流体动力学的改变等[16],从而诱发、加重呼吸和心脑血管疾病,甚至导致死亡.动物实验也表明热浪联合 O3暴露可加剧小鼠炎症反应的发生,热浪和 O3协同暴露造成比各自单独暴露更严重的心肺炎症损伤[33],据此可以推测两者联合暴露对人群健康的影响可能存在一定的交互作用.
本研究存在一定的局限性和不足之处,首先,由于污染物之间存在较高的共线性,因此本研究仅使用了单污染物模型,而未使用多污染物混合模型,可能导致结果存在一定偏倚,后续还需进一步深入探讨.其次,本文所用污染物数据仅来自成都市多个污染物监测站点的浓度平均值,无法代表个体实时暴露水平;与此同时,在进行疾病死亡数据资料收集时,无法判断该居民是长期在成都居住还是短时间居住,这些均会导致结果存在一定偏倚.此外,污染物对不同性别、年龄段人群的影响也存在差异,鉴于本研究所收集资料的限制,没有分性别、年龄进行更进一步细致地研究,在后续进一步收集成都市不同性别、年龄段疾病死亡资料的基础上,弥补上述研究的不足.
4 结论
4.1 成都市气温、污染物(PM2.5和O3)对呼吸系统和心脑血管疾病死亡人数有着显著影响,就平均气温和污染物单效应而言,气温与两种疾病死亡人数的暴露-反应关系均呈反“J”型分布特征.两种污染物的健康效应均在 lag01的情况下达到最大,此时,PM2.5和O3浓度每升高10μg/m3,对应的呼吸系统疾病死亡风险分别增加0.58%和0.54%,心脑血管疾病死亡风险分别增加0.35%和0.66%,且均有统计学意义(P<0.05).
4.2 就两种污染物的季节效应而言,冬季 PM2.5对呼吸和心脑血管疾病死亡影响的风险最为显著,其它季节均不显著,冬季PM2.5浓度每升高10μg/m3,呼吸和心脑血管疾病死亡风险分别增加 0.63%和0.37%;而秋季O3健康风险最为显著,此时,O3浓度每升高10μg/m3,呼吸和心脑血管疾病死亡风险分别增加0.56%和0.69%,且均有统计学意义(P<0.05).
4.3 高温段PM2.5(或O3)的健康效应明显高于低温段,即高温与高浓度PM2.5(或O3)对疾病死亡的影响存在协同加强效应,高温段 PM2.5浓度每升高10μg/m3,呼吸和心脑血管疾病死亡风险分别增加2.30%和1.09%,O3浓度每升高10μg/m3,呼吸和心脑血管疾病死亡风险分别增加1.14%和1.03%.

