光催化与生物膜直接耦合降解4-氟苯酚废水
钟兰兰,袁吉林,罗宏扬,向文浩,李林洋,肖川宝,钟年丙,2* (.重庆理工大学,光纤传感与光电检测重庆市重点实验室,重庆市现代光电检测技术与仪器重点实验室,重庆 400054;2.重庆理工大学,两江国际学院,重庆 4035)
有机氟化物由于其碳氟键的稳定性和高键能等理化性质被广泛应用于制药、合成材料、农用化合物等多个领域[1].但是,碳氟键的稳定性和高键能导致有机氟化物不易降解并造成环境污染和生物污染[2].4-FP等有机氟化物是医药、农药等多种药物的重要中间体[3-5],但是过量的氟会破坏机体钙、磷的正常代谢,抑制某些酶的活性,也可以通过食物链在体内累积[5].因此,实现4-FP等有机氟化物的高效持续降解对缓解水体污染、保护环境和生态健康具有重要意义.
目前关于 4-FP废水的降解方法主要有生物降解法[4]、光催化氧化法[5-8]、芬顿氧化法[9]、电化学法[10]、光催化-生物紧密耦合法(ICPB)[11]等.其中,ICPB法是让生物降解和光催化降解同时在同一个反应器中进行[11-14],一方面利用光催化的快速降解特性将生物毒性大的氟化物进行脱氟,并转化为结构相对简单、生物毒性相对较小的中间物质以便生物降解[11-12].另一方面,生物降解较单独光催化降解更为彻底.ICPB法突破了单独光催化降解能耗高、不彻底以及单独生物降解速度慢的局限性,在降解速度、降解程度以及能耗控制方面展现了其优越性[13-14].
虽然ICPB系统具有诸多优点,但是仍存在亟待解决的问题:当前 ICPB系统中,为了实现光催化与生物降解直接耦合,因此光催化剂与生物膜往往共用同一载体,生物膜位于多孔载体内部[16],光催化剂吸附在载体表面.用于附着生物膜和光催化剂的多孔载体主要是纤维素和海绵[11,14-15],这些载体不仅会影响光的传输,而且还会被紫外线烧焦老化[11].此外,光催化过程和微生物异养过程需要氧气参与,而传统 ICPB系统中,氧气来源于废液中的溶解氧,存在光催化和生物降解需氧竞争,导致系统整体耦合性能差、降解性能低.
为了实现4-FP快速持续地降解,本文制作了一种新型ICPB反应器.该反应器由核孔滤膜将反应器在空间上分为光催化区和生物膜区.生物膜附着在核孔膜表面.光催化区由涂覆N掺杂TiO2光催化剂的石英光纤束构成,用于实现4-FP的快速降解,其降解产物通过核孔膜传递给生物膜.生物膜实现 4-FP及其光催化产物的降解,并产生氧气;产生的氧气通过核孔膜后,传递至光催化光纤表面促进·OH 的产生,促进4-FP的快速持续降解.
1 材料与方法
1.1 材料与试剂
4-氟苯酚(99%)、氨水(25%~28%)、钛酸异丙酯(≥99.0%)、硝酸银(≥99.99%)、介孔二氧化硅(511m2/g,平均孔径 6.31nm)、乙酰丙酮(≥99.5)、Triton X-100、聚乙二醇(平均分子量 1000)、乙醇(≥99.8%)购自上海阿拉丁生化科技有限公司;无水乙醇(≥99.7%)、丙酮(≥99.5%)购自重庆川东化工(集团)有限公司;氯化铵(≥99.5%)、铁氰化钾(≥99.5%)购自成都市科龙化工试剂厂;异丙醇(≥99.5%)购自成都市科隆化学品有限公司;4-氨基安替比林(≥99.0%)购自上海科丰实业有限公司;斜生栅藻购自中国科学院水生生物研究所.
1.2 制备N掺杂TiO2(NT)涂覆光催化石英光纤
采用湿法制备锐钛矿型 NT纳米颗粒[17],然后,结合 Wang等[18]的方法制备了 NT光催化溶胶:2.375g NT粉末加入研磨钵,依次将 10mL 去离子水、2mL乙酰丙酮加入研磨钵中并研磨1-2h 得到混合溶液;将混合溶液放入超声波清洗器中超声处理10min后移至40mL无水乙醇中;向该混合溶液中加入2.5mL表面活性剂Triton X-100和0.3g聚乙二醇,连续搅拌8-12h,即得到稳定的NT光催化溶胶.
选用空心毛细石英光纤(HOFs)(内径 0.8mm,外径1.5mm,长度200mm)作为光催化剂的载体.首先,依次用丙酮、异丙醇、乙醇溶液对 HOFs进行超声清洗并在氮气下干燥;然后,将制备好的 NT光催化溶胶用提拉法涂覆在清洗后的HOFs表面;每涂覆一层溶胶之后,在温度为 60℃的干燥箱中干燥 15min,涂覆3层即得到光催化光纤样品;最后,把制得的光催化光纤样品以2℃/min的升温速度升温到400℃并煅烧2h,即得到高性能紫外-可见光催化光纤.
1.3 微藻生物膜的培养
生物膜藻种为斜生栅藻(Scenedesmus obliquus,FACHB-13),购自中国科学院武汉水生生物研究所淡水藻种库.斜生栅藻被接种到光生物反应器内之前,采用BG11培养基[19]来进行激活和扩大化培养:首先把培养所需的血清瓶及配置好的培养基放入120℃的高压灭菌锅中灭菌 20min,待冷却后,按照培养基与藻液 9:1的比例进行接种;然后将其放入光照培养箱,并将体积浓度为10%的CO2(作为栅藻所需的碳源)通过导气管导入,光照培养箱温度和光照强度分别设置 25℃和 5000lx,扩大化培养7~15d至对数生长期;得到生长活性旺盛的斜生栅藻后,取50mL藻液经培养基稀释至OD800nm=0.85,并采用盐酸或氢氧化钠将其pH值调节至8.0,随后利用蠕动泵(L100-1S-2,LONGER,中国)以3mL/min的速度通入反应器上层并循环 24h,使其在核孔膜上吸附成膜.
1.4 ICPB反应器
ICPB反应器(长140mm、宽59mm、高27mm,体积 66mL)分为光催化区和生物膜区,两个区域之间采用半透明核孔膜隔开,如图1所示.

图1 光催化-生物膜耦合反应器Fig 1. Intimately coupling photocatalysis and biodegradation reactor
生物膜区由微藻生物膜和气相空间构成,生物膜生长在核孔膜表面.光催化区由NT涂覆光催化光纤和4-FP废液构成;光催化光纤有2层,每层18根;光纤两端采用紫外-可见 LED 光源(360~380nm 光辐照度均值为 20W,400~750nm 光辐照度均值为30W)进行激发,当 NT涂覆光催化光纤受光激发后,快速降解4-FP.光催化产物及未被催化降解的4-FP通过核孔膜传递至生物膜内,被生物膜内的微生物降解;生物膜中微藻细胞光合作用产生的氧气通过核孔膜后传递至光催化光纤表面,促进·OH的生成.
1.5 4-FP降解实验
实验系统主要由光催化与生物膜耦合反应器、紫外-可见 LED光源、蠕动泵、恒温水浴等构成.恒温水浴(DCW-0530,顺马泰克,中国)用于控制废水(初始4-FP浓度为50mg/L、初始pH值8.0)的温度为(35±0.5)℃,蠕动泵流速控制在3mL/min.
单独光催化降解4-FP:核孔表面未接种微生物,光催化光纤的激发光源为 LED集成光源(360~380nm光辐照度均值为 20W,400~750nm光辐照度均值为30W).
单独生物膜降解4-FP:核孔表面接种微生物;光纤表面未涂覆任何催化剂,且光纤的激发光源为LED单色光源(400~750nm光辐照度均值为30W).
光催化与生物膜耦合降解 4-FP:核孔表面接种微生物;光纤表面涂覆有20μm的NT催化剂,且光催化光纤的激发光源为LED集成光源.
2.1.3 供试品溶液的制备 取本品粉末(过4号筛)约0.3 g,精密称定,置具塞锥形瓶中,精密加甲醇50 mL,密塞,摇匀,称定质量,放置过夜,超声处理(功率250 W,频率50 kHz)30 min,取出,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,过微孔滤膜,得到供试品溶液。
1.6 光催化光纤及生物膜表征
利用扫描电子显微镜(SEM, JSM-7800F,JEOL Ltd., Japan)对光纤和NT表面形貌进行分析.利用X射线光电子能谱 XPS (ESCALAB250Xi,Thermo Scientific,USA)和X射线衍射XRD (D/max 2500PC,Rigaku Corporation, Japan)对NT光催化剂成分进行表征.使用光谱范围 200~950nm 的光学光谱仪(AvaSpec-2048,Avantes,荷兰)和氘卤灯光源(DH-2000,Avantes,荷兰)记录了 NT涂覆光催化光纤的表面辐射光谱.
1.7 液相及气相分析
4-FP浓度的测量方法为 4-氨基安替比林分光光度法[20],利用光纤光谱仪(AvaSpec-2048,Avantes,荷兰)测量 4-FP在 507.411nm 处的吸光度来确定4-FP的残余浓度使用TOD分析仪(TOC-VCPH,岛津,日本)和0.22μm混合纤维膜过滤器对溶解有机碳(DOC)进行分析.利用Ct/ C0评估了4-FP和DOC的去除率.其中Ct和C0分别表示4-FP和DOC在t时刻的浓度以及初始浓度.
4-FP的脱氟浓度采用氟电极(PCL-1-01,雷磁,中国)进行测量.液相pH值使用梅特勒托利多320-s pH 计进行测量.溶解氧浓度(DO)采用 STARTER 400D 便携式溶解氧测定仪进行测量.温度采用光纤 Bragg光栅传感器(中心波长 1553.12nm)和光栅解调仪(SM-125,MOI,美国)进行测量.
1.8 生物量及生物多样性分析
为了准确表征微藻生物量,首先将长和宽分别为140和59mm的核孔膜在105℃干燥1h后且称量记为 m0,然后将不同培养时间条件下的核孔膜联同微藻生物膜一起取出,将附着有生物膜的核孔膜(长和宽分别为140和59mm)在105℃干燥5h后且称量记为m1,将m1-m0记为生物量;样品干重使用超微量天平(XPR6U,梅特勒托利多,瑞士)进行称量.分子16S rDNA分类分析样品来源于初始生物膜和用4-FP培养8d的生物膜.在16S rDNA基因测序之前,将样品在液氮中冷冻.生物多样性委托北京百迈客生物科技有限公司进行分析.
2 结果与讨论
2.1 NT涂覆光催化光纤表征
未经涂覆的光纤和涂覆有NT光催化剂的光纤表面形貌如图2(a)和图2(b)所示.可以看出,NT均匀地涂覆在光滑的光纤表面.从图2(c)中可以看出 NT涂覆层具有多孔结构,且 NT颗粒的平均直径为30μm.纳米颗粒构成的多孔光催化薄膜将为光催化反应提供更多的活性位点[21].

图2 光催化光纤的SEM图Fig.2 Scanning electron microscope images of photocatalytic optical hollow fiber
NT光催化的XRD图谱(图3a)中2θ= 25.26°、38.01°、48.09°、53.91°、55.07°、62.7°、68.8°、70.23°和75.09°处的9个主峰分别对应锐钛矿TiO2正方晶体的(101)、(004)、(200)、(105)、(211)、(204)、(116)、(220)和(215)反射面.图 3(b)为 NT光催化剂的 XPS图谱,其中,406.45eV为N 1s的特征吸收峰,表明NT中含有Ti-N 键; 458.25和464.1eV对应NT材料中的Ti 2p特征吸收峰峰;529.5eV对应NT中的O1s特征吸收峰峰.综合图3(a)和图3(b)表明NT光催化剂被成功制备.

图3 NT光催化材料的特性Fig.3 Properties of N-doped TiO2 photocatalyst
2.2 4-FP降解
2.2.1 单独光催化光纤降解4-FP
从图4(a)可以看出,12h内单独光催化对4-FP的去除率约为~94.3%,DOC 去除率约为~53.5%,脱氟率约为~24.7%(总 F-浓度为 0.446mmol/L).表明光催化可以快速降解 4-FP,但降解不彻底,脱氟效率低.从图 4(b)可以看出,在光催化降解 4-FP过程中不断消耗O2和OH-用于生产·OH[8].从图4c中可以看出,光催化光纤 15次循环降解 50mg/L 4-FP后,4-FP的去除率维持在94%,DOC去除率维持在53%;表明该光催化光纤可持续地降解 4-FP;其原因在于光催化剂被牢固的附着在光纤表面,且液相循环流动下光催化剂表面的活性位点未被光催化产物封锁[7].

图4 光催化降解4-FPFig.4 Photocatalytic degradation of 4-FP
2.2.2 单独生物膜降解 4-FP 从图 5(a)可以看出,第一个周期(10h)内微藻生物膜快速去除 4-FP、DOC和脱氟;其中4-FP去除率达到98.9%,DOC去除率达到 90.5%,脱氟率达到 90.9%.图 5(b)显示,在生物膜降解4-FP过程中DO先减少后增加,其原因在于生物膜中的异养微生物在降解 4-FP过程中耗氧[23],随着 4-FP的降解,光合微藻代谢产氧的速率大于细菌消耗氧气的速率,导致DO浓度增加.同时,由于 4-FP的降解和微生物代谢产生的酸性物导致液相pH值由8.0下降至6.7.
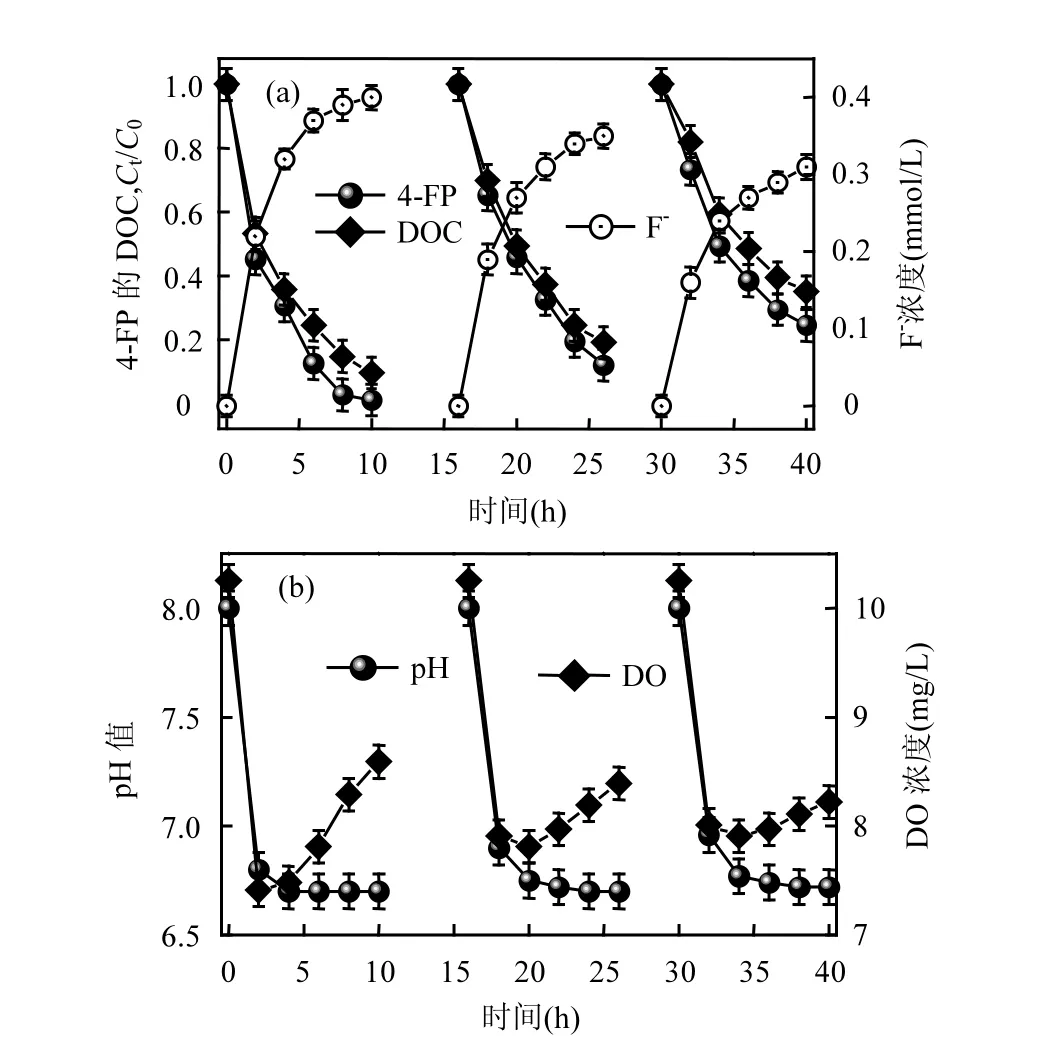
图5 单独生物膜降解4-FPFig.5 Isolated biodegradation of 4-FP by the biofilm
此外,从图5可以看出,经过3个周期的4-FP降解后,单独生物膜对4-FP的去除率、DOC的去除率及脱氟率降低,且最终 DO浓度的增量降低;其原因在于生物膜中微生物细胞代谢过程受到 4-FP毒性的影响.图5表明采用单独生物膜难以持续对4-FP进行降解.
2.2.3 ICPB降解4-FP 如图6(a)所示出,当温度为35℃,初始 pH=8.0时,ICPB 系统运行 144h(12次4-FP循环降解)后对50mg/L的4-FP完全去除时间由初始的8h缩短至5h.在5h内DOC去除率和脱氟率分别达到 89.4%和 78.3%.同时反应器运行 144h后,4-FP和DOC的去除率及脱氟率维持在恒定水平;表明随着4-FP降解周期的增加,系统将进行自适应调整并进入稳定运行.

图6 ICPB降解4-FPFig.6 ICPB degradation of 4-FP
从图6(b)可以看出,在4-FP循环降解过程中pH值的变化量恒定,且最终 DO 浓度逐渐升高,表明生物膜保持了高的生物活性.因此,采用 ICPB系统可以实现4-FP快速持续地降解.
2.3 生物分析
在光催化光纤与生物膜耦合降解4-FP中(保持图6a中的4-FP供给周期),4-FP不断转化为生物质,如图7所示.

图7 核孔膜表面的生物膜干重随4-FP供给时间变化Fig.7 Change in dry weight of the biofilms on the surface of nuclear pore membrane after grown in 4-FP
从图 7中可以看出,在光催化与生物膜耦合系统中,生物膜量持续增加,8d后生物量干重净增为166mg;表明微藻生物膜可持续地适应4-FP的毒性.其原因在于光催化及生物膜内的异养微生物(图 8)对4-FP进行了快速地降解和脱氟,降低了4-FP对生物膜的毒性.
如图8,6个样品(O1-O3及F4-F6)的16S rDNA总读数为 413965条,每个样品的平均计数为 68994条;O1-O3为未参与4-FP降解的原始斜生栅藻微生物膜细菌丰度,FP4-FP6为参与 4-FP耦合降解 8d之后的斜生栅生物膜细菌丰度.在所给数据的基础上剔除未命名细菌(uncultured_bacterium),再由高至低对其进行排序,选取前20个相关细菌属绘制相对丰度变化图.通过对参与ICPB耦合降解4-FP前后的菌落分析,可以发现红球菌(Rhodococcus)、假单胞菌(Pseudomonas)、无色杆菌(Achromobacter)、噬菌体(Hydrogenophaga)、盐矿单胞菌(Salinarimonas)、寡聚菌(Oligoflexus)、雷氏菌(Reyranella)等细菌在ICPB耦合降解4-氟苯酚8d后的生物膜中的富集度明显上升.其中,富集度最大的是红球菌,红球菌具有多种代谢途径和同源性基因以及吸收代谢疏水性物质的能力,可用于多种有毒有机物的降解,如碳氢化合物、腈和酚类化合物[24-26];同时,红球菌细胞膜中脂肪酸成分能根据生长底物的变化做出调节,进一步增强了红球菌对有毒有机物的抗性[25];另外,红球菌中存在多种单加氧酶和多加氧酶[25],加氧酶能够有效促进4-FP的降解[27].其次是假单胞菌和无色菌,假单胞菌中存在一种不与有机物质反应的苯酚羟化酶,该酶能够激活分子氧,通过羟基化对酚类化合物进行环裂解[28-30];无色菌也可降解酚类化合物[29].因此,在 4-FP有毒有机废水降解中,生物膜内细菌物种的自适应调整,促使了微藻、细菌及光催化三者之间的亲密合作,从而实现了4-FP快速持续地去除.

图8 斜生藻生物膜中主要细菌属的相对丰度Fig.8 The relative abundance of top 20associated bacterial genera in Scenedesmus obliquus biofilms
3 结论
3.1 单独光催化(12h内)对 4-FP的去除率约为~95%,DOC去除率约为~54%,脱氟率约为~25%(总F-浓度为0.446mmol/L).单独生物降解4-FP第一个周期(10h)内微藻生物膜对 4-FP去除率达 99%,DOC去除率达到91%,脱氟率达到89%.3个周期后,单独生物膜对4-FP的去除率、DOC的去除率及脱氟率分别降低为75.5%,64.5%,69.5%,且最终DO浓度的增量降低.
3.2 本文利用光催化光纤、生物膜、核孔膜及LED紫外-可见光源构建了光催化与生物降解直接耦合系统.耦合降解4-FP第1个周期内8h即可将4-FP完全去除,12个周期后,5h即可将 4-FP完全去除,DOC去除率达到89.4%,脱氟率达到78.3%.该系统克服了单独光催化降解不彻底,单独生物膜易受4-FP毒性影响而难以持续降解的缺点.在耦合降解系统中,微藻光合作用为细菌和光催化降解4-FP提供氧气;光催化产物及细菌产物为微藻生产代谢产氧提供碳源;光催化光纤能实现4-FP快速降解并在其表面辐射可见光(为微藻光合作用提供光能).
3.3 光催化与生物降解直接耦合系统实现了光催化、细菌及微藻的亲密耦合,在温度和初始pH值分别为35℃和8.0的条件下,实现了对4-FP快速持续地降解,50mg/L 4-FP的去除时间缩短至5h,8d内生物膜干重净增166mg.

