荧光碳量子点在药物分析中的应用研究进展
毛惠会,湛志华,周国华,薛茗月,*,韩国成*,蒋梦馨,罗晓楠,林小雅
(1. 桂林电子科技大学 生命与环境科学学院,广西 桂林 541004; 2. 岭南师范学院 化学化工学院,广东 湛江 524048)
1 引 言
随着科学技术的发展和人民生活水平的提高,人们对健康问题越来越重视,各种疾病治疗的药物不断地被研发和应用,但长期、大量地服用某些药物,会对机体造成一定程度的毒副作用。因此,为了保证药物疗效的良好发挥,实现对药物质量的准确、快速分析是非常必要的。
抗生素作为抗菌药物的一大类,能有效治疗人类的很多疾病,但抗生素的滥用也导致了一些常见细菌耐药菌株的增加,食物中残留的抗生素也会对人体产生一定的影响[1],实现对抗菌药物的有效检测尤为重要;抗炎药物,尤其是非甾体抗炎药物,在临床上被广泛用于骨关节炎、类风湿性关节炎、多种发热和各种疼痛症状的缓解,而不当地使用抗炎药物可能会导致肝、胃肠道和中枢神经系统的损伤[2];随着癌症发病率的不断提高[3],各种抗肿瘤药物进入人们的视野,控制抗肿瘤药物的质量,尽可能地减轻对机体的毒副作用非常重要;除此之外,维生素作为维持身体健康所必需的一类有机化合物、多种生物小分子药物作为疾病治疗的有效药物也越来越受到重视。因此,选择一种灵敏、高效、便捷、准确的技术实现对这些药物的检测十分重要。
目前药物分析技术主要为液相色谱-串联质谱联用、光谱法、毛细管电泳、时间分辨荧光分析法、酶活性测定等[4],这些方法使用的仪器通常都十分昂贵,有些还需要复杂的样品前处理。在这种情况下,各种类型的荧光传感器由于响应时间快速、易操作、具有优异的抗光漂白性、高灵敏度和高选择性等优势进入研究者的视野。目前常用的荧光传感器主要有基于金属有机框架的荧光传感器[5-6]、有机化学传感器[7-11]、金属纳米传感器[12-13]、碳纳米材料传感器[14-16]和荧光传感器阵列[17]等,其中碳纳米材料传感器,尤其是碳量子点(Carbon quantum dots,CQDs),也称为碳点(Carbon dots,CDs),作为一种新型的荧光碳纳米材料,与其他的荧光传感器相比,具有原料来源广泛、制备方便[18-20]等优势,近年来在药物分析领域发展迅速。
因此,本文对碳量子点作为荧光传感器在部分抗菌药物、抗炎药物、抗肿瘤药物、多种维生素以及一些药物小分子方面的分析应用进行了综述与展望。
2 碳量子点对抗菌药物的分析
抗菌药物(Antibacterial agents)包括各种抗生素、磺胺类、咪唑类、硝基咪唑类、喹诺酮类等化学合成药物。其中,四环素类(Tetracyclines,TCs)抗生素作为一类具有广谱抗菌活性的抗生素,呈现出良好的抑菌杀菌能力,国内应用的TCs主要包括金霉素(Chlortetracycline,CTC)、土霉素(Oxytetracycline,OTC)、四环素(Tetracycline,TC)、多西环素、美他环素和米诺环素等,其结构均含并四苯基本骨架[21-23],如图1所示。但由于TCs 具有较强的致畸、致突变的作用,过量时可能引起致命的肝毒性等副作用。为了有效地预防TCs药物的滥用,国标GB/T 21317-2007中规定动物源性食品中TCs兽药残留限量为50 μg·kg-1(以猪肉为例,TC=109.7 nmol·L-1;CTC=101.8 nmol·L-1;OTC=105.9 nmol·L-1);SC/T 3015-2002中规定水产品中TC、OTC的残留限量为50 μg·kg-1(以鱼肉为例,TC=118.5 nmol·L-1; OTC =114.3 nmol·L-1),CTC的残留限量为100 μg·kg-1(109.9 nmol·L-1) ;GB/T 22990-2008中规定牛奶中TC、OTC的残留限量为5 μg·kg-1(以正常鲜牛奶为例,TC =11.6 nmol·L-1; OTC=11.2 nmol·L-1),CTC的残留限量为10 μg·kg-1(21.5 nmol·L-1)。中华预防医学会发布的团体标准中规定饮用水中TC的残留限量为1.61 ng·L-1(3.62 nmol·L-1),OTC为1.77 ng·L-1(3.84 nmol·L-1),CTC为1.56 ng·L-1(3.26 nmol·L-1)。因此,必须开发快速、经济、实用的TCs检测方法。
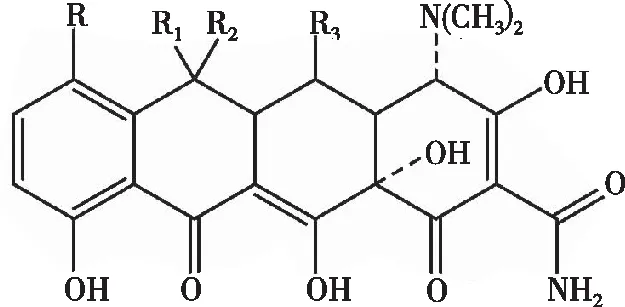
图1 四环素类药物的基本化学结构图[21]
Wang[23]以烟丝为原料、水热合成的蓝色荧光碳点(T-CDs)与 TCs结合后,由于OTC 和 TC 的吸收光谱与T-CDs的激发光谱有较好的重叠,基于内滤效应(Inner filter effect,IFE),导致了CQDs的激发光被吸收从而发生荧光猝灭现象;又由于CTC分子中存在吸电子基(—Cl),导致CTC分子更易于与带负电的T-CDs结合,形成更稳定的体系从而引起荧光信号的增强。因此,基于以上不同的荧光响应机制,实现了对TC、OTC、CTC的视觉区分。Lin[24]以柠檬酸和谷胱甘肽为原料,采用一步微波法合成的荧光CQDs负载于静电纺丝中,基于IFE,实现了对固相中TC的识别,线性范围为2~150 μmol·L-1,检测限为520 nmol·L-1。食品和饮用水中的抗生素残留也引起了极大的关注,Zhao等[25]采用微波辅助法,以柠檬酸三胺和维生素B1为前驱体,合成具有高选择性的N,S-CDs,实现了对牛奶中CTC含量的检测,线性检测范围是0.177~35.3 μg·mL-1(37~74 μmol·L-1),检测限为71 ng·mL-1(148 nmol·L-1)。Sun[26]以荧光材料CQDs和铕为基础,利用分子印迹聚合物(MS/MIPs)作为涂层制备了比率荧光传感器(CQDs-Eu@MIPs)。研究发现,CT与CQDs-Eu@MIPs结合后,CT表面的羟基与CQDs作用使蓝光减弱,同时,其表面的羰基又与铕离子发生缔合,使铕离子在 620 nm 波长处的红光增强。作者基于两处的荧光强度比,实现了对牛奶中CT的检测,检测限为7.9 nmol·L-1。在许多国家,一些含有CTC和柳氮磺吡啶(Sulfasalazine,SSZ)的抗生素被广泛用于临床,Zhang等[27]由柠檬酸和L-精氨酸一步水热反应合成的纳米CDs荧光传感器,基于荧光猝灭效应,在定量CTC和SSZ方面表现出优异的分析性能,检测限分别为0.078 μg·mL-1(162.9 nmol·L-1)和0.032 μg·mL-1(80.3 nmol·L-1)。Zhang等[28]以山楂粉为原料,添加DETA作为氮源,通过水热法制备了具有蓝色荧光的N-CDs。基于IFE引起的荧光猝灭现象,建立了一种新的用CDs测定CTC的荧光方法。在最佳实验条件下,在0.4~20 μg·mL-1(0.835~41.8 μmol·L-1)范围内具有良好的线性关系,检测限为(0.073±0.005) μg·mL-1((152.4±10.4) nmol·L-1)。不同CQDs体系对TC、CTC、OTC检测的性能对比如表1所示,为了更好地进行分析比较,文中表述的药物检测的线性范围单位统一换算为μmol·L-1,检测限单位统一换算为nmol·L-1。
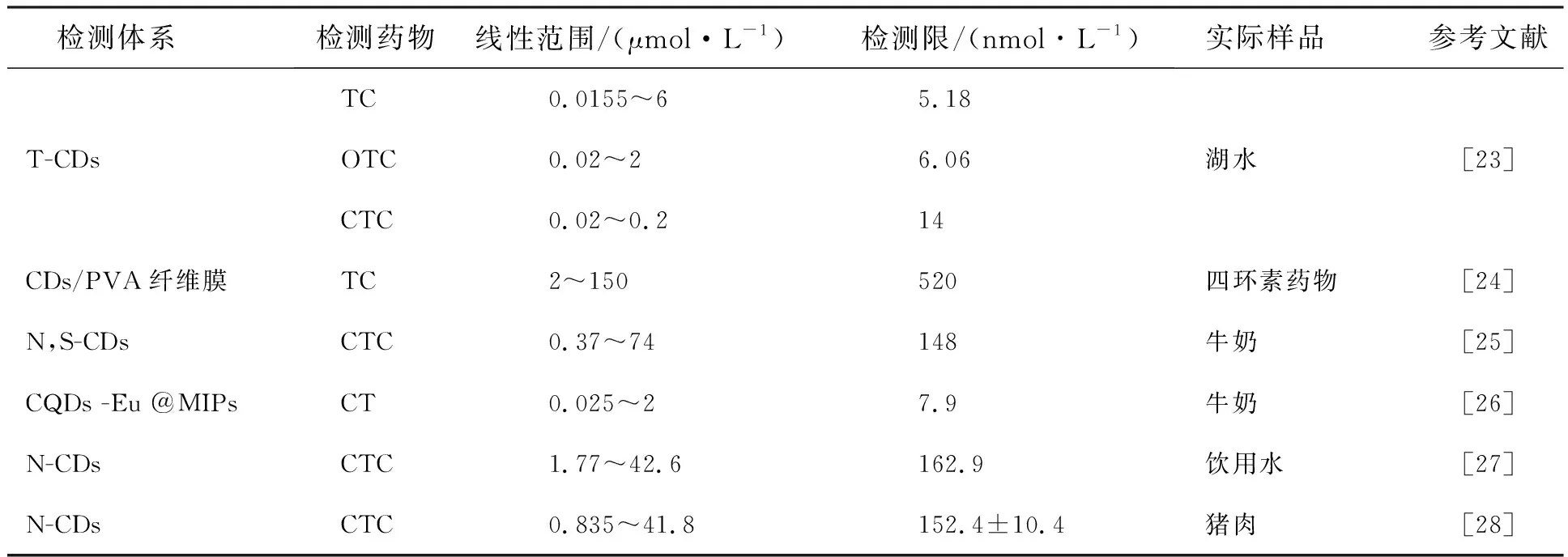
表1 不同 CQDs 体系对TC、CTC、OTC检测的性能对比
由于四环素类抗生素经常作为兽用抗生素用于动物疾病的预防和治疗,因此,将荧光碳量子点用于水产品、动物源性食物、牛奶、饮用水、蜂蜜中四环素类抗生素的检测是十分必要的。通过表1中的数据分析发现,虽然上述检测方法均能较好地实现对TC、CTC、OTC含量的检测,但存在线性范围窄、灵敏度不高等缺点。
除四环素类药物之外,常见的抗菌药物还有氨苄青霉素(Ampicillin)[29]、盐酸小檗碱(Berberine Hydrochloride,BH)[30]、奥硝唑(Ornidazole,ORN)[20]、呋喃妥因(Nitrofurantoin,NIT)[31]、异烟肼[23]、头孢克肟[32]等。Li等[29]以柠檬酸三钠、11-氨基十一烷酸、NaH2PO4和聚乙二醇为原料,用微波法合成了氮磷共掺杂荧光碳量子点(NPCQDs),研究发现,加入黄芩苷后,其表面富含的羟基会与 NPCQDs表面的羧基结合,形成无荧光的复合物,从而减弱了NPCQDs的荧光发射,使NPCQDs荧光发生猝灭;而加入氨苄青霉素后,氨苄青霉素表面的氨基会与黄芩苷表面的羟基之间形成分子间氢键,使得NPCQDs得到释放,使其荧光得以恢复,如图2所示。基于荧光碳量子点“关-开”原理,建立了测定氨苄青霉素的新方法,检测限为0.79 μmol·L-1。Al-Hashimi等[31]用叶酸和浓磷酸水热合成荧光CQDs,通过NIT对CQDs的猝灭,建立了荧光分析法测定胶囊中的NIT,线性响应范围为5.0~9 0 μmol·L-1,检测限为1.4 μmol·L-1,结果与英国药典规定的参考方法相当。Zhang等[32]以黑豆为碳源,合成荧光黑豆(BS)-碳量子点(CQDs)的廉价碳源。由于Ce(Ⅳ)和BS-CQDs之间的基态复合和电子转移,Ce(Ⅳ)可以有效地猝灭这些粒子的荧光;而在头孢克肟存在下,电子转移被中断,荧光信号被恢复,其检测限为0.169 μmol·L-1,该新体系的建立为头孢克肟的测定提供了新的方法。
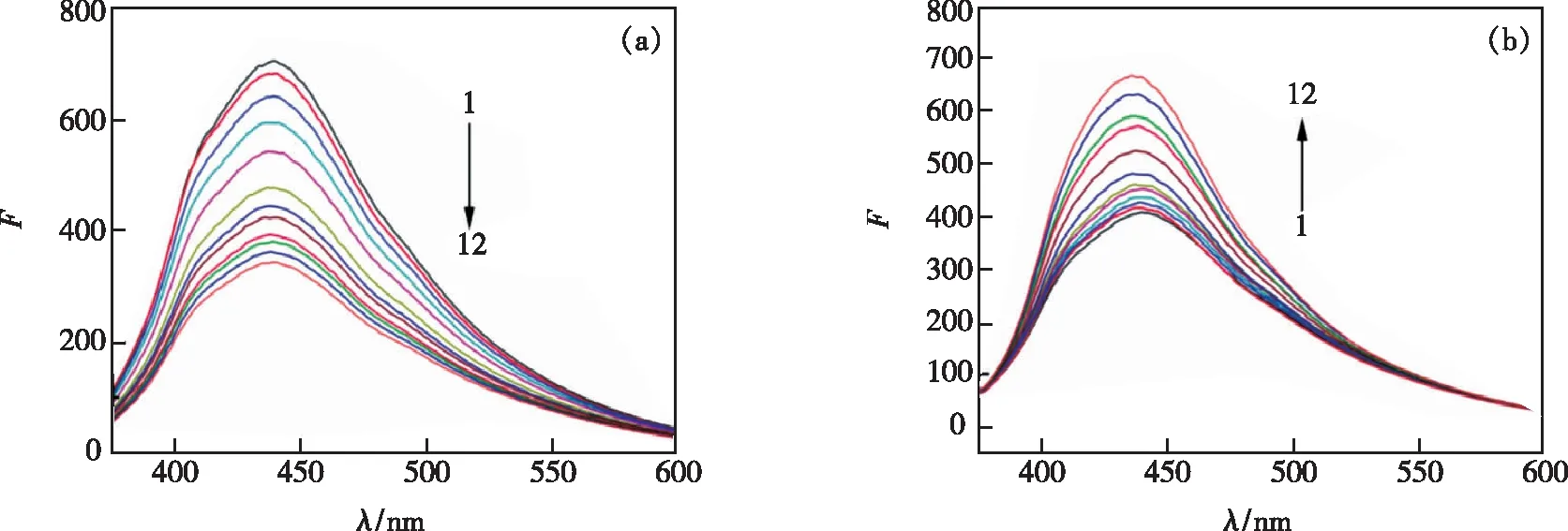
图2 (a)黄芩苷对 N,P-CQDs 的荧光猝灭光谱;(b)氨苄青霉素对猝灭体系的响应[29]。
综上所述,CQDs荧光传感器通过荧光“猝灭-恢复”机制,可以较好地实现对抗菌药物的可视化检测。同时,宽线性检测范围和低检测限的碳量子点荧光传感器设计仍亟待解决。
3 碳量子点对抗炎药物的分析
非甾体抗炎药(Nonsteroidal antiinflammatory drugs,NSAIDs)通过抑制前列腺素的合成,发挥其解热、镇痛、消炎作用,同时还对肿瘤有抑制作用。其代表药物尼美舒利(Nimesulide,Nim)可有效治疗慢性类风湿性关节炎、泌尿生殖系统炎症、耳鼻喉科疾病。然而,长期或过量使用 Nim会对儿童和成人造成严重的身体伤害,包括肝脏和中枢神经系统[33]。Song等[34]以柠檬酸铵和双(频哪醇合)二硼为前驱体,通过简单的水热处理制备硼、氮碳量子点(B,N-CQDs)。Nim的加入使B,N-CQDs的荧光明显猝灭。在0~100 μmol·L-1范围内,荧光强度与Nim浓度呈良好的线性关系。此外,该方法还成功地应用于药物样品中Nim的检测,回收率为94.60%~96.73%。
吡罗昔康(Piroxicam,PRX)具有镇痛、抗炎及解热作用。Wu等通过一步水热法,以邻苯二胺、谷氨酸及硼酸为前驱体,制备了一种硼氮共掺杂的荧光碳点(B,N-CDs)。由于B,N-CDs和 PRX之间存在强烈的电子或能量转移,导致B,N-CDs发生强烈的荧光猝灭效应。据此,应用B,N-CDs 作为荧光探针成功构建了高选择性、高灵敏性的PRX检测荧光传感器,检测PRX的线性范围为0.02~0.15 mmol·L-1,检测限为0.057 μmol·L-1[35]。Wang以黑芝麻为原料,采用一步水热法制得具有强烈荧光的CQDs,由于Cu2+具有较强的络合作用,将Cu2+加入到CQDs溶液后,Cu2+会与CQDs表面基团间发生一定的作用,形成CQDs-Cu2+复合物,CQDs处于激发态时,Cu2+会与CQDs之间发生电子转移,从而导致了CQDs荧光猝灭,CQDs荧光强度降低;由于PRX与Cu2+具有更强的结合能力,可以形成更稳定的复合物,因此,在猝灭后的CQDs-Cu2+复合物体系中加入PRX,导致Cu2+从CQDs表面移除,CQDs荧光强度增强,CQDs的荧光得以恢复[36]。基于这一原理,成功构建了“猝灭-恢复”型荧光探针用于PRX的高灵敏检测,检测限为0.072 μmol·L-1。
芦丁(Rutin,RT)是一种多酚类天然化合物,具有抗炎、抗氧化、抗过敏、抗病毒等功效,同时可用于冠心病、心绞痛、脑溢血、高血压的治疗。Wang等[37]通过对 Na2[Cu(EDTA)]和盐酸羟胺进行热解,制备了铜掺杂的碳量子点(Cu-CQDs)。研究发现,制备的Cu-CQDs的激发光谱和发射光谱与RT的紫外吸收有较大的重叠,基于IFE,RT成功屏蔽了Cu-CQDs的激发光和发射光,且在0.1~15 μg·mL-1(0.164~24.6 μmol·L-1)范围内,Cu-CQDs的荧光猝灭与不同浓度的RT呈良好的线性关系,检测限低至0.05 μg·mL-1(81.9 nmol·L-1)。Wang以红枣为原料,通过一步水热法成功合成了荧光 CQDs,实验发现,在CQDs溶液中加入KMnO4,会发生荧光猝灭现象,加入RT后,体系荧光得到恢复。作用机理如下:由于KMnO4具有强氧化性,易吸收电子,将KMnO4加入到 CQDs溶液时,KMnO4通过电子转移的方式占据了CQDs表面,使CQDs的表面激发态以一种非辐射电子转移方式释放其能量,CQDs的荧光猝灭,使得荧光信号“关闭”;在猝灭后的CQDs体系中加入RT后,结合于CQDs表面的KMnO4会与强还原性的RT发生氧化还原反应,把KMnO4从CQDs的表面移除下来,从而使CQDs 的荧光得以恢复,荧光信号“开启”[36]。该方法检测限为0.15 μmol·L-1,据此提出了“关-开”型荧光探针,用于RT的高灵敏度检测。
抗炎药物由于优良的抗炎、镇痛和解热的作用,成为继抗菌药物之外,滥用最为严重的药物,因此,实现对抗炎药物的检测十分重要。CQDs作为荧光性能优异的传感器,可以较好地实现对抗炎药物的检测,但是仍然存在检测范围窄、灵敏度不高的缺点。
4 碳量子点对抗肿瘤药物的分析
药物治疗已成为当今临床治疗肿瘤的重要手段之一,常见的替尼类抗肿瘤药物是一类新型生物靶向治疗肿瘤药物,主要包括吉非替尼、伊马替尼、厄洛替尼、舒尼替尼、拉帕替尼等。Jiao[38]以绿茶茶叶渣为碳源,通过高温热解和浓H2SO4氧化相结合的方法制备出氮硫共掺杂的荧光碳点(T-CDs),研究发现,吉非替尼的吸收光谱和T-CDs的激发光谱重叠,在T-CDs溶液中加入吉非替尼后,二者之间发生IFE而引起T-CDs荧光猝灭,线性检测范围为 0.1~20 μg·mL-1(0.22~32.8 μmol·L-1),并成功地将其作为荧光传感器应用于尿液样品中吉非替尼的检测。Zhang等[39]由葡萄糖和半胱胺酸盐一步水热处理,合成氮硫共掺杂的碳点(N,S-CQDs)。基于IFE导致的荧光猝灭现象,实现了对厄洛替尼(Erlotinib)的线性检测,检测限为0.027 μg·mL-1(62.8 nmol·L-1)。
姜黄素(Curcumin,Cur)是中药姜黄的一种主要生物活性成分,具有降血脂、抗凝、抗氧化、抗肿瘤等药理作用,临床应用十分广泛。Hu等利用麦秸秆和1,2-乙二胺为原料,采用一步水热法制备出蓝色氮掺杂碳点(CDs-Ws)[40]。由于IFE的存在,Cur在3~10 μmol·L-1范围内可有效猝灭CDs-Ws的荧光,检测限为 55.17 nmol·L-1,如图3所示,同时制备的 CDs-Ws 细胞毒性低,可应用于细胞的多色成像,据此构建了检测 Cur 的荧光传感器。Tang等[41]采用一步固相法,使用酒石酸和尿素作为前体制备了一种氮掺杂碳点(NCDs),发现姜黄素的紫外吸收带明显与NCDs的激发带重叠,因此,基于IFE和静态猝灭,所合成的NCDs可用作姜黄素检测的荧光猝灭传感器,在0.1~20 μmol·L-1范围内获得良好的线性关系,检测限为29.8 nmol·L-1。
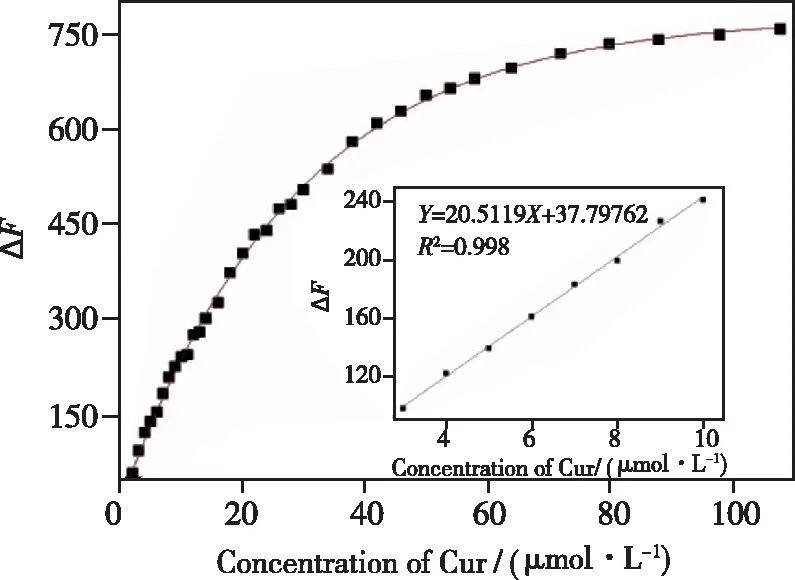
图3 Cur对CDs-Ws的荧光猝灭曲线及线性拟合曲线[40]
除了保障抗肿瘤药物的质量之外,实现抗肿瘤药物的靶向运输也是尽可能地杀死癌细胞、保护正常组织的有效方法之一。目前常用的负载抗肿瘤药的载体有抗体[42]、功能化树状大分子[43]、聚合物[44-45]、碳量子点[46]等。CQDs尺寸一般在10 nm以下,而<6~8 nm的碳量子点容易被肾脏清除,减小了在体内积聚的风险;同时,由于CQDs具有优异的荧光性能,作为荧光探针,在药物运输的实时监测、肿瘤靶向成像和放疗增敏方面具有重要作用。
5 碳量子点对维生素类药物的分析
维生素在人体内不能合成,也不能相互转化,只能从食物中获取,因此,开发高选择性、可靠且灵敏的方法来检测食品和药物样品中的维生素含量至关重要,这里主要介绍部分B族维生素和维生素C。
核黄素,俗称维生素B2,是水溶性维生素之一,也是多种细胞过程所必需的,缺乏这种维生素会导致皮肤粘膜表面损伤、强烈畏光、疲劳、生长缓慢,出现消化问题、唇炎和贫血。Severino等[47]研究发现,核黄素中羰基和氨基基团的存在对CQDs表面的羟基和羧基具有很强的吸引力,使得CQDs与核黄素之间形成氢键并缩短空间距离,因此,以CQDs为供体、核黄素为受体,实现了CQDs与核黄素之间的高效荧光共振能量转移(Fluorescence resonance energy transfer,FRET)。观察到FRET和核黄素浓度在0.1~3 μg·mL-1(0.27~7.9 μmol·L-1)之间呈线性关系,检测限为1 ng·mL-1(2.7 nmol·L-1)。
叶酸(Folic acid,FA),俗称维生素B9,是一种水溶性维生素,对孕妇尤其重要,妊娠期间摄入足量的FA可以预防胎儿先天性神经管畸形。Qian等[48]制备的AA-CDs可以通过静电相互作用与FA相互作用,两者之间发生电子转移过程,导致AA-CDs的荧光动态猝灭,检测限为40 nmol·L-1。该方法成功地应用于食品和药品样品中FA的检测,平均回收率为95.0%~105.3%。维生素 B12(VB12)是唯一含金属元素(钴)的维生素,由微生物合成,可用于治疗巨幼细胞贫血、亚急性联合变性神经系统病变、缓解眼疲劳、治疗放射性皮肤损伤等。Wang等[49]以红枣为碳源,通过一步水热法合成了发光碳量子点(CQDs),研究发现,维生素B12可能作为电子受体与激发态的CQDs发生相互作用,使CQDs发生电荷转移,实现动态猝灭,且CQDs的荧光猝灭强度 ΔF与VB12的浓度呈良好的线性关系,线性范围为0.09~15 μmol·L-1,方法检测限为71 nmol·L-1,可用于样品中VB12含量的测定。Hu[50]以乙腈和对苯二胺为原材料,通过溶剂热法制备了红色荧光氮掺杂碳点(N-CDs)。基于IFE,VB12可有效猝灭N-CDs的荧光,在2~204 μmol·L-1范围内具有良好的线性关系,如图4所示。基于该方法,红色荧光 N-CDs 已成功用于药物和食品样品中 VB12的检测。
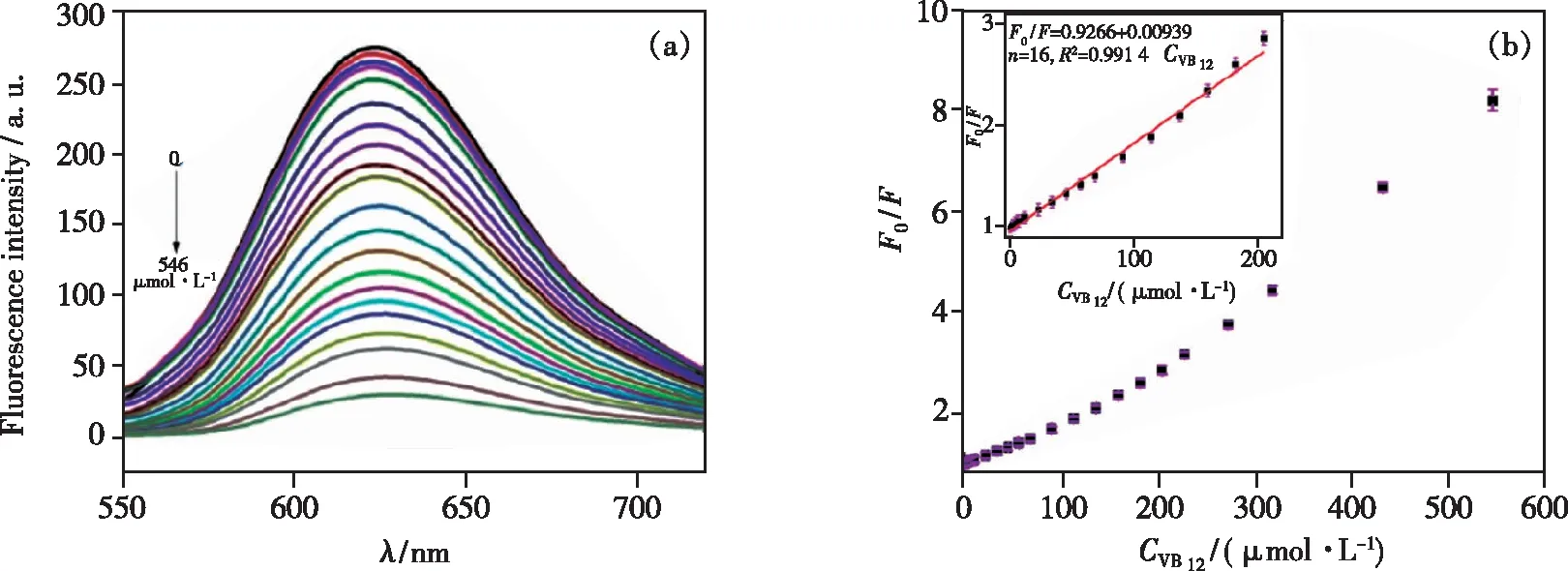
图4 (a)不同 VB12含量(0~546 μmol·L-1)的荧光猝灭图;(b)VB12对 N-CDs 的荧光猝灭曲线[50]。
L-抗坏血酸(L-ascorbic acid,Ascorbic acid,AA)俗称维生素 C,是一种水溶性维生素,可用于防治坏血病、治疗慢性铁中毒和特发性高铁血红蛋白血症。Zheng等[51]首次以柠檬酸为碳源、乙烯三胺(DETA)为表面钝化剂,采用热裂解法制备了量子产率高达88.6%的CDs。由于Cr(Ⅵ)与该CDs的激发和发射带具有相当精确的重叠,基于内滤光效应,保证了CDs荧光猝灭的高效发生。此外,在常温条件下,Cr(Ⅵ)可以被AA还原为Cr(Ⅲ),从而恢复CDs的荧光。而且,在0.03~0.1 mmol·L-1范围内,荧光强度和AA浓度之间存在良好的线性关系,因此,CDs-Cr(Ⅵ)混合物可作为一种“开启”荧光传感器,用于快速响应(1 min内)和高灵敏度检测AA。Wu等以去皮的蓖麻为碳源,采用一步水热法合成了绿色荧光CO-CQDs,之后将CO-CQDs与卤代荧光素染料曙红Y(EY)复合,建立了一种以 CO-CQDs /EY 复合物为比率型荧光探针测定 AA 的新方法[52]。在优化的实验条件下,基于荧光信号猝灭与恢复效应,该探针于 540 nm/405 nm 两处的荧光强度比值与AA 的浓度在0.05~4 μmol·L-1范围内呈良好线性关系,检测限为37 nmol·L-1,该探针成功地应用于检测药物、水果和蔬菜中 AA 的含量。Lin等[53]以柠檬酸、酒石酸铵和氯化铜为原料,利用家用微波炉合成了新型的铜掺杂碳点(Cu-CDs)。基于内滤光效应,AA在0.1~3.0 μmol·L-1范围内可直接猝灭Cu-CDs荧光,检测限可达27 nmol·L-1。同时,设计了一种基于Cu-CDs与 Fe3+配合物的通-通传感系统,通过FRET作为AA的特异检测探针,检测限为6 nmol·L-1,是报道的最好结果之一,在真实药品样品中AA的检测也取得了较好的结果,不同CQDs体系对AA检测的性能对比如表2所示。
6 碳量子点对其他药物分子的分析
多巴胺(Dopamine,DA)是大脑中含量最丰富的儿茶酚胺类神经递质,其在生物内发挥着巨大的作用。当其浓度发生异常改变时,会导致帕金森病、精神分裂症、Tourette综合症、注意力缺陷多动综合症和垂体肿瘤等的发生。除此之外,DA还作为心血管系统药,注射用于各种低血压和休克。因此,建立体内DA灵敏、特异检测方法具有重要意义。
He等[56]通过柠檬酸钠和碳酸氢铵的水热处理制备了发蓝光的CDs,并用3-氨基苯硼酸(APBA)进行修饰。之后以牛血清白蛋白(BSA)为稳定剂,N2H4-H2O 作为还原剂,制备了BSA稳定的发红光的CuCNs。通过碳二亚胺活化偶联,构建了由CDs和CuCNs组成的新型纳米杂化材料(Cu/CuCNs),并显示出双发射荧光。研究发现,在DA存在下,检测到Cu/CuCNs的标记荧光(在440 nm)猝灭,APBA的硼酸与DA的顺式乙二醇之间的特异性偶联作用导致了DA与APBA在CDs表面的结合。DA作为一种高级电子受体,触发了从CDs到DA的电子转移,导致Cu/CuCNs中CDs的荧光猝灭;而添加DA后,Cu/CuCNs中CuCNs的荧光强度(在640 nm处)几乎没有变化,因此进一步用作参考荧光,以开发用于检测多巴胺的新型比率荧光探针。基于两处荧光强度的比值,发现该Cu/CuCNs与DA在0.1~100 μmol·L-1的范围内具有良好的线性关系,检测限为32 nmol·L-1。Naik等[57]采用水热合成法制备的氮掺杂碳点(N-CDs)作为选择性和灵敏检测DA的肉眼荧光探针,成功应用于商业药物样品中DA的定量测定。研究发现,多巴胺通过静电作用与N-CDs形成复合物,导致N-CDs的荧光发生猝灭,检测DA的线性范围为2~20 μg·mL-1(13~131 μmol·L-1),检测限低至1.97 μg·mL-1(12.9 μmol·L-1)。Ma等[58]以花生为原料,利用一步水热法直接合成了花生碳量子点(PN-CQDs),研究发现,Ce(Ⅳ)不仅可以与激发态的PN-CQDs之间发生电子转移,还会与PN-CQDs的表面羟基(—OH)和羧基(—COOH)等基团进行结合,导致PN-CQDs荧光猝灭;而加入DA后,由于其强的还原性,更易与结合在PN-CQDs表面的Ce(Ⅳ)发生反应,将 Ce(Ⅳ) “去除”,PN-CQDs被不断释放出来,荧光恢复。据此构建了可高灵敏检测DA的“关-开”型荧光探针,线性范围为0.25~10 μmol·L-1,检测限为90 nmol·L-1,该体系反应原理如图5所示。
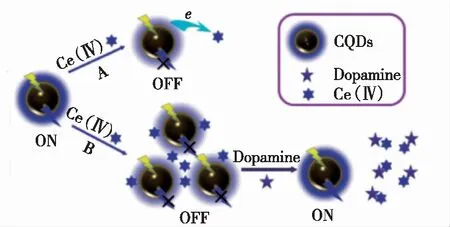
图5 Ce(Ⅳ)、DA与PN-CQDs体系反应原理图[58]。
通过上述文献研究可知,碳量子点可以实现对药品中DA含量的高灵敏检测。但是,通过比较可以发现,相较于荧光“猝灭-恢复”机理,比率荧光传感器可以实现更宽范围的线性检测和更低的检测限。目前,比率荧光传感器的设计及应用已成为CQDs研究的重要方向。
谷胱甘肽(Glutathione,GSH)作为一种小分子生物硫醇,通常在肿瘤细胞内过度表达,因此,被当作一种重要的生物标志物。除此之外,GSH能清除体内自由基,用于肝病的辅助治疗,还可用于角膜溃疡、角膜炎、初期老年性白内障等。因此,构建一种对细胞内GSH进行检测和成像的荧光探针具有十分重要的诊断意义。
Lin[24]以邻苯二胺为碳源,采用水热法合成了黄色荧光碳点(OPD-CDs),研究发现,Cu2+可与 OPD-CDs的氨基配位,生成Cu—N键而结合在OPD-CDs的表面发生聚集现象,聚集后的 OPD-CDs分子内的大幅振动受到抑制,非辐射失活过程减弱,从而使得OPD-CDs的荧光强度显著增强。而由于GSH与Cu2+具有更强的结合能力,加入GSH之后,Cu2+从OPD-CDs表面脱离,聚集体解聚,OPD-CDs的荧光强度恢复到加入Cu2+之前的状态,GSH在1~100 μmol·L-1范围内与Cu-OPD-CDs混合体系的荧光变化呈现良好的线性关系,检测限为 0.32 μmol·L-1。由此,构建了一个由聚集诱导发光增强(Aggregation-induced luminescence enhancement,AIEE)介导的“开-关”策略实现对GSH 的检测。Li等以柠檬酸、乙二胺和乙酸锌为前体,采用一步水热法制备了锌掺杂碳量子点(Zn-CQDs)。由于Cu2+能通过静电作用与Zn-CQDs 表面的官能团结合并附着于Zn-CQDs表面,当Zn-CQDs处于激发态时,Cu2+会与Zn-CQDs发生电荷转移而使Zn-CQDs荧光猝灭;之后,向该猝灭体系中加入GSH,由于GSH与Cu2+结合的强度大于静电作用力的强度,因此Cu2+会逐渐从Zn-CQDs 表面脱离,使得体系的荧光逐渐恢复[59]。在最佳实验条件下,GSH浓度在0.05~80 μmol·L-1内与Zn-CQDs荧光恢复率呈线性关系,检测限达63 nmol·L-1,由此构建了“关-开”型荧光探针用于GSH的选择性、高灵敏检测。Zn-CQDs的制备及检测GSH的原理如图6所示。
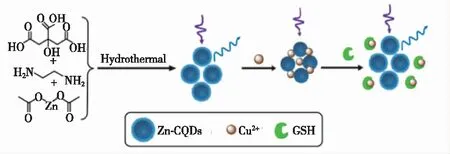
图6 Zn-CQDs制备及检测GSH原理示意图[59]
通过对比发现,在制备碳量子点的过程中掺杂其他离子,会很大程度上降低GSH的检测限,达到更好的实验结果。
除了多巴胺和谷胱甘肽外,一些其他的药物小分子物质也在生物体内发挥着重要的作用,因此,构建一个操作简单、易可视化的荧光传感器实现这些小分子物质的检测十分重要。
7 展 望
综上所述,CQDs作为荧光传感器,以其优异、稳定的荧光性能,实现了对药物的快速分析,在药物分析检测方面取得了重要的研究进展,但仍有许多地方需要改进:(1)CQDs的荧光性能:目前制备的CQDs荧光多为蓝绿色,且具有发射红移依赖激发波长的特性,为了更好地实现荧光碳量子点在生物体内的应用,减弱或避免生物自组织荧光和背景的干扰,应进一步探索具有长波长发射的 CQDs,如红光或近红外碳量子点的研究;同时,部分CQDs存在灵敏度偏低的缺点,因此,设计灵敏度高、稳定性好的CQDs传感器是亟需解决的科学问题。(2)药物荧光检测原理:现有检测方法多基于氧化还原反应设计,直接或间接导致CQDs荧光的猝灭和恢复,实现药物检测的可视化。但这种方法易受到其他还原性物质干扰,需进一步提高其检测的选择性,如比率型荧光探针/传感器的研究,与基于氧化还原反应进行药物检测的碳量子点相比,比率型荧光传感器具有更宽的线性检测范围和更低的检测限。(3)制备CQDs的碳源选择:目前制备CQDs的原料大多为化学试剂,会在一定程度上导致环境污染,危害研究人员的身体健康。随着对天然生物质材料(肉类、果蔬类、食物残渣以及一些绿色植物)的研究,“绿色”碳量子点的制备也成为研究热点。(4)CQDs的体内应用:目前大部分CQDs的细胞成像、对活细胞中生物小分子物质与药物检测、药物靶向运输和可视化治疗的研究,均在体外进行。这些研究虽然能在一定程度上反映出荧光CQDs的性能特征,但是,由于机体的代谢环境十分复杂,是否能作用于机体还需要继续研究。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20210168.

