碳点在生物医学领域中的应用
郑 敏,刘坤梅,苏 雅
(长春工业大学 化学与生命科学学院,材料科学高等研究院,吉林 长春 130012)
1 引 言
碳点(Carbon dots,CDs)是一类新型的零维荧光碳纳米材料,其直径通常小于10 nm。CDs的内核主要由石墨化的sp2碳组成,赋予CDs良好的光稳定性和高比表面积。CDs表面富含多种官能团如胺基、羧基、羟基和羰基等使其具有良好的水溶性,同时也利于同各种功能小分子和生物大分子等反应实现功能和应用的多样化。对于CDs来说,前驱体和合成方法的选择直接决定它们的物理化学性质,如尺寸、结晶度、碳/氧/氮含量、荧光特性、稳定性和生物相容性等。CDs的制备方法可以概括为两大类:自上而下和自下而上法。自上而下法是通过物理、化学或电化学的方法将碳材料(如炭黑、石墨、石墨烯和碳纳米管等)切割或分解成纳米尺寸的颗粒,通常包括电弧放电法、激光消融法、电化学法和化学氧化法等,这类方法通常需要苛刻的实验条件如强氧化剂、浓酸和高温等,而且所制备的CDs需要进一步的钝化以提高其稳定性和发光性能;自下而上法主要通过小分子或大分子的脱水、聚合和碳化而形成CDs,通常包括水/溶剂热法、热解法和微波辅助热解法等,这类方法原材料来源广泛,合成简单易行、制备成本低、适合CDs的大规模生产,促进了CDs的实际应用推广,是目前比较常用的合成方法。
CDs所具有的尺寸小、比表面积大、表面易功能化、稳定性强、水溶性和生物相容性好、毒性低等特性[1-3],使其在生物成像[3-9]、荧光传感[10-17]、药物/染料/蛋白的递送[18-22]、以及癌症诊断治疗[24-30]等生物医学领域具有广阔的应用前景。本文将从 CDs 在生物成像、药物/染料/蛋白/基因的递送和癌症诊断治疗等方面介绍其在生物医学领域的应用研究进展。
2 碳点在生物成像中的应用
目前,用于生物成像的材料主要包括有机荧光染料、半导体量子点、稀土纳米晶和碳点等。传统的有机染料虽具有较高的荧光量子产率,但是其合成过程复杂、斯托克斯位移窄、光稳定性和水溶性差等缺点限制了其在生物成像中的应用。半导体量子点虽具有发光可调和良好的光稳定性,但自身所具有的重金属毒性会给生物体和环境造成危害。稀土纳米晶虽易实现近红外区生物成像,但大都易在生物体内聚集,无法通过代谢排出体外。与上述三类材料相比,CDs不仅在抗光漂白和无闪烁的光稳定性方面具有优势,而且毒性更低、生物相容性更好、亲水性更强、表面功能基团更丰富,是一类用于生物荧光成像研究最为理想的材料之一。近年来,许多研究实现了将CDs用于非特异性或特异性细胞成像和体内组织成像。
对于哺乳动物细胞如人结直肠腺癌细胞(Caco-2)、人宫颈癌细胞(HeLa)、脑胶质瘤细胞(C6)、人肝癌细胞(HepG2)、人肺癌细胞(A549)和小鼠成纤维细胞(L929)来说,大多数CDs被细胞摄取之后,滞留在细胞质内,而不能实现在某一细胞器的特异性分布。 最近,也有一些针对某种细胞器(如细胞核[31]、核仁[32]、溶酶体[33]、内质网[34]、线粒体[35]和高尔基体[36]等)的特异性成像的报道。某些CDs还可以通过特定的细胞器标记来区分癌细胞和正常细胞。Duan等[37]以邻苯二胺为原料合成的CDs,可以通过肝癌细胞核的特异性染色来区分肝癌细胞(HepG2)和正常人肝细胞(LO2)。这种现象可能是由于正常细胞和癌细胞之间存在细胞酸碱度、内体-溶酶体系统和核孔复合体的核孔蛋白等方面的差异造成的。此外,用叶酸功能化的CDs可以靶向和鉴定叶酸受体过度表达的癌细胞[38](如MCF-7、HeLa、HepG2)。
一些CDs不需要额外地引入靶向分子,即可实现对肿瘤细胞的特异性识别。如Zheng等[7,16]以D-葡萄糖和L-天冬氨酸为原料制备的CD-Asp,可靶向脑肿瘤细胞(C6)。小鼠的荧光活体成像数据表明,通过尾静脉注射的 CD-Asp 能快速地穿过血脑屏障,精准地靶向神经胶质瘤部位,而在正常脑组织内的分布却非常少,充分证实了 CD-Asp 对脑胶质瘤的靶向成像功能(图1(a))。为了研究确定CD-Asp对C6细胞选择性的可能因素,他们分别以D-葡萄糖、L-天冬氨酸或D-葡萄糖和L-谷氨酸制备了CD-G、CD-A和CD-Glu,结果证实这三类CDs都对C6没有靶向性。他们推测CD-Asp的靶向作用可能是由于在用D-葡萄糖和L-天冬氨酸制备CD-Asp的过程中,在CD-Asp的边缘形成了类似于RGD的官能团,导致CD-Asp的高胶质瘤靶向效率。
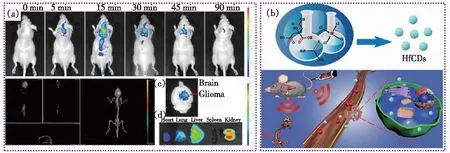
图1 (a)尾静脉注射CDs之后小鼠体内荧光成像照片[7];(b)HfCDs制备及其在原位肝脏肿瘤部位的荧光/CT双模态成像示意图[4]。
此外,基于CDs的多模式成像逐渐被应用到医学诊断领域,如Diego等[39]以柠檬酸、乙二胺、氯化钆和氯化镱为原料,制备了N、Gd、Yb共掺杂的CDs,可用于磁共振、CT和荧光三模式成像。Su等[4]以柠檬酸、硫脲和氯化铪为原料,通过热解法制备了一种铪掺杂荧光碳点(HfCDs),所制备的HfCDs可以靶向蓄积于原位肝脏肿瘤部位,并且能够在1 min内实现快速肿瘤靶向的荧光/CT双模式成像(图1(b))。为了进一步研究HfCDs对肿瘤靶向和成像的普适性,他们建立了原位宫颈肿瘤模型和右肢皮下肿瘤模型,都能够在肿瘤中检测到强的荧光/CT信号。
3 碳点在药物/染料/蛋白/基因递送方面的应用
众所周知,CDs 是由碳核(无定形碳或石墨碳,并掺杂有共轭芳环)和键连大量有机官能团的边缘结构所组成。其疏水的共轭结构易于和其他的芳香性分子发生 π-π 堆积或疏水相互作用,而处于其边缘的有机官能团则有助于和其他化合物发生静电相互作用,或与功能分子进行共价键合。因此,CDs 实现抗癌药物、有机功能染料、蛋白质或基因的递送主要有两种途径:(1)共价键合;(2)非共价相互作用(如 π-π 堆积、静电相互作用和氢键等)。
3.1 碳点用于抗癌药物的递送
Zheng等[30]合成出具有多色发光特性(从蓝光到红光)的CDs,并利用其表面大量胺基和抗癌药物奥沙利铂进行共价键合,构筑了新型的诊断治疗纳米药物体系(CD-Oxa)。CD-Oxa的平均粒径只有2.3 nm,这种超小粒径的纳米载药体系,在降低被RES吸收的同时,又可以增强药物在肿瘤组织的富集,延长药物的作用时间。在这一纳米复合体系中,一方面,CDs作为药物的载体,通过和抗癌药物的共价偶联使两者合二为一,保证了纳米药物的稳定性;另一方面,CDs多色发光的特性使得该类纳米药物具有体内和体外荧光成像的能力,通过监测荧光强度的变化,就可以达到跟踪药物的生物分布的目的;此外,肿瘤内的强还原环境有利于实现药物的控制释放。体外细胞实验证明CD-Oxa可以通过内吞作用进入癌细胞内,从细胞毒性实验来看,其对癌细胞的杀伤力足以和小分子奥沙利铂相媲美。她们以H22肝肿瘤为研究模型,通过动物活体的荧光成像来检测药物在肿瘤部位的代谢,根据荧光强度的变化来决定给药的时间和剂量,实现疾病诊断和治疗的一体化(图2(a))。Feng 等[40]构建了一种基于CDs的肿瘤微环境敏感的纳米复合体系CDs-Pt(Ⅳ)@PEG-(PAH/DMMA),其具有电荷变化特性,PEG-(PAH/DMMA)在正常生理条件下(pH 7.4)带负电荷,而在肿瘤细胞外微环境下(pH 6.8)变为正电荷,PEG-(PAH/DMMA)和正电荷的CDs-Pt(Ⅳ)的静电排斥增强,促进CDs-Pt(Ⅳ)的释放。重要的是,带正电荷的CDs-Pt(Ⅳ)@PEG-(PAH/DMMA)对带负电荷的癌细胞膜显示出高亲和力,这导致顺铂(Ⅳ)前体药物在还原性细胞质中的内化和有效激活。CDs-Pt(Ⅳ)@PEG-(PAH/DMMA)拥有多重功能:多色成像、延长血液循环时间、在肿瘤部位有效积累、增强癌细胞内化、促进内体逃逸、控制细胞内的药物释放,提高了体内外的肿瘤抑制效率,副作用小(图2(b))。Sun等[22]通过热解D-葡萄糖和L-谷氨酸的混合物合成的CDs,可以通过 π-π 堆积和静电相互作用与抗肿瘤药物阿霉素(DOX)进行超分子共组装,所制备的 CDs-DOX复合物具有pH敏感的药物担载和释放行为。DOX在pH 7.4时的担载率(260%)远高于pH 5.0时的担载率,这主要是由于在较低的pH下DOX发生质子化,削弱了DOX和CDs之间的相互作用。从在不同的pH(5.0和7.4)下CDs-DOX的释药行为评价来看,DOX在pH 5.0的释放速率明显高于pH 7.4,这是因为在较低的pH下,质子化的DOX提高了亲水性,导致负载的DOX快速释放。DOX的这种pH敏感的药物释放行为有利于癌症的有效治疗(图2(c))。Wang等[41]通过CDs和壳聚糖的交联反应合成了壳聚糖-CDs纳米凝胶(CCHNs),CCHNs中的CDs可以通过π-π堆积和静电吸引与DOX作用,提高CCHNs的DOX担载率。此外,壳聚糖的pH/近红外双重响应特性使得内源性pH触发的药物在肿瘤部位的释放和外源性近红外增强的药物释放能够实现协同治疗,以有效杀死4T1癌细胞。体内研究证实,作为DOX纳米载体,CCHNs对小鼠植入的4T1肿瘤显示出很高的疗效(图2(d))。
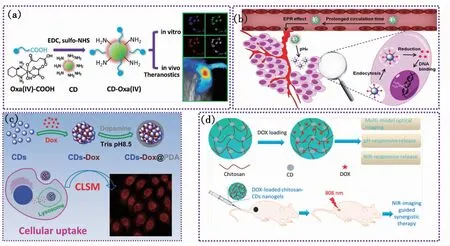
图2 (a)CDs-Oxa制备及其在生物成像和肿瘤治疗中的应用示意图[30];(b)CDs-Pt(Ⅳ)@PEG-(PAH/DMMA)用于药物递送[40];(c)CDs与阿霉素(DOX)的共组装过程及其被细胞摄取示意图[22];(d)DOX-CCHNs用于近红外成像和联合治疗[41]。
3.2 碳点用于有机功能染料的递送
Gao等[20]以3,3,4,4,5,5,6,6,7,7,8,8,8-十三氟-1-辛醇和聚(乙烯亚胺)为原料,制备了具有细胞核靶向功能的氟掺杂碳点(FCDs)。FCDs具有水溶性高、稳定性好、生物相容性好等优点,是药物和染料传递的理想载体。他们以DOX和二吡咯甲基硼(BODIPY)分别作为模型药物和模型染料与FCDs进行超分子组装,分别制备了FCD-DOX和FCD-BODIPY纳米复合材料。实验结果表明,FCDs可以大幅提高DOX/BODIPY的细胞摄取能力和递送效率,实现有机功能染料和抗癌药物的靶向递送(图3(a))。Zhang等[6]通过CDs和疏水的聚集诱导发光(AIE)染料分子的超分子共组装,制备了稳定的荧光纳米粒子CDsG-AIE 1。CDsG-AIE 1显示出大斯托克斯位移、优异的物理和光稳定性、良好的生物相容性、高荧光量子效率和强耐光漂白性等特性。更重要的是,CDsG-AIE 1可以很容易地被HeLa细胞摄取,并且在15 d内经过6代后,仍然可以清楚地观察到来自纳米颗粒的红色荧光。此外,CDsG-AIE 1在体内也表现出优异的长期成像能力。这些优良性能使CDsG-AIE 1成为无创长期追踪和成像应用的理想荧光探针(图3(b))。
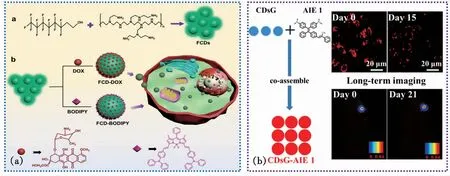
图3 (a)氟掺杂碳点(FCDs)的制备及其在抗癌药物和有机功能染料递送中的应用[20];(b)CDsG-AIE 纳米粒的体内和体外长期荧光成像照片[6]。
3.3 碳点用于蛋白质的递送
Zhang等[23]以增强型绿色荧光蛋白(EGFP)作为模型蛋白,通过EGFP与CDs共组装,合成CDs- EGFP纳米复合体系,评估CDs担载和递送蛋白质的能力。在这一体系中带负电荷的CDs和带负电的EGFP可以形成非常稳定的复合物,蛋白的包封效率高达83.3%。通过二者的复合显著地提高了蛋白的稳定性和细胞内递送效率。为了证明这种方法的普适性,他们尝试了另外一种带负电荷的CDs-Asp与人血清白蛋白(HSA)的共组装,结果证实CDs-Asp仍可以和HSA 共组装成稳定的纳米颗粒(图4(a))。与游离蛋白质相比,CDs-蛋白复合物可以保护蛋白质免受酶水解,并有效地将蛋白传递到细胞中。Li等[21]研究了带正电荷的CDs与带负电荷的蓖麻毒素蛋白B链的共组装,制备CDs-RTB超分子复合物,RTB的负载效率为81.7%。CDs-RTB不仅具有良好的生理稳定性,而且有效地阻止蛋白质的酶降解、提高了RTB胞内递送效率。更重要的是,与游离RTB相比,CDs-RTB可促进巨噬细胞增殖,有效地提高炎症因子的mRNA表达水平,增强了RTB免疫调节活性(图4(b))。Lu等[19]用简单的溶剂热法制备了表面带有醛基的CDs,通过与4-氨基苯硼酸的缩合反应,合成氨基苯硼酸修饰的碳点CD-B。CD-B可通过并以其为载体实现了血红蛋白(Hb)和葡萄糖氧化酶(GOX)的高效递送。Hb与CDs复合后,其包封率高达94.3%,值得一提的是,Hb@CD-B和GOX(O2,CO)结合后具有独特的吸收带,这说明它保留了天然Hb结合和释放氧的能力。GOX与CDs复合后,其生物活性仍保持在93.8%。与游离的GOX相比,GOX@CD-B的酶活性在室温下更稳定。这些结果证明碳点和蛋白组装后很大程度改善了蛋白药物易聚集、降解的缺点,使蛋白更容易被递送到细胞内并发挥作用。
图4 (a)CDs与绿色荧光蛋白超分子共组装[23];(b)CDs与蓖麻毒素蛋白B链的共组装[21]。
3.4 碳点用于基因的递送
在CDs表面修饰易同基因结合的阳离子聚合物如聚乙烯亚胺(PEI)等,即可实现基因的递送。比如Liu等[42]以甘油和PEI25k为原料,通过微波辅助热解法制备了PEI功能化的CDs,PEI既钝化了CDs表面,赋予CDs强的光致发光特性,又可以通过静电相互作用和DNA复合,用于基因转染。此后,该课题组[43]将聚[甲基丙烯酸2-(二甲氨基)乙酯]-b-聚[N-(3-(甲基丙烯酰氨基)丙基)-N,N-二甲基-N-(3-磺丙基)氢氧化铵](PDMAEMA-b-PMPDSAH)修饰在CDs表面,制备多功能的基因递送体系CD-PDMA-PMPD。在CD-PDMA-PMPD中CDs核作为良好的多色细胞成像探针,PDMAEMA作为DNA缩合剂可与DNA复合,两性离子PMPDSAH的外壳可以阻止载体与血清的非特异性相互作用。在30%和50%的血清浓度下,CD-PDMA80-PMPD40分别显示出比PEI25k高13和28倍的转染效率。Wang等[44]利用低分子量两亲性PEI(烷基-PEI2k)进行表面钝化,合成的烷基-PEI2k-CDs纳米载体具有良好的水分散性和稳定性,细胞毒性低,基因传递效率高。Li等[45]以1,2,4-三氨基苯作为碳源、PEI为钝化剂合成了橙光PEI-CDs,PEI-CDs可作为多功能生物相容性材料用于细胞成像和基因传递。He等[46]利用水热法制备了两种阳离子聚合物衍生的碳点(Taea-CD和CyclenCD),CDs表面带正电荷基团可与DNA组装成纳米粒子,并保护DNA免受降解。与市售的PEI相比,基因转染效率提高了2 000倍。
4 碳点在癌症诊断治疗中的应用
4.1 碳点用于光热治疗
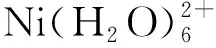
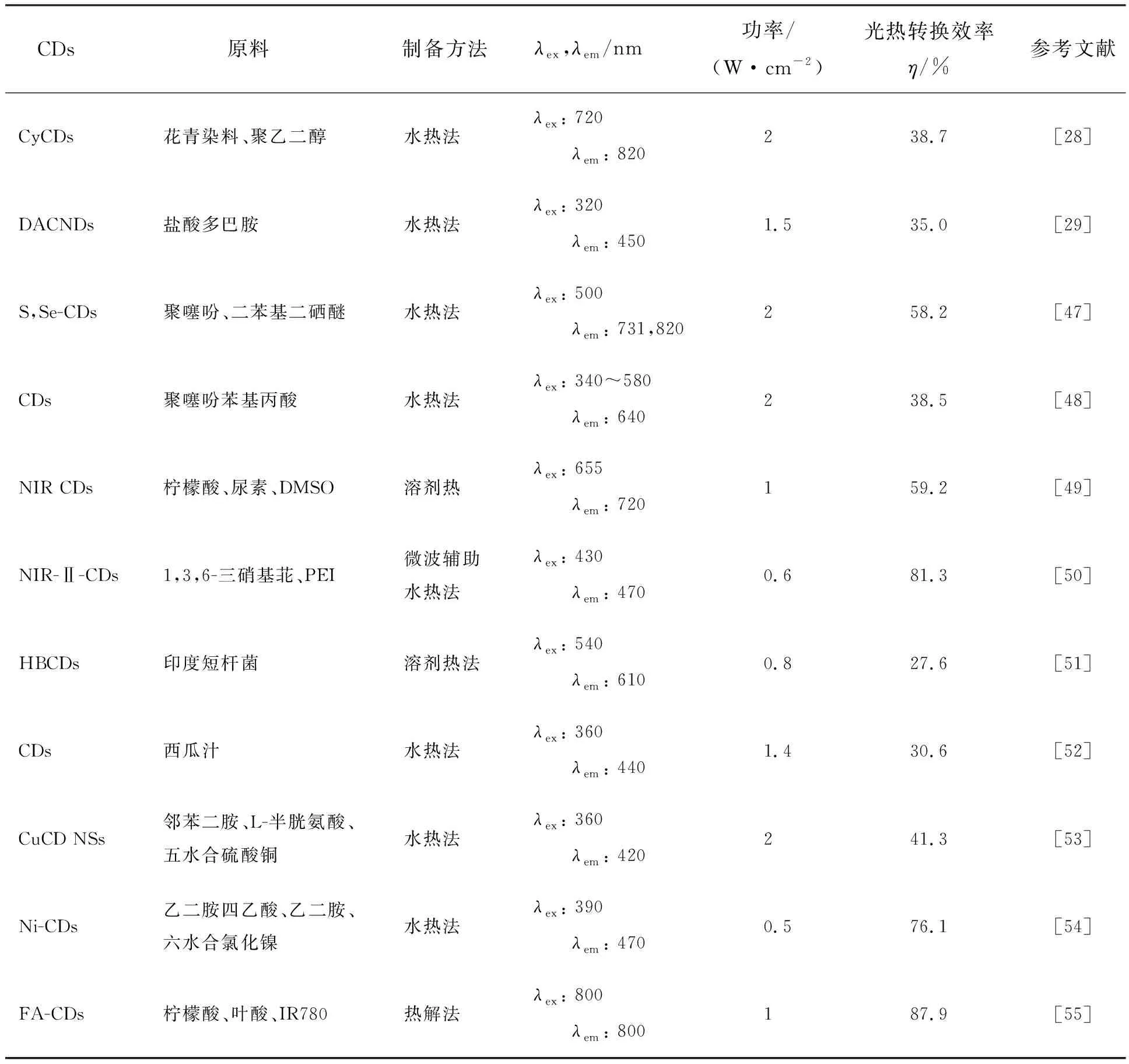
表1 不同CDs基PTT剂的光热转换效率
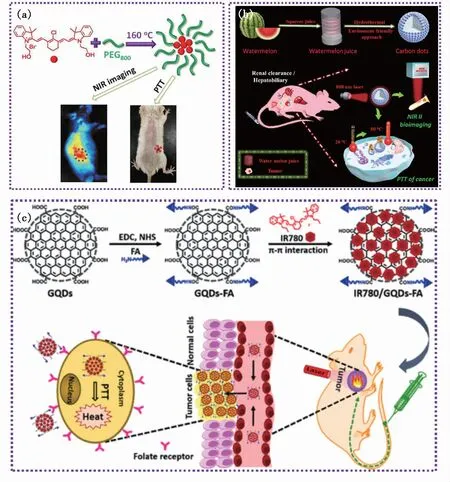
图5 (a)CyCDs的合成及NIR成像和PTT治疗[28];(b)NIR-Ⅱ发光CDs的合成及在NIR-Ⅱ成像和PTT治疗中的应用示意图[52];(c)IR780/FA-CDs用于肿瘤靶向PTT治疗[55]。
4.2 碳点用于光动力治疗
光动力治疗(PDT)是一种由光敏剂在光诱导下产生单线态氧或自由基而杀死癌细胞的治疗方法。制备CDs基PDT材料的方法通常有三种:(1)CDs通过与具有PDT功能的物质进行共价交联或共组装制备PDT纳米复合材料。Chen等[24]通过CDs和BODIPY的共价交联反应构建了结构稳定的CDs基共价有机骨架材料CCOF-2。此后,为了提高CCOF-2在水和生理介质中的分散性和稳定性,对CCOF-2进行聚乙二醇修饰。所制备的CCOF-2@PEG具有良好的生理稳定性和生物相容性、较强的癌细胞摄取能力,优异的产生活性氧物种能力,可作为一种高效光敏剂用于肿瘤的光动力治疗。实验结果表明,CCOF-2@PEG能够显著抑制癌细胞增殖和肿瘤组织生长(图6(a))。Su等[25]通过CDs和BODIPY的共组装,在增强BODIPY溶解性的同时,又通过荧光共振能量转移效应显著提高了光动力治疗效果(图6(b))。Jia等[56]使用酞菁锰作为原料制备了Mn-CDs,Mn-CDs与DSPE-PEG复合制备了具有荧光/磁共振成像和PDT多种功能的CDs复合物。Xue等[57]将转铁蛋白(Tf)和二氢卟吩Ce6担载到CDs表面,制备NBCD-PEG-Ce6-Tf复合物,实现了肿瘤靶向的近红外荧光成像介导的PDT。Sun等[58]通过富含氨基的红光CDs和Ce6组装制备了Ce6-RCDs复合物,Ce6-RCDs可用于PTT/PDT协同治疗。(2)以具有PDT功能的分子为前驱体直接制备CDs。Li等[27]用卟啉和壳聚糖为原料制备的TPP CDs不仅具有良好的水溶性和生物相容性,而且仍保持和卟啉类似的单线态氧产生能力,能够用于生物荧光成像和肿瘤PDT治疗(图6(c))。He等[26]用二酮吡咯并吡咯和壳聚糖为原料合成的DPP CDs,仍保持二酮吡咯并吡咯的PDT功能,在激光照射下可有效地抑制肿瘤细胞的增值和肿瘤组织的生长(图6(d))。Chen等[59]以间苯二胺和氯化钆为原料制备了具有PDT功能的CDs,可用于小鼠肿瘤的荧光/磁共振双模式成像介导的PDT治疗。Liu等[60]合成了一种近红外染料(CyOH)修饰的银纳米颗粒/碳点纳米复合材料(CyOH-AgNP/CDs),CyOH-AgNP/CDs可作为线粒体靶向的纳米光敏剂,用于肿瘤靶向成像和高效PDT治疗。(3)杂原子掺杂制备CDs。Guo等[61]以乙二胺四乙酸二钠和氯化铜为原料通过水热法制备了铜、氮共掺杂的CDs(Cu,N-CDs),Cu,N-CDs的近红外吸收有利于产生热量和活性氧,实现了光热和光动力联合治疗。
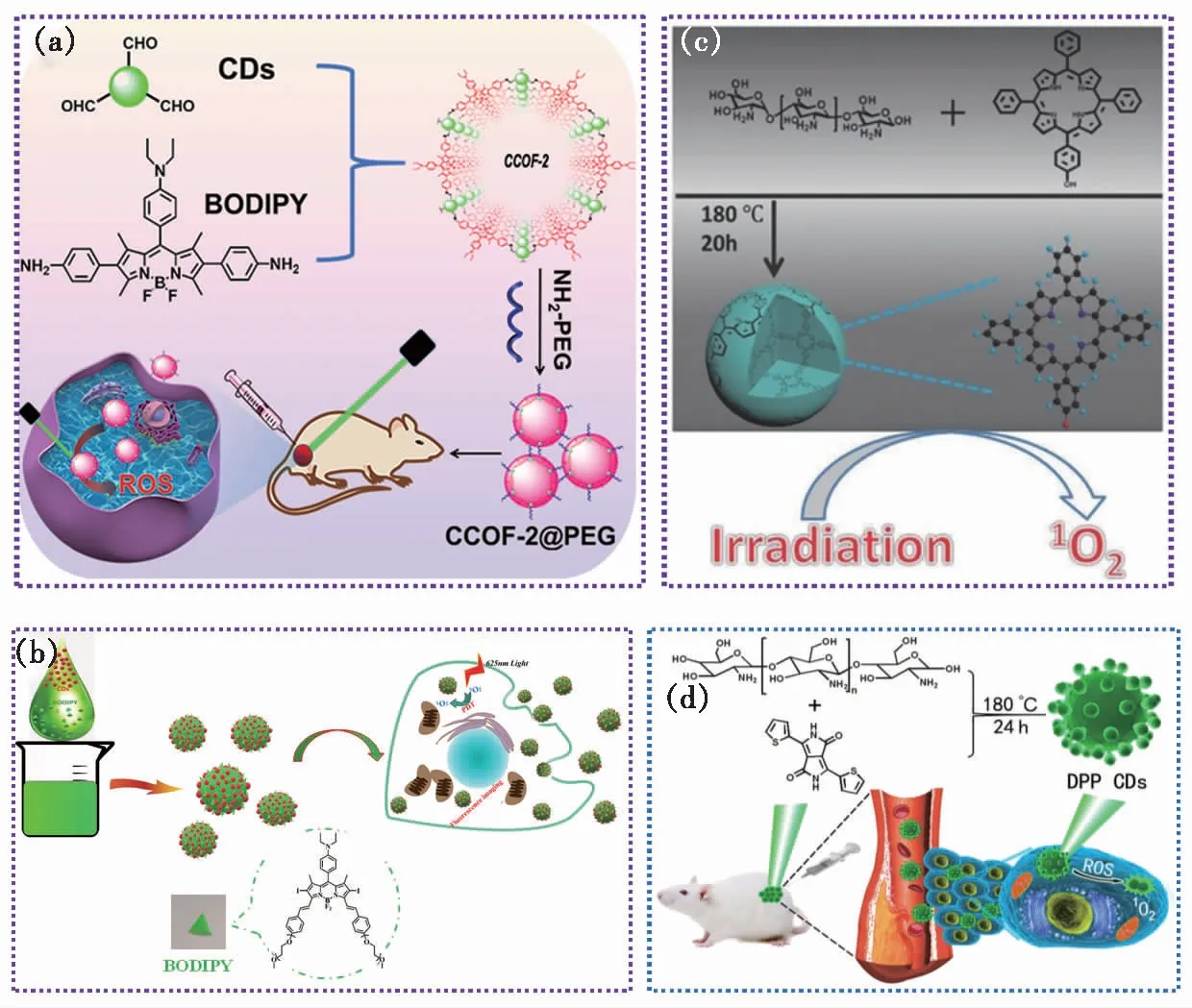
图6 (a)CCOF-2@PEG的合成及其在光动力治疗中的应用示意图[24];(b)CBNPs的制备过程及其PDT示意图[25];(c)TPP CDs的制备及PDT应用示意图[27];(d)DPP CDs的合成及其在PDT中的应用示意图[26]。
5 结论与展望
作为碳纳米材料家族的最新成员,CDs由于其优异的水溶性、低毒性和突出的荧光性质,在生物领域受到了极大的关注。由于CDs易于表面功能化,人们可以根据需要对其进行修饰,制备出量子产率高、生物相容性好、稳定性强的CDs,实现其在生物成像、荧光传感、药物和蛋白的递送及癌症的诊断治疗等领域的应用。然而,对于CDs的进一步生物应用,仍有一些亟待解决的问题。大多数CDs的激发和发射波长较短,且荧光量子产率较低,无法实现深层组织成像,不能满足人们对高品质生物成像的要求。而由于CDs的合成机制和发光机理尚不明确,难以实现红光和近红外发光CDs的可控精准制备。而且,CDs合成存在重复性差的问题,不同批次制备的CDs往往在发光特性和尺寸等方面有所差异,阻碍了CDs的进一步商业化发展与应用。另外,CDs的生物安全性和毒性评价是其向生物医学临床转化过程中的关键问题之一。然而,目前针对CDs生物安全性的系统评价较少,对CDs可能的毒性作用机制研究更是凤毛麟角。研究人员正在试图解决和克服上述问题,以推动CDs在生物医学领域更加广泛和深入的应用,促使这一新型碳纳米材料在今后的研究中绽放光彩。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20210162.

