兼具水稻纹枯病拮抗功能的生物水稻育苗基质效果研究①
戚秀秀,魏 畅,张林利,刘晓丹,杨艳霞,姜 瑛*,马 超
兼具水稻纹枯病拮抗功能的生物水稻育苗基质效果研究①
戚秀秀1,魏 畅1,张林利1,刘晓丹1,杨艳霞2,姜 瑛1*,马 超3*
(1 河南农业大学资源与环境学院,郑州 450002;2 西平县农业技术推广中心,河南西平 463900;3安徽农业大学资源与环境学院,农田生态保育与污染防控安徽省重点实验室,合肥 230036)
水稻纹枯病是水稻上常见的土传病害之一,为了研发出可防治水稻纹枯病兼具促生效果的功能型生物水稻育苗基质,本研究选用前期筛选出具有固氮解磷功能的根际促生菌:LY5枯草芽孢杆菌()、LY11解淀粉芽孢杆菌()、X2摩拉维亚假单胞菌()、X3沙芬西芽孢杆菌()、X8绿针假单胞菌(),首先探索该5株促生菌对水稻纹枯病病原菌的抑菌率,再将其与水稻纹枯病病原菌混合,在实验室已筛选出的最适配比基质基础上,研发功能型生物水稻育苗基质。在盆栽条件下,与市售水稻育苗基质对比,验证功能型生物水稻育苗基质对水稻纹枯病发病率、水稻幼苗生长和体内抗性相关酶类的影响。结果表明:①5株根际促生菌对水稻纹枯病病原菌均具有拮抗作用,抑菌率达到35.31% ~ 40.20%。②5株拮抗促生菌能够降低水稻纹枯病的发病率,其中添加LY11菌株的处理较对照处理的每盘出苗数显著增加了110.41%,而发病率显著降低了89.32%。③在含有水稻纹枯病病原菌的育苗基质中添加拮抗促生菌后,水稻幼苗的茎粗、百株地下部干物质重、百株全株干物质重、根系活力、根总表面积、根平均直径、根总体积、根尖数等方面均有所提高,其中添加LY11菌株的处理比市售水稻育苗基质处理分别显著提高3.13%、4.21%、4.97%、68.02%、26.77%、16.67%、44.44%、7.82%。④添加拮抗促生菌显著促进了水稻幼苗对地上和地下部氮磷钾的吸收。⑤水稻幼苗体内超氧化物歧化酶、过氧化物酶、过氧化氢酶的活性以及丙二醛的含量均显著高于市售水稻育苗基质处理,提高幅度为27.08% ~ 122.72%、16.09% ~ 48.15%、53.33% ~ 233.85%、110.24% ~ 511.71%。因此,本研究研发出5种对水稻纹枯病具有较好的拮抗效果,同时可以显著促进水稻幼苗生长的功能型高效生物水稻育苗基质,其中添加了菌株LY11的育苗基质综合效果最优,为功能型高效生物水稻育苗基质的研制与应用奠定了理论与实践基础。
水稻纹枯病;拮抗促生菌;育苗基质;根系活力;酶活性
水稻是我国主要的种植作物之一[1]。近年来,随着农业科技的进步和机械化生产的发展,我国水稻生产效率不断提高,水稻生产中面临的问题也日益突出,除了育苗过程取土困难以及育苗技术不完善外,水稻病害也日益加剧,其中水稻纹枯病在我国的发生最为广泛[2],导致我国水稻产量和品质下降。
水稻纹枯病是由立枯丝核菌()侵染引起的一种病害,大多发生在高温、多雨的气候条件下,是主要的土传病害之一[3]。病原菌以菌核的形式在土壤中或附着在植株上越冬,春播或插秧后附着于水稻植株近水面的叶鞘部位,在适宜的温度、湿度等条件下再生菌丝可在水稻叶片或叶鞘表面萌发、生长,然后侵入水稻内部,最后菌丝体在水稻组织内延伸、蔓延[4];随着病害的发展,到达水稻根茎周围,会使根茎的感染部分变黑,最终导致水稻根茎组织坏死,甚至根茎断裂,造成严重的穗枯萎[5],降低水稻的产量和品质。且当环境湿度较高时,白蜘蛛丝状菌丝体会出现在感染部位,并逐渐聚集成簇,终形成新的萝卜种子状菌核[6]。此外,真菌细胞在生长和分化之间的过渡时期会产生·OH、O2–·、1O2、H2O2和其他活性氧,用来削减水稻体内抗氧化作用。当细胞内活性氧过度积累,可形成菌核,抵抗活性氧的毒性,保持真菌的活力[7],同时当水稻体内的活性氧含量过高会对植物本身产生危害,SOD、CAT、POD等抗氧化酶可以水解H2O2,降低活性氧的含量,维持植物体内的活性氧产生与清除之间的平衡[8],降低真菌的活力,提高水稻的抗病性。
现今植物病害主要防治方式仍然是化学农药,而化肥、农药的大量施用对病害的防治、作物产量的提高虽然起到了重要的作用,但同时也带来了诸多生态问题[9]。近两年利用有益微生物进行生物防治的相关研究逐渐成为植物保护领域的研究热点之一,例如研发兼具促生及生防功能的高效生物育苗基质[10]。研究发现植物根际促生菌在促进植物生长发育、防治病害、改良土壤微生物生态环境等方面十分重要,可部分替代化肥、农药[11],降低有害成分对环境及人类健康造成的危害,实现农业的可持续发展。
植物根际促生菌(plant growth promoting rhizobacteria,PGPR)是指生存于植物根圈范围内的土壤中或植株根系表层能够促进植物生长、防治病害、增加作物产量的有益细菌的统称[12-13]。研究发现根际促生菌能够改变土壤中难溶性元素的形态,合成植物生长素,同时防止淋失来提高根际周围养分的生物有效性(如固氮、解磷等),从而促进植物对养分的吸收[14],同时还能够在土壤中大量繁殖,与有害微生物产生竞争,并产生次生代谢产物[15-16]抑制病原菌菌丝、寄生病原菌菌丝生长,诱导水稻产生抗性以及定植在水稻茎秆上减少菌丝对叶鞘的侵染等[17-18]。目前已有相关研究将根际促生菌与育苗基质相结合,从而制成兼具促生及生防功能的水稻育苗基质,如张扬等[10]和文春燕等[18]从西瓜和辣椒根际分离得到的根际促生菌可产吲哚乙酸(IAA)和NH3且对尖孢镰刀菌和茄科劳尔氏菌均有生防效果,与普通育苗基质相结合而制成生物育苗基质在苗期及移栽至大田后均可明显促进黄瓜、番茄、辣椒等秧苗的生长。但针对水稻的功能型生物育苗基质的研究还未见报道,故本研究将在前人的研究基础上对可防治水稻纹枯病兼具促生效果的功能型生物水稻育苗基质进行探索,并为其在农业上的应用提供理论与实践基础。
1 材料与方法
1.1 试验材料
1.1.1 供试基质和稻种 基质为本实验室前期筛选出的优势配比水稻育苗基质[19],即(酒糟+秸秆)堆肥60%+蛭石30%+珍珠岩10%,以1.5% 的硫酸水溶液调节至pH 5.0左右。水稻种子是由广西恒茂农业科技有限公司提供,品种为两优1号。
1.1.2 供试菌株 菌株为本实验室前期筛选出的具有固氮解磷能力的菌株,分别为:LY5枯草芽孢杆菌(),LY11解淀粉芽孢杆菌(),X2摩拉维亚假单胞菌(),X3沙芬西芽孢杆菌(),X8绿针假单胞菌(),水稻纹枯病病原菌由河南农业大学植保学院提供。
1.1.3 LB 培养基 蛋白胨10 g,酵母粉5 g,NaCl 10 g,去离子水1 000 ml,pH 7.2 ~ 7.4,121 ℃ 高压灭菌20 min。
1.2 试验设计
水稻催芽:室内晾晒2 ~ 3 d的水稻种,用20% 盐水选种,去除秕子及杂物,清水洗去种子表面的盐分。水浸催芽,定期换水。待种子吸水膨胀出芽2 mm时,摊晾,备用。
拮抗促生菌悬液的制备:将已活化的拮抗促生菌接种于LB液体培养基,30 ℃、170 r/min振荡培养36 h,4 000 r/min离心10 min,用无菌水重悬–离心洗涤3次后,重悬于无菌水中,调节其浓度为108/ml。
病原菌悬液的制备:将已经活化的病原菌接种于PDA平板上,28 ℃ 静置培养5 d,待菌丝布满平板用无菌涂布棒将菌丝刮下并充分搅碎,用无菌水调节其浓度为105/ml。
本试验分别设置以下7个处理,T1(最适配比基质+病原菌)、T2(最适配比基质+菌LY5+病原菌)、T3(最适配比基质+菌LY11+病原菌)、T4(最适配比基质+菌X2+病原菌)、T5(最适配比基质+菌X3+病原菌)、T6(最适配比基质+菌X8+病原菌)、T7(普通商品基质+病原菌),将菌悬液等量均匀喷洒于相应处理中,每盘50 ml,对照处理喷洒等量无菌水;3 d后喷洒病原菌悬液于相应处理中,每盘80 ml,每个处理重复3次。按照常规生产方式装盘育苗,均匀撒种。用育苗盘为580 mm´280 mm´30 mm带孔育苗盘,将基质均匀平铺于盘中,每盘播种芽谷130 g,均匀喷水保持基质含水量达到饱和状态并维持厚度约3 cm播种后覆土,覆土厚度0.11 cm。湿润覆土后覆膜保温保湿。各处理随机摆放,保持生长环境一致。生长第22天采样。
1.3 测试指标与测定方法
1)采用平板对峙法确定5株根际促生菌对水稻纹枯病病原菌的抑菌率。挑取5株促生菌落于LB培养基进行纯化,后用无菌涂布器均匀涂于PDA培养基培养待用,取已活化的病原菌接于PDA平板中央,28 ℃ 培养24 h,采用对峙法将该5株根际促生菌的菌株点接在距病原菌菌片20 mm处,每皿接种1个菌株,对称放于两侧。同时设对照(不接菌),28 ℃ 培养6 d。每个梯度设3个重复。
抑菌率(%)=(对照病原菌直径–与拮抗菌对峙的病原菌直径)/对照病原菌直径´100%
2)植株农艺性状:株高、茎粗用直尺测量;地上地下部干重采用烘干法测定;壮苗指数= 茎粗/株高´全株干重。
3)根系测定:根系总长、根系总面积、根系平均直径、根系总体积和根尖总数用根系扫描仪(EPSON EXPERSSION 1680型)测定;根系活力的测定采用Leagene植物根系活力定性检测液(TTC法)检测[20];SPAD值采用SPAD-502叶绿素仪测定。
4)植株氮磷钾含量测定参照《土壤农化分析》[21]:用浓硫酸-H2O2消煮,分别用凯氏定氮法、钼蓝比色法和火焰光度计法测定氮磷钾的含量。
5)植株超氧化物歧化酶(SOD)测定参考Fridovich[22]方法,过氧化物酶(POD)测定参考Liang 等[23]方法,过氧化氢酶(CAT)测定参考Aebi[24]方法,丙二醛(MDA)酶活性采用南京建成生物工程研究所提供的酶试剂盒进行测定。
1.4 数据处理及分析
采用Excel 2003和 Origin 8.5软件进行数据计算及作图;采用IBM SPSS Statistics 20进行数据统计分析,LSD和Duncan法进行差异显著性检验(< 0.05);各指标间采用Pearson法进行相关性分析。
2 结果与分析
2.1 五株根际促生菌对水稻纹枯病病原菌的抑菌率
采用平板对峙法确定5株根际促生菌对水稻纹枯病的抑菌率,如表1可知,5株促生菌对水稻纹枯病均有抑制作用,其中LY11的抑菌率最高,与其他4株促生菌相比,提高了1.23%、3.08%、3.85%、4.89%,其次是LY5;X8的抑菌率相对较低,为35.31%。

表1 分离菌株对水稻纹枯病病原菌生长的抑制作用
2.2 不同处理对植株病情防治的效果
从表2可得,不同处理对水稻基质育苗效果影响显著。T3处理较T1处理的每盘出苗数显著增加了110.41%,而发病率显著降低了89.32%;T3处理较T7处理在每盘出苗数、发病率方面虽无显著差异,但每盘出苗数增加了4.16%,而发病率降低了12.53%。其次是T4处理,在每盘出苗数、发病率方面与T3、T7处理差异均不显著。
2.3 不同处理对植株农艺性状及干物质重的影响
不同处理的水稻幼苗的农艺性状及干物质重见表3。由表3可知,与T1处理相比,其他处理的株高、茎粗、SPAD值、干物质重以及壮苗指数均显著增加(<0.05)。其中,T2 ~ T7处理的水稻株高比T1处理显著增加6.43% ~ 13.00%,茎粗比T1处理显著增加3.97% ~ 17.86%,SPAD值增加了57.71% ~ 121.19%,植株壮苗指数增加了15.73% ~ 19.10%。与T1处理相比,T3、T6处理的植株百株地上部干重、百株地下部干重、百株全株干重分别显著增加了34.80%、28.81%,7.92%、5.74% 和 25.83%、21.19%。T3处理的茎粗、百株地下部干重、百株全株干重以及T6处理的株高均显著高于T7市售育苗基质处理(<0.05)。
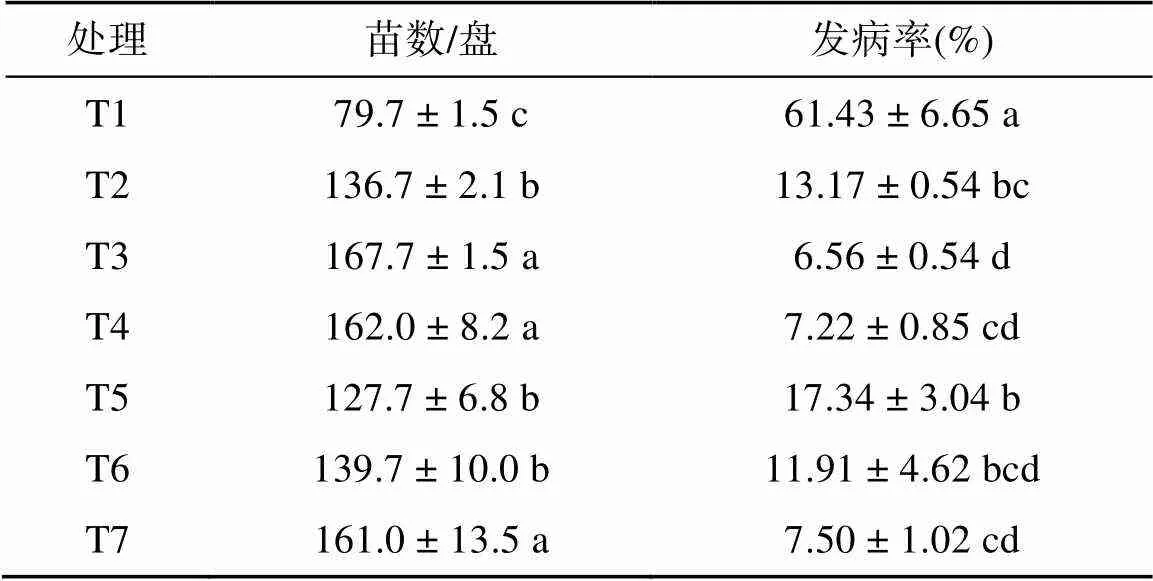
表2 不同处理对植株病情防治的效果
注:同列小写字母不同表示处理间差异显著(<0.05),下同。
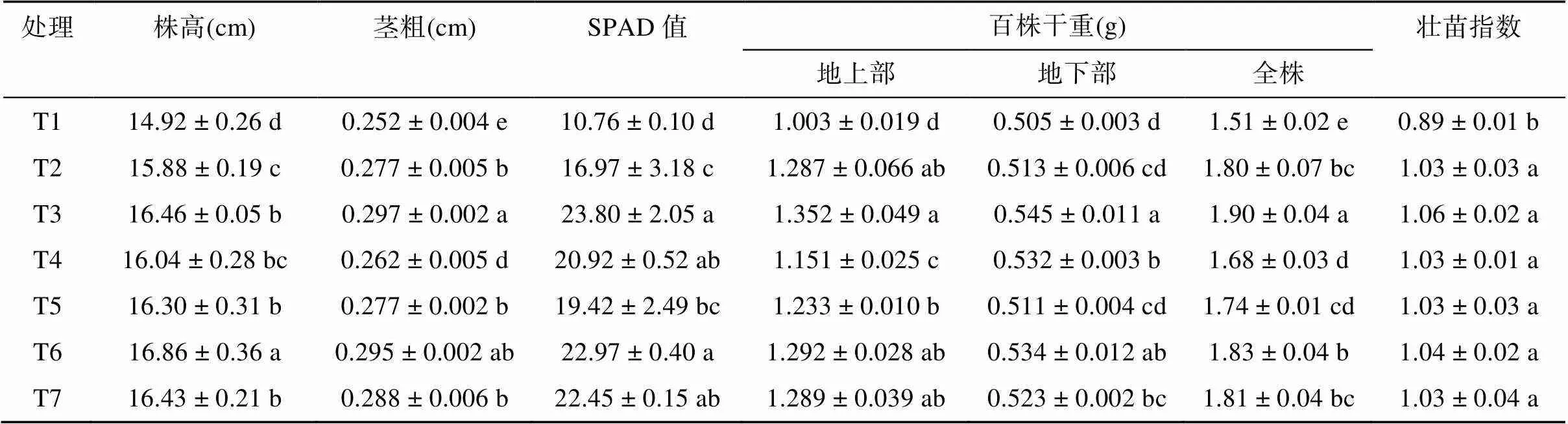
表3 不同处理对植株农艺性状及干物质重的影响
2.4 不同处理对植株根系的影响
不同处理对植株根系各指标的影响如表4所示。T2 ~ T7处理的植物根系的各指标显著高于T1处理(<0.05),增幅分别为36.62% ~ 147.01%、108.52% ~ 216.71%、94.12% ~ 158.82%、10.77% ~ 37.31%、50.00% ~ 133.33%、97.39% ~ 284.92%,且T3处理效果最好,T6处理次之。与T7处理相比,T3、T6处理的根系活力、根系总表面积、根系平均直径以及根系总体积均显著增加,增幅分别为16.67% ~ 68.02%、6.21% ~ 66.61%,且T3处理的根尖数显著高于T7处理。与T2、T4、T5、T6处理相比,T3处理的植物根系各项指标均有所提高,部分指标达到显著水平。T6处理的植物根系各项指标显著高于T2处理,根系活力、根系总表面积、根系平均直径以及根系总体积均显著高于T4、T5处理。
2.5 不同处理对植株养分含量的影响
不同处理对植株养分含量各指标的影响如图1所示。植株地上部氮、钾含量高于地下部,与T1处理相比,T2 ~ T7处理的植株地上和地下部的氮磷钾含量均增加,且地上部和地下部的氮含量以及地上部磷含量差异达到显著水平(<0.05)。其中T3处理的植株地上和地下部氮钾含量最优,T6处理次之,均高于T7处理。与T7处理相比,T3、T6处理植株地上和地下部氮含量分别增加了13.99%、5.66% 和26.21%、12.40%,植株地上和地下部钾含量分别增加了6.54%、2.69% 和0.13%、0.07%,且T3处理植株地上部氮钾含量以及T3、T6处理地下部氮含量与T7处理间差异达显著水平(<0.05)。在植株地上部和地下部磷含量方面,T2、T3、T6处理均显著高于T7处理,分别提高32.25%、45.75%,49.44%、58.17% 和87.20%、68.88%。
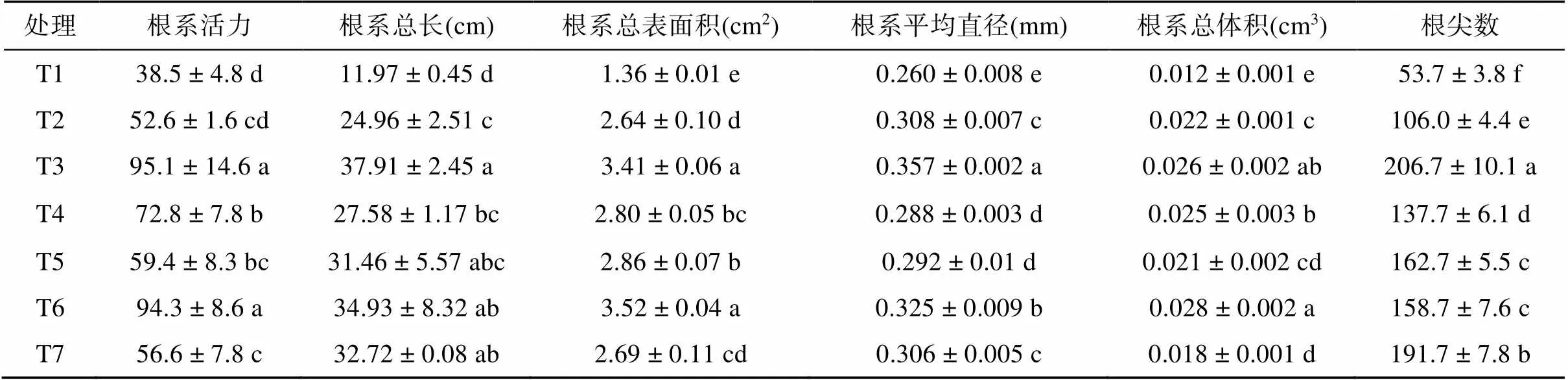
表4 不同处理对植株根系的影响
2.6 不同处理对植株体内酶的影响
不同处理对植株体内酶活性的影响如表5所示,由表可知T1 ~ T6处理的SOD、POD、CAT酶的活性均显著高于T7处理,提高幅度为27.08% ~ 122.72%、16.09% ~ 48.15%、53.33% ~ 233.85%,且POD、SOD和CAT活性在T3处理最高,并显著高于其他6个处理,其中POD活性在T1和T4处理之间差异不显著,T5和T6处理之间差异不显著。对MDA含量,T1处理为最高,T7处理为最低,与T7处理相比,T1 ~ T6处理的MDA含量增加了1.1 ~ 5.1倍,其中T3处理显著低于T2、T4、T5,与T6处理差异不显著。
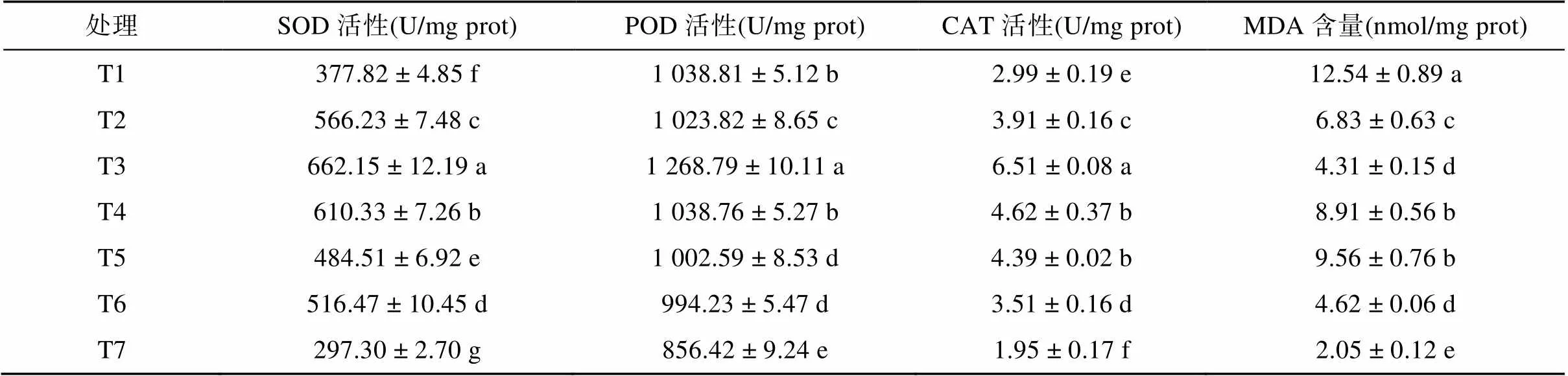
表5 不同处理对植株体内酶活性的影响
3 讨论
近年来,随着生态农业的不断发展,关于根际促生菌促进植物生长及防治土传病害的研究开始被报道[13]。本试验处理中的5株促生菌对水稻纹枯病均具有较高的抑制率,其中LY11的抑菌率最高,这与卢钰升[25]等人研究结果相类似。植物根际促生菌不仅能防治病害、改良土壤微生物生态环境,其生长代谢活动也能促进或调节植物生长,提高植物的出苗率[11]。本研究结果发现,添加根际促生菌的处理对水稻纹枯病在实际育苗中有明显的抑制作用,且提高了水稻的出苗率,水稻纹枯病发病率降低可能是因为根际促生菌能够竞争生态位或底物[15],同时诱导植物产生防御反应,使其产生抗菌活性物质,包括酶类、细菌素、脂肽类、挥发性物质[16]抑制病菌分生孢子萌发和附着胞形成[17],阻止病原菌侵入。
其中防御酶体系是植株在受到外界伤害如高温、干旱、盐碱化、病原菌入侵等时,植物细胞自发形成的抵御外界伤害的主要酶保护系统[26]。近年来的诸多研究结果均表明,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等抗氧化酶活性与植株的抗病性密切相关[27]。本研究中添加病原菌之前先添加本研究所筛选出的拮抗促生菌的相应处理的抗氧化酶活性显著增加,可能是因为SOD能够将真菌细胞在生长和分化之间的过渡时期产生部分活性氧发生歧化反应,形成H2O2和O2,H2O2进一步被CAT和POD等分解[8],抑制菌核的形成,降低病原菌的活力,提高水稻的抗性,同时削减水稻体内氧化作用,维持活性氧的平衡,防止过量的活性氧导致水稻体内的膜脂过氧化,减少膜系统损伤。丙二醛(MDA)作为膜脂过氧化的主要产物之一,可与膜上蛋白质结合,导致蛋白质分子间和分子内产生交联,严重损失和破坏细胞膜系统,MDA含量高低反映了膜脂的损伤程度[28],其在机体内的积累会对细胞产生毒害作用。本研究中,添加病原菌使植株细胞膜受到损害,从而促使植株体内MDA含量升高,而添加菌株LY11等拮抗促生菌使植株体内抗氧化酶活性提高从而降低了其相应处理植株体内的MDA含量。
同时相关研究发现根际促生菌通过抑制病原菌的生长,减少植物病害的发生,从而间接促进植物生长。如朱震等人[29]的研究结果表明,菌株XZ-173,对番茄青枯病具有较好的拮抗效果,同时可以显著促进番茄幼苗生长。本研究结果发现,添加根际促生菌的处理在株高、茎粗、SPAD值、百株全株干物质重、壮苗指数、根系活力、根系总长、根平均直径、根尖数等方面的作用效果高于对照组。可能因为根际促生菌除了通过在植物幼根表面定殖时形成一层均匀的保护层,保护了病原菌的侵染位点,减低了侵染机会[18],间接促进植物生长外,还能分泌外源激素物质,增加植物初生根、次生根和不定根的数量来改变植物的根系形态结构[30],为作物地上部的生长打下基础。此外,水稻根际促生菌分泌的生长素、赤霉素、铁载体等植物生长促生物质[14]能够提高对铁镁等中微量元素的吸收,有利于作物叶绿素的形成并促进光合作用的进行,增加有机物质的积累,为水稻固氮和吸收养分提供能量。同时本实验室前期研究表明促生菌能够提高植物碳氮代谢过程中的关键酶,具有固氮解磷作用,从而使株高、茎粗等明显增加。其中T3处理效果最显著,这可能是因为根际促生菌对土壤中非寄生性根际有害微生物与有害病原微生物起到生防作用,促进植物矿质元素的吸收和利用,可产生利于植物生长的代谢产物,从而促进植物生长发育。
4 结论
5株拮抗促生菌与所筛选出的最适配比水稻育苗基质相结合,之后再添加水稻纹枯病病原菌,进行水稻育苗,所得水稻幼苗体内的抗氧化酶活性提高,发病率降低,同时提高了水稻农艺性状及干物质重、壮苗指数,明显改善根系活力和形态结构,提高了水稻的养分含量,且(酒糟+秸秆)堆肥60%+蛭石30%+珍珠岩10%+解淀粉芽孢杆菌()作为高效生物水稻育苗基质效果最优。
[1] 关强, 蒲瑶瑶, 张欣, 等. 长期施肥对水稻根系有机酸分泌和土壤有机碳组分的影响[J]. 土壤, 2018, 50(1): 115–121.
[2] 周梦琳, 夏园, 刘尧, 等. 水稻纹枯病菌不致病菌株基因组重测序以及致病力相关基因分析[J]. 植物病理学报, 2017, 47(6): 756–766.
[3] 吴志明, 钟敏, 鹿承建, 等. 新型农抗N2粗提物对水稻纹枯病菌细胞膜和抗氧化功能的影响[J]. 核农学报, 2018, 32(4): 700–707.
[4] 朱名海. 我国南繁区水稻纹枯病菌和稻瘟病菌的遗传多样性研究[D]. 广州: 华南农业大学, 2016.
[5] 伏荣桃, 王剑, 卢代华, 等. 水稻纹枯病发生与防治技术[J]. 四川农业科技, 2016(11): 32–33.
[6] 乔静. 水稻纹枯病发病因素及综合防治方法研究[J].农业科学, 2019, 2(2): 25–26.
[7] Wang C, Pi L, Jiang S F, et al. ROS and trehalose regulate sclerotial development in Rhizoctonia solani AG-1 IA[J]. Fungal Biology, 2018, 122(5): 322–332.
[8] 韩永强, 文礼章, 侯茂林. 水稻施用硅肥对稻纵卷叶螟幼虫保护酶和解毒酶活性的影响[J]. 应用昆虫学报, 2016, 53(3): 482–490.
[9] 杨帆, 孟远夺, 姜义, 等. 2013年我国种植业化肥施用状况分析[J]. 植物营养与肥料学报, 2015, 21(1): 217–225.
[10] 张杨, 王甜甜, 孙玉涵, 等. 西瓜根际促生菌筛选及生物育苗基质研制[J]. 土壤学报, 2017, 54(3): 703–712.
[11] 李剑峰, 杨鑫, 张淑卿, 等. 2种植物内生固氮菌对燕麦种子萌发及幼苗生长的效果[J]. 西南农业学报, 2015, 28(6): 2465–2468.
[12] Abbasi M K, Sharif S, Kazmi M, et al. Isolation of plant growth promoting rhizobacteria from wheat rhizosphere and their effect on improving growth, yield and nutrient uptake of plants[J]. Plant Biosystems - an International Journal Dealing With All Aspects of Plant Biology, 2011, 145(1): 159–168.
[13] Krey T, Caus M, Baum C, et al. Interactive effects of plant growth-promoting rhizobacteria and organic fertilization on P nutrition of Zea mays L. and Brassica napus L[J]. Journal of Plant Nutrition and Soil Science, 2011, 174(4): 602–613.
[14] 刘泽平, 王志刚, 徐伟慧, 等. 水稻根际促生菌的筛选鉴定及促生能力分析[J]. 农业资源与环境学报, 2018, 35(2): 119-125.
[15] Prabhukarthikeyan S R, Keerthana U, Raguchander T. Antibiotic-producing Pseudomonas fluorescens mediates rhizome rot disease resistance and promotes plant growth in turmeric plants[J]. Microbiological Research, 2018, 210: 65–73.
[16] 徐婷, 朱天辉, 李姝江, 等. 贝莱斯芽孢杆菌YB15β-葡聚糖酶的抑菌作用与基因克隆[J]. 中国生物防治学报, 2014, 30(2): 276-281.
[17] 沙月霞, 隋书婷, 曾庆超, 等. 贝莱斯芽孢杆菌E69预防稻瘟病等多种真菌病害的潜力[J]. 中国农业科学, 2019, 52(11): 1908–1917.
[18] 文春燕, 高琦, 张杨, 等. 含PGPR菌株LZ-8生物育苗基质的研制与促生效应研究[J]. 土壤, 2016, 48(2): 414–417.
[19] 张林利, 吴大霞, 刘晔, 等. 酒糟等农业废弃物的堆肥化及水稻育秧基质研发[J]. 土壤, 2019, 51(4): 682–689.
[20] 胡敏, 贺德先. 小麦根系活力的昼夜变化及最佳取样和测定时间[J]. 麦类作物学报, 2011, 31(6): 1094– 1098.
[21] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
[22] Fridovich I. Superoxide radical and superoxide dismutases[J]. Annual Review of Biochemistry, 1995, 64(1): 97–112.
[23] Liang Y C, Sun W C, Si J, et al. Effects of foliar- and root-applied silicon on the enhancement of induced resistance to powdery mildew in Cucumis sativus[J]. Plant Pathology, 2005, 54(5): 678–685.
[24] Aebi H E. Catalase//Bergmeyer H U. ed. Methods of enzymatic analysis[M]. Weinheim: Verlag Chemie, 1974: 273–280.
[25] 卢钰升, 顾文杰, 蒋瑞萍, 等. 解淀粉芽孢杆菌GB58对水稻纹枯病的防效及菌剂载体筛选[J]. 中国农学通报, 2017, 33(11): 119–125.
[26] Sumayo M S, Kwon D K, Ghim S Y. Linoleic acid-induced expression of defense genes and enzymes in tobacco[J]. Journal of Plant Physiology, 2014, 171(18): 1757–1762.
[27] 梅小飞, 王智荣, 阚建全. 荧光假单胞菌防治果蔬病害的研究进展[J]. 微生物学报, 2019, 59(11): 2069– 2082.
[28] 郭天荣, 陈丽萍, 冯其芳, 等. Al、Cd胁迫对空心菜生长及抗氧化特性的影响[J]. 核农学报, 2015, 29(3): 571-576.
[29] 朱震, 张国漪, 徐阳春, 等. 产脂肽菌株发酵生物有机肥的生物防治与促生作用研究[J]. 土壤学报, 2012, 49(1): 104–110.
[30] Cassán F, Vanderleyden J, Spaepen S. Physiological and agronomical aspects of phytohormone production by model plant-growth-promoting rhizobacteria (PGPR) belonging to the genus azospirillum[J]. Journal of Plant Growth Regulation, 2014, 33(2): 440–459.
Study on Effect of Biological Rice Breeding Substrate with Antagonistic Function of Rice Sheath Blight
QI Xiuxiu1, WEI Chang1, ZHANG Linli1, LIU Xiaodan1, YANG Yanxia2, JIANG Ying1*, MA Chao3*
(1 College of Resources and Environmental Science, Henan Agricultural University, Zhengzhou 450002, China; 2 Xiping Agricultural Technology Extension Center, Xiping, Henan 463900, China; 3 Anhui Key Laboratory of Farmland Ecological Conservation and Pollution Control, College of Resources and Environment, Anhui Agricultural University, Hefei 230036, China)
Rice sheath blight is one of the common soil-borne diseases of rice. To develop a biological rice breeding substrate to prevent and control rice sheath blight and promote rice growth, 5 rhizosphere growth-promoting bacteria with nitrogen fixation and phosphorus removal functions were selected, including LY5 (), LY11 (), X2 (), X3 () and X8 (). Based on the determination of the inhibition rate, the 5 bacteria were mixed with pathogenic bacteria of rice sheath blight, and then the functional biological rice breeding substrates were developed on the basis of the most suitable substrates screened in the laboratory, and a pot experiment was conducted to verify the effects of the developed 5 substrates on the incidence rate of rice sheath blight, growth of rice seedlings and in vivo resistance-related enzymes in rice by comparing with a commercial rice breeding substrate (CK). The results showed that the 5 rhizosphere growth-promoting bacteria all had the antagonistic effect on the pathogen of rice sheath blight with the inhibition rate from 35.31% to 40.20%. Compared with CK, the 5 rhizosphere growth-promoting bacteria all reduced the incidence rate of rice sheath blight, among of which, LY11 treatment significantly reduced the incidence rate by 89.32% and increased the number of emergence per plate by 110.41%. The 5 rhizosphere growth-promoting bacteria increased rice stem diameter, underground dry matter weight of 100 plants, dry matter weight of 100 plants, root activity, total root surface area, average root diameter, total root volume and root tip number, among of them, compared with CK, LY11 treatment significantly increased the above indexes by 3.13%, 4.21%, 4.97%, 68.02%, 26.77%, 16.67%, 44.44% and 7.82%, respectively. Compared with CK, the 5 rhizosphere growth-promoting bacteria significantly promoted the uptake of nitrogen, phosphorus and potassium by rice seedlings, increased significantly the activities of superoxide dismutase, peroxidase and catalase and the content of malondialdehyde in rice seedlings by 27.08%-122.72%, 16.09%-48.15%, 53.33%-233.85% and 110.24%-511.71%, respectively. Therefore, the 5 rhizosphere growth-promoting bacteria have good antagonistic effect against rice sheath blight pathogens andhas the best comprehensive effect, it lays a theoretical and practical basis for developing the high efficient biological rice breeding substrate with growth-promoting and bio-control functions.
Rice sheath blight; Antagonistic growth-promoting rhizobacteria; Nursery substrate; Root activity; Enzyme activity
S435.111
A
10.13758/j.cnki.tr.2021.03.009
戚秀秀, 魏畅, 张林利, 等. 兼具水稻纹枯病拮抗功能的生物水稻育苗基质效果研究. 土壤, 2021, 53(3): 505–511.
国家自然科学基金项目(42077050)和安徽省重大科技专项(18030701188)资助。
(JY27486@163.com;chaoma@ahau.edu.cn)
戚秀秀(1995—),女,河南永城人,硕士研究生,主要从事资源利用与植物保护研究。E-mail: qixiuxiu0318@163.com

