克劳氏芽孢杆菌BC-G21 发酵培养基的优化
韦祥银
(润盈生物工程(上海)有限公司,上海 201700)
克劳氏芽孢杆菌(Bacillus clausii)属于革兰氏阳性细菌,可产生芽孢,属于嗜碱杆状细菌,产过氧化氢酶和氧化酶,可降解明胶和淀粉、还原硝酸盐。克劳氏芽孢杆菌产生的碱性蛋白酶在清洁剂、丝绸脱胶、皮革工业、食品工业、制药行业、摄影行业及生活垃圾处理等领域有重要的应用价值[1-3]。克劳氏芽孢杆菌作为碱性蛋白酶天然分泌的优势菌株之一,有着重要的应用前景及价值[4-5]。
克劳氏芽孢杆菌除了产碱性蛋白酶,还具有益生菌功能,其产生的芽孢具有很强的抗逆性,具有耐酸、耐碱和耐胆盐特性,可顺利通过人体胃、胆汁,到达肠道后萌发,刺激人体免疫反应,可用于治疗儿童和成人腹泻和便秘问题[6-8]。
本文利用单因素试验、正交试验、最陡爬坡试验和响应面法对克劳氏芽孢杆菌BC-G21 的培养工艺和培养条件进行优化研究,得到克劳氏芽孢杆菌BC-G21 的最佳发酵培养基组成和培养条件,为克劳氏芽孢杆菌发酵研究提供一定参考依据。
1 材料与方法
1.1 材料
克劳氏芽孢杆菌BC-G21,润盈生物工程(上海)有限公司研发中心实验室菌种库提供。
芽孢发酵基础培养基:葡萄糖5 g/L、蛋白胨10 g/L、氯化钠0.5 g/L、磷酸氢二钾0.3 g/L、氯化钙3 g/L、七水硫酸镁0.25 g/L、一水硫酸锰0.05 g/L、pH调至中性。
改良的LB 培养基:蛋白胨10 g/L、氯化钠10 g/L、酵母粉5 g/L、pH 调至9.5。
1.2 仪器和设备
HH-W600 数显恒温三用水箱,常州中捷实验仪器制造有限公司;百伦BLBIO15 型发酵罐,上海百伦生物科技有限公司;SKY-2102C 恒温培养振荡器,上海苏坤实业有限公司;DNP-9082 电热恒温培养箱,上海精宏实验设备有限公司;1 mL 和200 μL 移液器,德国Eppendorf 公司。
1.3 方法
1.3.1 种子培养
一级种子:BC-G21 甘油管接入改良LB 液体培养基中,置于37 ℃振荡培养箱中,培养24 h。
二级种子:将活化后的菌种按体积比2%接种到装有50 mL 改良的LB 液体培养基的250 mL 三角瓶中,置于37 ℃振荡培养箱中,培养24 h。
1.3.2 三角瓶发酵及芽孢活菌数计数
上述二级种子按2%体积分数接种至装有200 mL液体LB 改良培养基的250 mL 三角瓶中,置于37 ℃振荡培养箱中,培养36 h。发酵培养液利用连续梯度稀释方法进行稀释,计数试管于80 ℃水浴10 min 后迅速冷却,加至提前倒置好的改良LB 固体培养基上进行涂布计数。
1.3.3 培养基优化
以芽孢发酵基础培养基作为起始培养基,选择添加量为5 g/L 的葡萄糖、蔗糖、乳糖、海藻糖、果糖、麦芽糖、麦芽糊精、玉米淀粉、小麦淀粉以及糖蜜单一碳源作为碳源,进行碳源优化实验;选择添加量为10 g/L 蛋白胨(骨蛋白胨)、胰蛋白胨、大豆蛋白胨、酵母浸膏、酵母粉、鱼蛋白胨、硫酸铵、脱盐乳清粉、酪蛋白胨以及乳清粉进行单一氮源优化实验;进行三角瓶实验,置于37 ℃振荡培养箱中,培养36 h,进行发酵液芽孢有效活菌计数,初步确定培养基成分。
在上述优化后的培养基基础上,添加10 g/L 的大豆蛋白、小麦蛋白、土豆蛋白、花生蛋白、豌豆蛋白、棉籽饼粉、玉米浆粉、玉米浆液以及豆粕粉的粗料,进行三角瓶试验,置于37 ℃振荡培养箱中,培养36 h,进行发酵液芽孢有效活菌计数,初步确定培养基成分。
1.3.4 发酵培养基组分比例优化
针对上述优化结果,选择效果最好的碳源、氮源和粗料3 种因素进行最陡爬坡试验、中心组合设计(Central Composite Design,CCD)、响应面拟合优化分析,得到最适合添加量。
1.3.5 三角瓶培养条件优化
对初始pH、接种量和培养温度3 因素进行优化设计试验,确定克劳氏芽孢杆菌BC-G21 较优的三角瓶培养条件。
1.3.6 发酵罐方法验证
摇瓶发酵培养基配方和培养条件优化确定后,进行10 L 的小试发酵放大试验,接种装有10 L 培养基的15 L罐中,恒温37 ℃、搅拌180 r/min、通气1.2 m3/h、添加0.2%消泡剂,培养36 h,取样检测发酵液芽孢有效活菌数,验证优化后的培养基配方及培养条件。
1.2 数据处理
所有发酵培养基摇瓶试验均重复3 次,10 L 罐试验共重复6 次,数据结果取平均数。试验数据利用WPS-2016 软件进行数据汇总分析。发酵培养基主要成分比例响应面预测分析、方差分析利用Design Expert 8.0 软件进行分析预测。
2 结果与分析
2.1 培养基优化结果
2.1.1 碳源优化结果
碳源为微生物生长提供重要的能源和目的产物合成所需的碳成分,最终影响发酵活菌数和目的产物的产量。多种碳源组合有利于菌体和芽孢的均衡生长,但过高的碳源亦不利于芽孢杆菌的芽孢形成。不同碳源对克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数的影响如图1 所示,由图1 可知,在原先芽孢基础培养基上分别添加5 g/L 的葡萄糖、玉米淀粉和麦芽糊精为碳源时,克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数较高,因此以三者为考察因素进行正交实验,结果见表1。
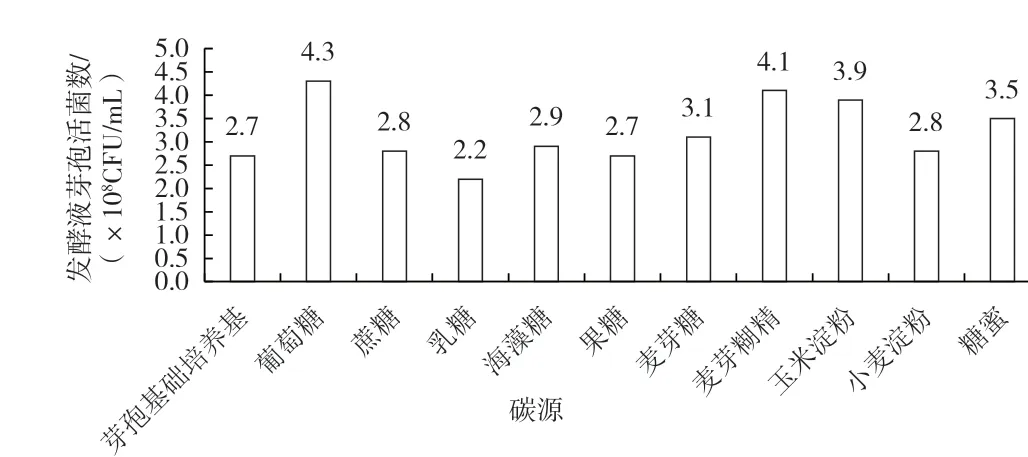
图1 不同碳源对克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数的影响
由表1 可知,碳源正交实验的极差值葡萄糖>玉米淀粉>麦芽糊精,最优组合为葡萄糖15 g/L、玉米淀粉40 g/L 和麦芽糊精16 g/L。按照此优化组合进行碳源添加,克劳氏芽孢杆菌BC-G21 发酵液芽孢有效活菌数最高可达9.1×108CFU/mL。
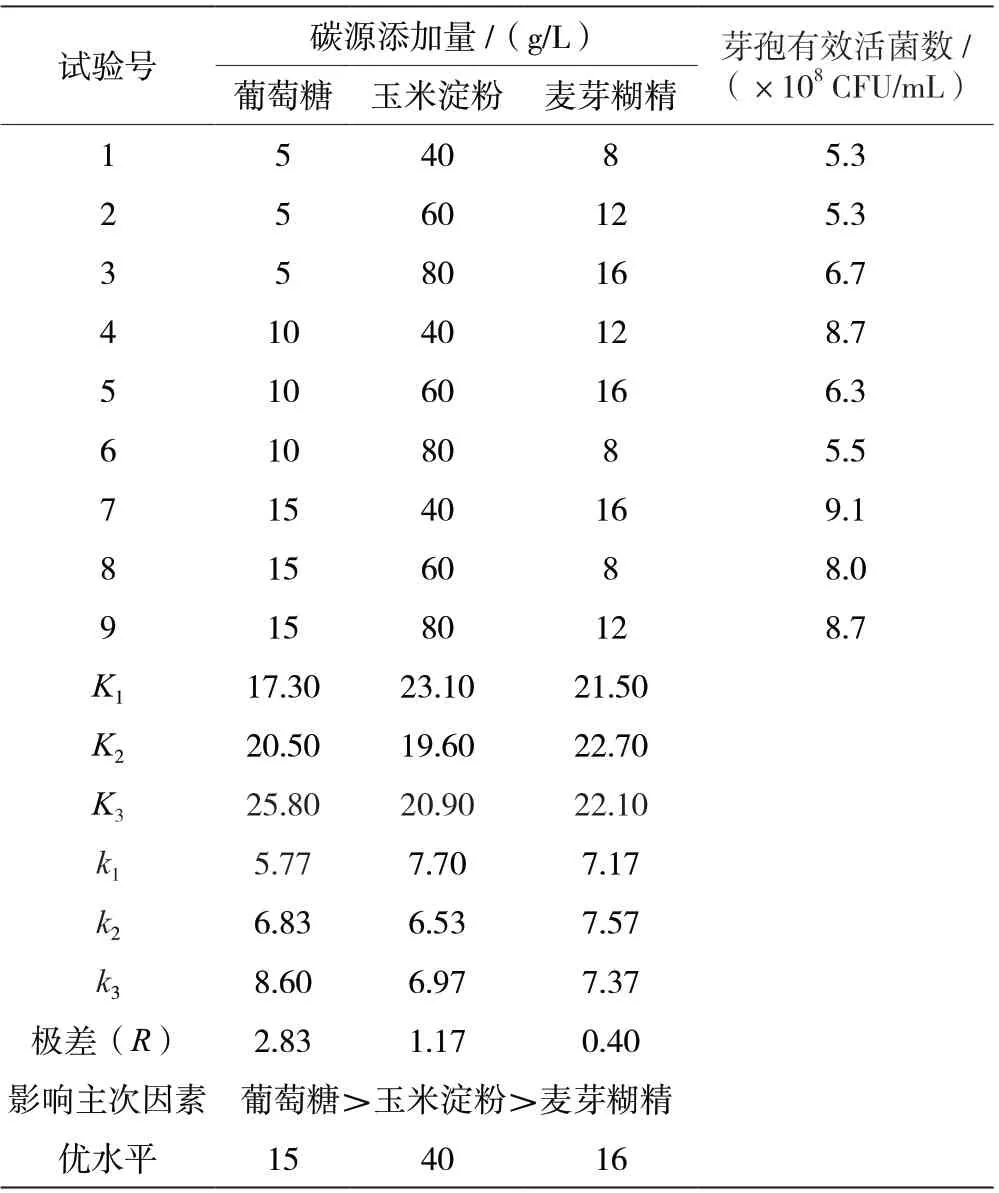
表1 克劳氏芽孢杆菌BC-G21 碳源优化正交实验
2.1.2 氮源优化结果
氮源可提供菌体生长所需的蛋白质、调节发酵过程中pH,同时还提供无机盐和生长因子。氮源分为有机氮源和无机氮源,无机氮源菌体利用速度快,发酵利用周期较短。有机氮源利用速度较慢,时效周期较长,有利于芽孢杆菌发酵芽孢的形成,但来源相对不稳定,成分复杂。所以可利用多种氮源进行组合,减少原料带来的影响。不同氮源(10 g/L)对克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数的影响如图2所示,由图2 可知,在优化好的芽孢基础培养基上分别添加10 g/L 的蛋白胨、大豆蛋白胨和酵母粉为氮源时,克劳氏芽孢杆菌BC-G21发酵液芽孢活菌数较高,以三者为考察因素做正交实验,结果见表2。
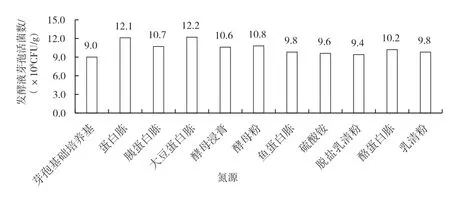
图2 不同氮源对克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数的影响
由表2 可知,氮源正交实验的极差值蛋白胨>大豆蛋白胨>酵母粉,最优组合为蛋白胨10 g/L、大豆蛋白胨30 g/L 和酵母粉5 g/L。按照此优化组合进行氮源添加,克劳氏芽孢杆菌BC-G21 发酵液芽孢有效活菌数最高可达1.15 ×109CFU/mL。
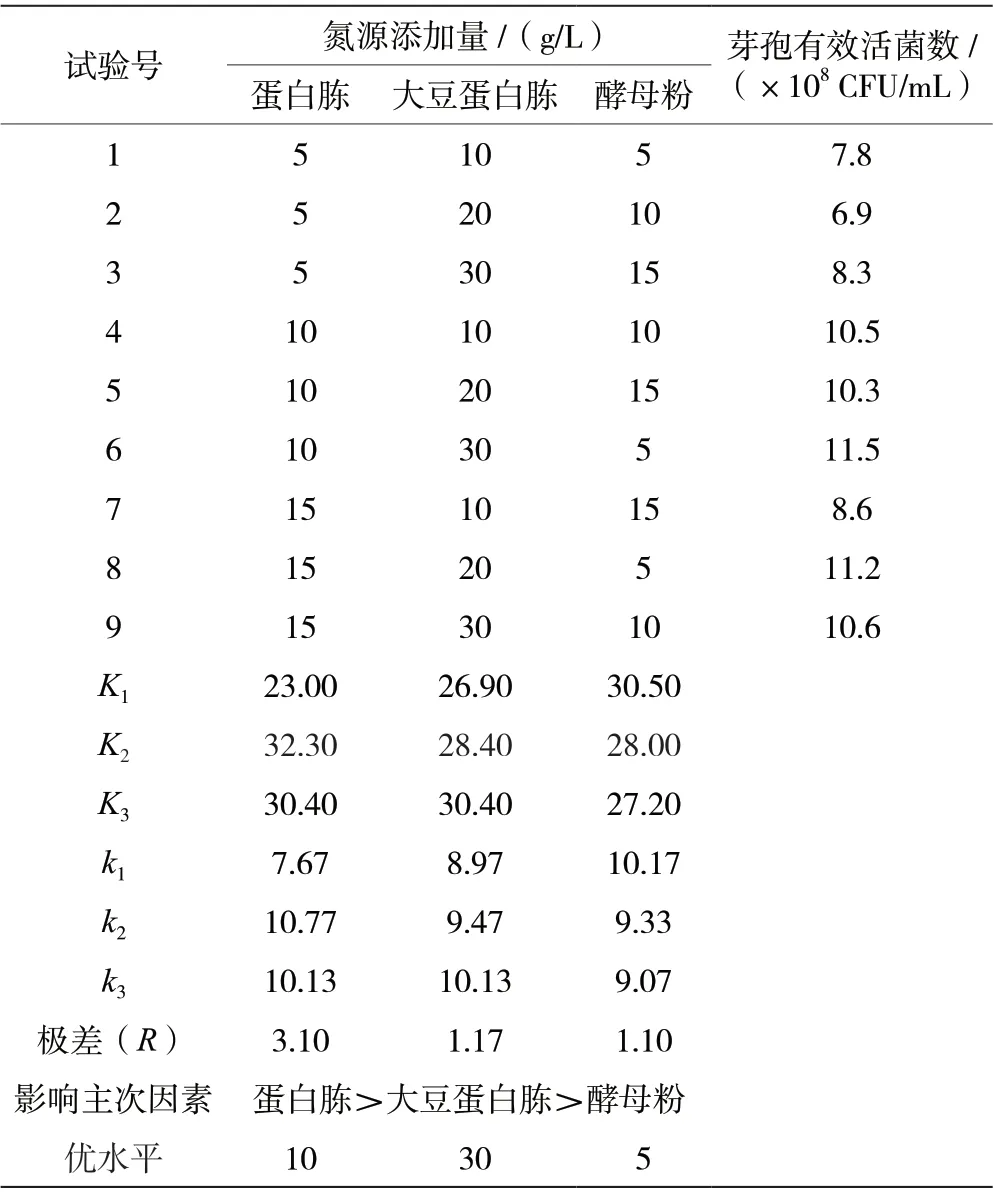
表2 克劳氏芽孢杆菌BC-G21 氮源优化正交实验
2.1.3 粗料优化结果
不同植物原料(如大豆、玉米、小米、豌豆和土豆等)、不同水解程度的蛋白粉或浆液体等粗料,发酵时沉降较多、成分复杂、营养丰富、各种固体介质对芽孢杆菌后期芽孢的形成有较好作用,缩短发酵后期[9-10]。不同的粗料组合有利于营养平衡,减少原料来源不稳定因素给发酵带来的影响。不同粗料对克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数的影响如图3 所示,由图3 可知,在优化好的芽孢基础培养基上分别添加10 g/L 的小麦蛋白、土豆蛋白和大豆蛋白为粗料时,克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数较高,以三者为考察因素做正交实验。
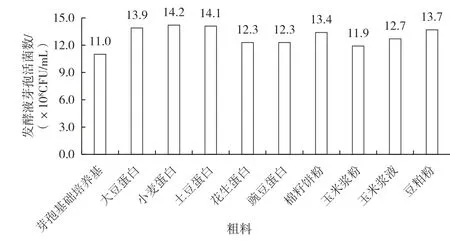
图3 不同粗料对克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数的影响
由表3 可知,粗料正交实验的极差值土豆蛋白>小麦蛋白>大豆蛋白,最优组合为土豆蛋白10 g/L、小麦蛋白15 g/L 和大豆蛋白15 g/L。按照此优化组合进行粗料添加,克劳氏芽孢杆菌BC-G21 发酵液芽孢有效活菌数最高可达1.48×109CFU/mL。
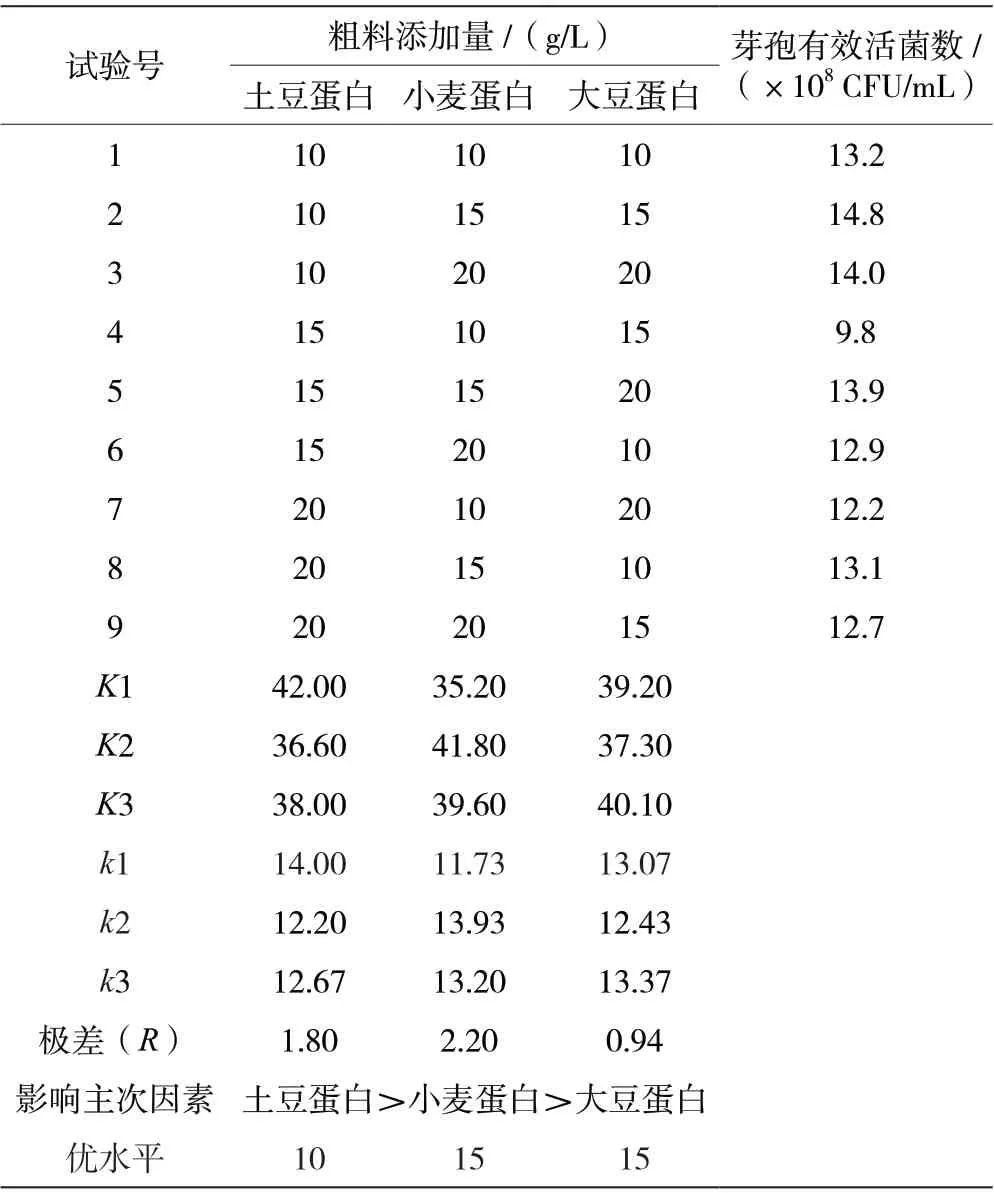
表3 克劳氏芽孢杆菌BC-G21 粗料优化正交实验
2.2 响应面效应法优化克劳氏芽孢杆菌BC-G21 主影响成分的比例
基于2.1 试验确定葡萄糖、蛋白胨和土豆蛋白为3 个最显著因素,据此进行最陡爬坡试验,确定中心点。
由表4 结果可知,随着3 个显著因素(葡萄糖、蛋白胨和土豆蛋白)的添加量增加,克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数先上升后下降,在葡萄糖添加量15 g/L、蛋白胨添加量11 g/L 和土豆蛋白添加量为13 g/L 时(第5 组),克劳氏芽孢杆菌BC-G21发酵液芽孢活菌数达到最大。基于第5 组3 个显著因素的添加量为中心点,以葡萄糖添加量(A)、蛋白胨添加量(B)和土豆蛋白添加量(C)为自变量,以克劳氏芽孢杆菌BC-G21 芽孢有效活菌数为响应值(Y),利用DX-8.0 软件设计3 因素5 水平的中心组合设计(Central Composite Design,CCD),数据结果如表5 和表6 所示。
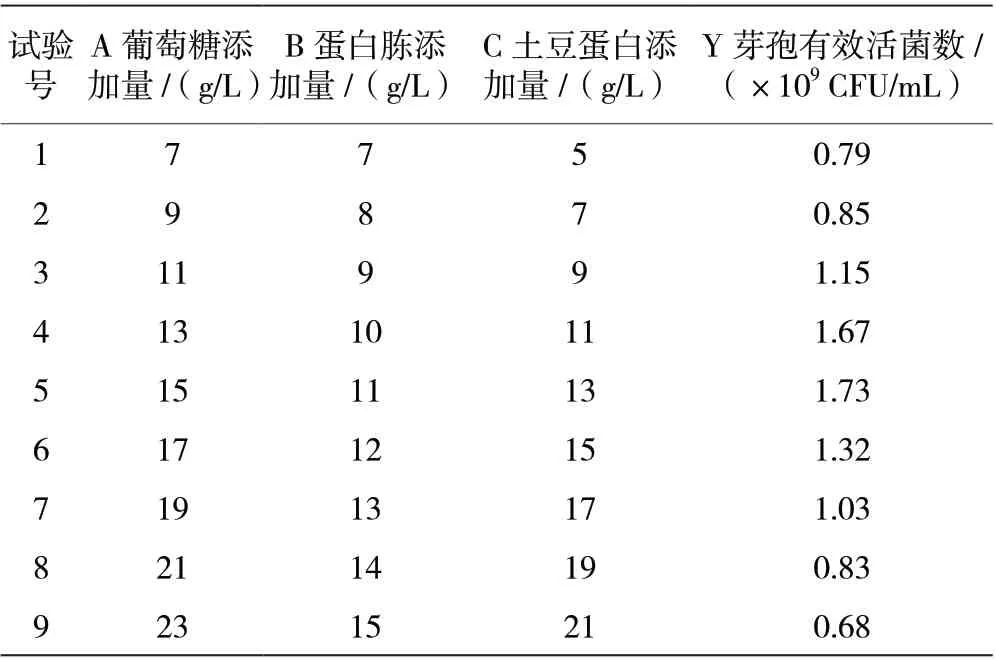
表4 BC-G21 培养基成分最陡爬坡试验设计及结果
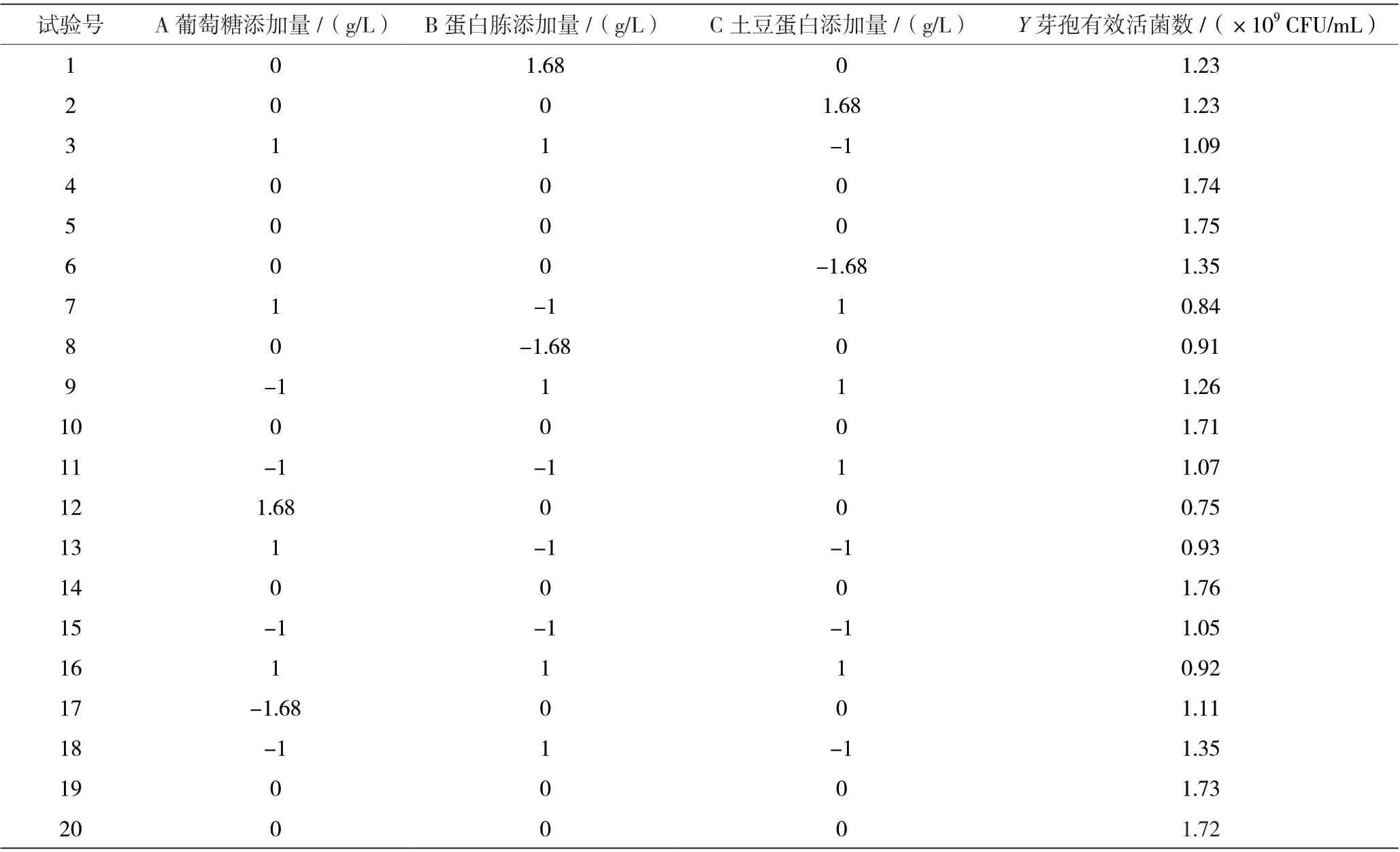
表5 克劳氏芽孢杆菌BC-G21 培养基成分CDD 设计及结果
利用DE-8.0 软件进行结果分析,模型拟合方程为Y=17.35-1.14A+0.93B-0.39C-0.31AB-0.24AC-0.24BC-2.84A2-2.34B2-1.56C2。得到的模型的决定系数是R2为0.998 8,RAdj=0.997 8,RPre=0.995 9,预测度较高。由表6 可知,模型P值<0.0001,说明此模型对于响应值Y影响极显著,可信度较高。模型的失拟项P值为0.765 7 >0.05,影响不显著,说明此回归模型可信,可较好的解释和预测克劳氏芽孢杆菌BC-G21 的芽孢有效活菌数。
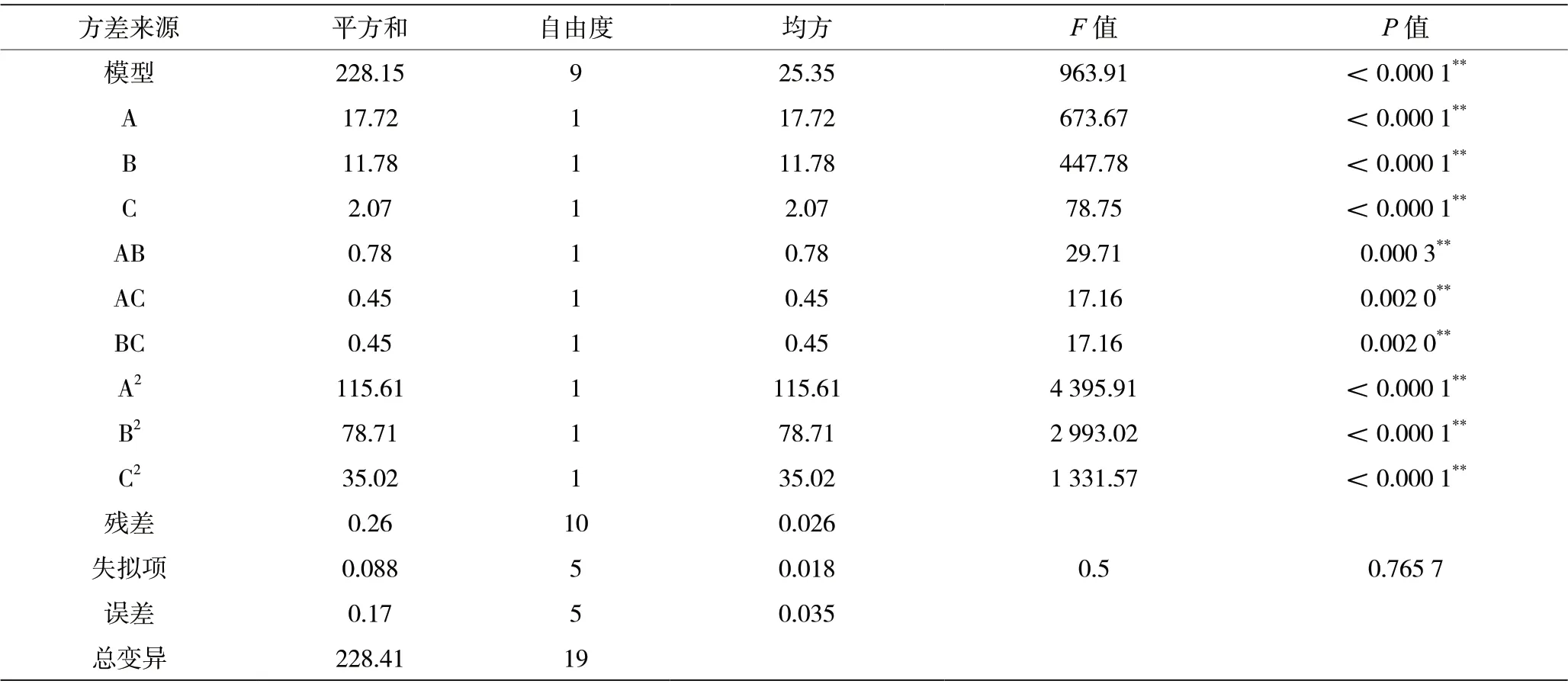
表6 BC-G21 培养基成分响应面结果方差分析
根据拟合方程绘制出响应面三维图见图4。由图4 可知,土豆蛋白与葡萄糖、葡萄糖与蛋白胨、土豆蛋白与蛋白胨对克劳氏芽孢杆菌BC-G21 发酵液芽孢有效活菌数的交互作用显著(P<0.01);在一定范围内,随着土豆蛋白、葡萄糖和蛋白胨浓度的增加,克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数随之增加;当达到最大值后,发酵液芽孢活菌数逐渐下降,进一步说明了3 个因素之间存在交互作用共同影响着克劳氏芽孢杆菌的芽孢数量,只有各因素在合适的添加量时,发酵液的芽孢数量才会达到最大值。
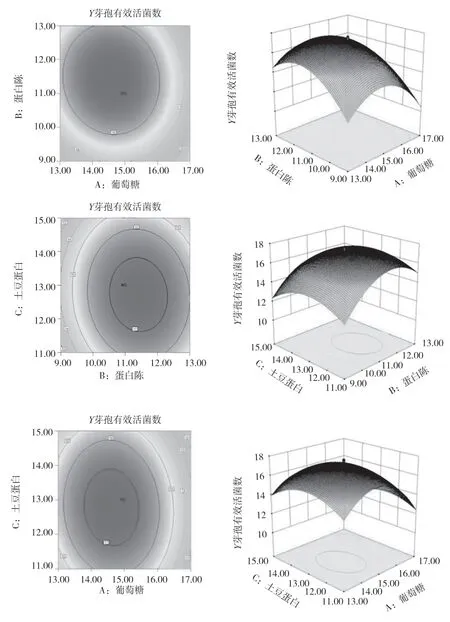
图4 各因素交互作用对芽孢有效活菌数影响的响应面和等高线
利用响应面优化得到克劳氏芽孢杆菌BC-G21的最佳添加量为葡萄糖14.59 g/L、蛋白胨11.44 g/L和土豆蛋白12.75 g/L,其余的培养基按照优化后的量添加。该模型预测的最大值为1.759×109CFU/mL。按照上述优化后的培养基量添加,37 ℃振荡培养箱中培养36 h 后,发酵液芽孢活菌数为1.76×109CFU/mL,可见该模型可较好地预测克劳氏芽孢杆菌BC-G21的发酵芽孢活菌数。
2.3 三角瓶培养条件优化结果
由表7 可知,此试验的培养基发酵条件中3 个主要影响因素的影响顺序为起始pH >接种量>培养温度,最优条件为起始pH 为10.0、接种量为2%、培养温度为37 ℃,在此培养条件下克劳氏芽孢杆菌BC-G21 发酵液芽孢活菌数为1.93×109CFU/mL。
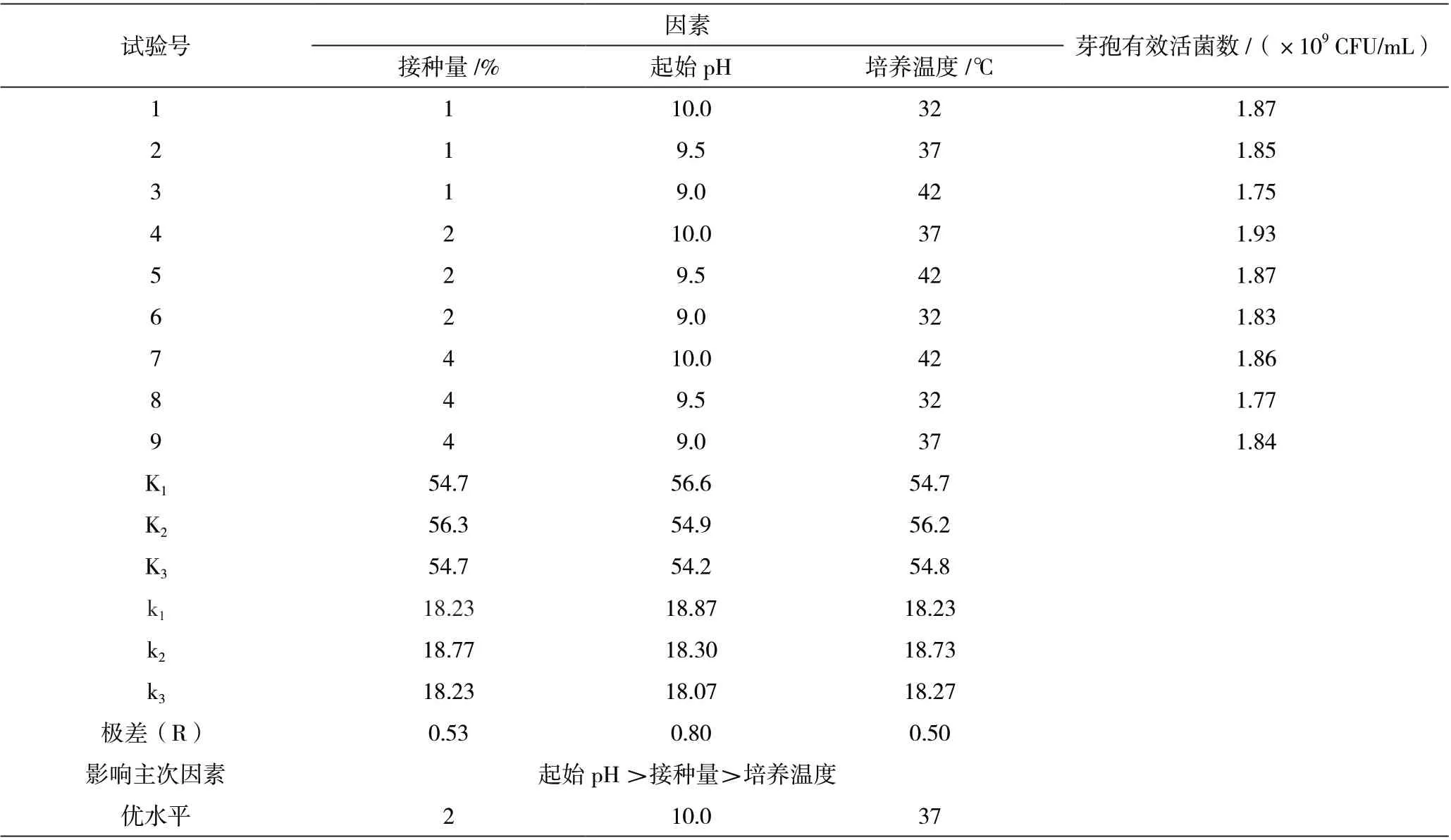
表7 BC-G21 三角瓶培养条件优化设计及结果
2.4 10 L 发酵罐发酵试验结果
上述摇瓶发酵培养基配方和培养条件优化后,进行10 L的小试发酵放大试验,接种装有10 L培养基的15 L 罐中,恒温37 ℃、搅拌180 r/min、通气1.2 m3/h、添加0.2% 消泡剂,培养36 h,取样检测发酵液芽孢有效活菌数,测得发酵液芽孢有效活菌数为3.88×109CFU/mL,较本实验室培养芽孢基础培养基10 L 发酵结果(4.0×108CFU/mL)提高了约10 倍。
3 结论
细菌孢子形成剂具有热稳定性好、生存能力强和通过胃屏障存活率高的特点,利用这些特性可将其用作人类饮食和动物饲料中的益生菌补充剂[11-12]。就全球范围来看,克劳氏芽孢杆菌(Bacillus calusii)与枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)、凝结芽孢杆菌(Bacillus coagulans)、蜡状芽孢杆杆菌(Bacillus cereus)一样,可单独或与其他益生菌组合使用,作为儿童和成人治疗腹泻和便秘的芽孢类益生菌[13-15]。本试验采用正交设计、中心组合设计和响应面分析相结合的方法,确定了最显著因子的最佳添加量,为克劳氏芽孢杆菌高质量、高密度发酵培养芽孢提供一定参考依据。
克劳氏芽孢杆菌BC-G21 高密度培养过程中最优培养基为葡萄糖14.59 g/L、玉米淀粉40 g/L、麦芽糊精16 g/L、蛋白胨11.44 g/L、大豆蛋白胨30 g/L、酵母粉5 g/L、土豆蛋白12.75 g/L 、小麦蛋白15 g/L、大豆蛋白15 g/L、氯化钠0.5 g/L、磷酸氢二钾 0.3 g/L、氯化钙3 g/L、七水硫酸镁0.25 g/L、一水硫酸锰0.05 g/L;最佳培养条件为接种量2%,起始pH 10.0,恒温37 ℃;利用10 L 发酵罐验证发酵,采用优化后的发酵培养基和发酵条件进行培养,克劳氏芽孢杆菌BC-G21的芽孢有效活菌数达到了3.88×109CFU/mL,较本实验室芽孢基础培养基10 L 发酵芽孢活菌数4.0×108CFU/mL 提高了约10 倍。合理的培养基及合适的培养条件使发酵培养基发酵营养更加均衡、营养更加丰富、发酵结果更加稳定,有利于规模化稳定性生产。

