龙血素A对骨肉瘤MG63细胞增殖、凋亡的作用及机制
刘亚云 张瑾 彭春光 任招娣 廖卫华 邱鹏

【关键词】龙血素A;骨肉瘤;增殖;凋亡;分子机制
骨肉瘤属于骨科中常见肿瘤疾病之一。通过保肢治疗的方式,一定程度上能够提高治愈率,骨肉瘤细胞对化疗药物的敏感程度与骨肉瘤患者的治疗效果以及预后恢复情况存在关系[1]。近几年,关于骨肉瘤化疗药物相关的研究取得了进步,但是依旧存在部分患者对相关化疗药物的敏感性低或者使用一段时间后出现耐药性现象,患者预后恢復较差,并且目前用于治疗骨肉瘤患者的药物,副作用均较大。因此,积极寻找疗效理想,副作用小的药物具有重要意义。龙血素A 是血竭总黄酮中的主要活性成分, 具有活血化瘀、消炎镇痛、促进表皮修复、抗肿瘤等功效[2]。近年来研究显示[3] 多数黄酮类化合物具有明显的抗肿瘤作用,如葛根黄酮可通过上调Fas、Baxm RNA 的表达水平,下调Bcl-2 和上调Bax 蛋白,抑制HL-60 细胞增殖,诱导其凋亡。龙血素A 可通过上调caspase-3 激活Bax/Bcl-xl 线粒体信号通路诱导乳腺癌细胞凋亡[4]。龙血素A 对骨肉瘤增殖、凋亡是否有影响?通过什么机制影响?因此,本次研究主要探讨龙血素A 对骨肉瘤MG63 细胞增殖、凋亡的作用及可能存在的分子机制。
1 资料与方法
1.1 细胞培养以及分组 收集和接种细胞:骨肉瘤MG63细胞株进行培养,观察细胞生长情况,待细胞培养至对数生长期时,获取细胞,并进行计数,再加入完全培养基,再将其配置成浓度为1×105 个/mL 的细胞悬液,开始进行细胞接种,将骨肉瘤MG63 细胞接种于96 孔板中再次进行培养,并向每个孔内加入剂量为100 μL 完全培养基。将培养后的骨肉瘤MG63 细胞,均分为两组,即实验组和对照组,对照组骨肉瘤MG63 细胞仅仅加入完全培养基,实验组骨肉瘤MG63细胞加入不同浓度龙血素A 进行干预。每组分别设置6 个复孔。
加药处理:上述骨肉瘤MG63 细胞经过培养一段时间以后,过夜孵育培养,取出96 孔板,将其置于倒置显微镜,进一步观察细胞培养情况,若细胞出现明显贴壁现象,再将原来培养液清除干净,再分别加入不同浓度的龙血素A 药物进行干预(0,15,30,60,90,120 μmol/L),药物剂量均为90 μL,再加入完全培养液进行培养处理,阴性对照组加入完全培养基90 μL,放入细胞培养箱培养。
1.2 CCK-8 检测细胞增殖 不同浓度的药物处理24 h、48 h、72 h 后, 清除含药物干预的培养基, 各组每孔分别加入CCK8 溶液,干预剂量为10 μL,分别将其置于细胞培养箱5% CO2,37℃继续培养4 h,用酶标仪测波长为450 nm 的OD值,实验重复3 次,取实验结果的平均值作为最终实验结果。
按公式计算生长抑制率= [( 对照组OD -实验组OD)/ 对照组OD]×100%。
1.3 流式细胞仪检测细胞凋亡 取对数生长期的细胞,调整细胞密度,即调整至1×105 个/mL,并将细胞分别接种于六孔板,于每孔加入2 mL 的细胞悬液;次日细胞贴壁后,弃去培养液,加药组沿孔壁小心加入2 mL 含最佳浓度龙血素A培养基溶液,对照组只加入2 mL 的完全培养基,每组设置3个复孔,置CO2 培养箱中继续培养,目的是为了确定最佳作用时间;分别通过细胞收集、细胞洗涤、乙醇固定、细胞重悬及染色;最后采用流式细胞仪进行检测。
1.4 蛋白质印迹法(Western blot) 检测Akt /NF-KB 通路因子(Akt、磷酸化Akt、核蛋白NF-KB) 以及Bax、Bcl-2 蛋白表达 取对数生长期的细胞,以1×105 个/mL 的密度接种于六孔板,每孔加入2 mL 的细胞悬液;次日细胞贴壁后,弃去培养液,实验组沿孔壁小心加入2 mL 含最佳浓度龙血素A培养基溶液,对照组只加入2 ml 的完全培养基,每组设置3个复孔,置CO2 培养箱中继续培养最佳作用时间;进行细胞总蛋白的提取、蛋白浓度测定、SDS-PAGE 电泳、Westernblot 测定。检测与细胞凋亡有关Akt /NF-KB 通路的蛋白:Akt、磷酸化Akt、核蛋白NF-KB、Bax、Bcl2 表达情况。
1.5 观察指标 观察不同浓度干预后在不同时间点的细胞增殖率、细胞凋亡率、Akt /NF-KB 通路因子(Akt、p-Akt、核蛋白NF-KB) 及凋亡蛋白(Bcl-2、Bax) 表达。
1.6 统计学方法 实验每组重复3 次,结果均采用SPSS22.0 软件进行统计分析,定量数据用x±s 形式表示,两样本均数的比较采用t 检验,多样本均数的比较采用方差分析,检验水准为P<0.05。
2 结果
2.1 细胞增殖变化 同时间点,不同浓度药物干预后细胞增殖明显发生变化,药物浓度为60 μmol/L 时,细胞增殖率明显下降(P<0.05),并且呈现一定浓度剂量依赖性;相同浓度下,不同时间点药物干预后,随着时间的延长,细胞增殖率明显下降(P<0.05),即24 h(48 h) 后,细胞增殖明显下降。基于此,后续实验均采用60 μmol/L 进行干预,均干预24 h(48 h),开始检测后续实验指标。详见表1。
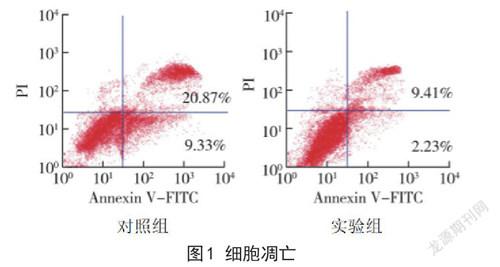
2.2 细胞凋亡 与对照组进行比较,实验组细胞凋亡率明显更低(P<0.05)。详见图1。
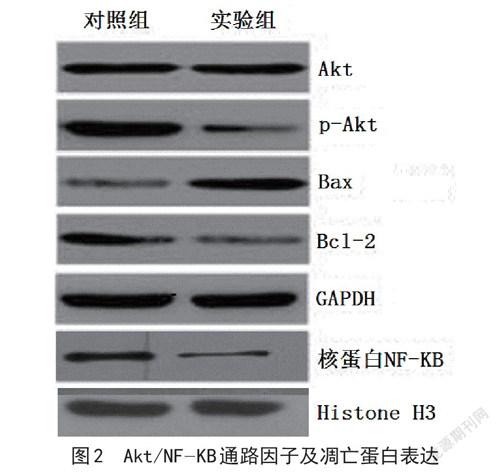
2.3 龙血素A 对骨肉瘤MG63 细胞增殖、凋亡的作用机制与Akt /NF-KB 通路有关 与对照组比较,实验组p-Akt、核蛋白NF-KB、Bcl-2 蛋白表达均明显更低,Bax 蛋白表达明显更高,差异显著(P<0.05),两组Akt 蛋白表达比较,差异不显著(P>0.05)。详见表2、图2。
3 讨论
本次研究主要探讨龙血素A 对骨肉瘤MG63 细胞增殖、凋亡的作用及可能存在的分子机制,首先为了确定龙血素A最佳的干预浓度,分别采用不同浓度0、15、30、60、90、120 μmol/L 龙血素A 进行干预,观察不同浓度对骨肉瘤MG63 细胞增殖的影响,以及同种浓度下,不同干预时间细胞增殖的变化,研究结果显示,60 μmol/L 龙血素A 干预后,细胞增殖率明显下降,并且与90、120 μmol/L 龙血素A 比较,无显著差异,表明龙血素A 作为骨肉瘤患者新型药物,具有一定应用前景[5]。进一步观察60 μmol/L 龙血素A 干预后,骨肉瘤MG63 细胞凋亡情况,发现实验组细胞凋亡率明显低于对照组,提示龙血素A 药物能够明显促进骨肉瘤MG63 细胞凋亡[6]。进一步探讨其可能存在的分子机制,研究发现实验组Akt /NF-KB 通路因子出现明显变化,实验组p-Akt、核蛋白NF-KB、Bcl-2 蛋白表达均明显更低,Bax 蛋白表达明显更高,提示龙血素A 主要通过抑制Akt /NF-KB 通路从而发挥对骨肉瘤细胞增殖的抑制作用及进一步诱导细胞的凋亡[7-8]。Akt /NF-KB 通路可以作为骨肉瘤作用靶点之一。
综上所述,龙血素A 能够明显抑制骨肉瘤MG63 细胞增殖过程,同时进一步诱导细胞凋亡,其主要的分子机制为龙血素A 通过抑制Akt /NF-KB 通路活性,磷酸化Akt,下调核蛋白NF-KB 表达,上调Bax 蛋白表达,下调Bcl-2 蛋白表达,最终抑制骨肉瘤MG63 细胞增殖,以及诱导MG63 细胞凋亡。

