一株山羊源2型溶血性曼氏杆菌的分离鉴定及全基因组序列分析*
芦 彪,张保海,罗梓丹,姚学萍 ,王 印,2,杨泽晓,罗 燕,曹随忠
(1.四川农业大学 动物医学院,四川 成都 611130;2.动物疫病与人类健康四川省重点实验室,四川 成都 611130)
溶血性曼氏杆菌(Mannheimia haemolytica)原称为溶血性巴氏杆菌,有学者根据反刍兽曼氏杆菌和肉芽肿曼氏杆菌等相同分子特征建立曼氏杆菌属,随后溶血性巴氏杆菌被归入曼氏杆菌属并更名为溶血性曼氏杆菌[1]。溶血性曼氏杆菌是一种革兰氏染色为阴性短杆状的条件致病菌,是引起牛、羊等反刍动物呼吸道疾病的主要病原菌之一。一般而言,菌体寄生在宿主的上呼吸道,只有当宿主动物受到外界因素如高温、运输及环境剧烈变化等刺激或其他细菌、病毒等病原微生物感染,导致机体的防御能力下降,菌体才会开始大量繁殖,侵入宿主的下呼吸道引发呼吸道疾病及败血症[2]。目前,山羊的急性呼吸道疾病是危害养羊业的一类重要疾病,主要由细菌、支原体和寄生虫等病原单独或混合感染引起[3-4]。
2019 年10 月,四川江油市某山羊场有大批羊只出现急性呼吸道症状,部分病羊死亡,病死率约为10%。患病山羊临床症状主要表现为呼吸急促,精神萎靡,鼻镜有结痂以及有化脓性鼻液出现,部分患病山羊眼部还有脓性分泌物产生;在疾病发生初期,听诊患病动物呼吸时表现为湿啰音,后期为干啰音;严重者死亡。解剖病死动物后,发现肺脏有明显的充血和出血;肝脏边缘有点状白色坏死灶;气管内存在大量白色泡沫样物质。为了探究此次病死山羊的病原菌,本研究采用常规的细菌分离方法,从病羊的肺脏、肝脏、气管和鼻液中分离病原菌进行鉴定,并对分离菌株的血清型和毒力基因进行分析,同时做药敏试验,从而为该病的临床诊断和预防提供参考依据。
1 材料与方法
1.1 样品来源
样品采自于四川江油市某山羊场的病死山羊,包括肺脏、肝脏组织和气管各2 份及4 份鼻液。
1.2 试验试剂和动物
胰蛋白胨大豆琼脂(TSA)培养基、细菌微量生化鉴定管购自海博生物公司;DL 2000 DNA Marker、2×TaqPCR Master Mix 均购自宝生物工程(大连)有限公司;细菌 DNA 提取试剂盒均购自北京天根生化科技公司;小牛血清购自上海士锋生物公司;药敏纸片购自杭州微生物试剂有限公司;健康昆明小鼠(18±2) g 购自成都达硕实验动物有限责任公司。
1.3 分离菌的培养和纯化
取肺脏、肝脏、气管病变组织和鼻液在无菌环境下分别接种于5% 小牛血清TSA 平板,将培养皿于37 ℃培养16~24 h,观察菌落形态。挑取单个疑似菌落在TSA 平板上继续纯化,之后革兰氏染色并镜检。
1.4 生化试验
将纯化的细菌培养物接种于七叶苷、葡萄糖、阿拉伯糖、蔗糖、麦芽糖、硫化氢、甘露醇、苯丙氨酸脱氨酶和西蒙式枸橼酸盐等微量生化鉴定管,置于37 ℃培养箱内,培养16~18 h 后观察并记录结果。
1.5 动物致病性试验
将健康的昆明小鼠分为5 个试验组和1 个对照组,每组6 只小鼠进行半数致死量(LD50)测定。将3×109CFU/mL 菌液以10 倍稀释到不同的密度梯度,每个试验组对应1 个密度梯度,按0.2 mL/只剂量腹腔注射,对照组注射等量的生理盐水。连续观察2 周并记录小鼠状态和死亡情况,按寇氏法[5]计算LD50。剖检死亡小鼠并分离细菌。
1.6 药敏试验
药敏试验参照CLSI[6]标准,选取12 种药物,做3 个平行对照。挑取纯化后的单个菌落加入LB 液体培养基中,振荡培养过夜,将菌液稀释至适宜密度(1.5×108CFU/mL)后均匀涂布到MH 平板上,用无菌镊子夹取药敏纸片贴于平板平面,37 ℃培养24 h 后,测量各种药敏纸片的抑菌圈直径并判定药敏结果。
1.7 分离菌16S rRNA 基因的扩增及荚膜血清型鉴定
采用细菌16S rRNA 检测引物对分离菌株的16S rRNA 基因进行扩增,预期扩增长度为1 465 bp。反应体系(20 μL):上、下游引物各1 μL,细菌基因组2 μL,2×TaqPCR Master Mix 10 μL,ddH2O 6 μL。反应条件:95 ℃ 5 min;95 ℃30 s,55 ℃ 30 s,72 ℃ 45 s,34 个循环;72 ℃7 min。PCR 产物经1% 琼脂糖凝胶电泳后送至华大基因科技公司测序。
目前世界范围内溶血性曼氏杆菌荚膜血清1、2 和6 型最为流行,血清1 型的荚膜多糖Hyp由N-乙酰甘露糖醛酸和N-乙酰甘露糖胺序列组成,可以促进细菌黏附并抑制免疫细胞的吞噬,从而免疫逃脱;血清2 型的荚膜多糖Core2由具有α 键的N-乙酰神经氨酸的线性聚合物组成,发生免疫逃逸;血清6 型的荚膜多糖TupA组成还未见文献报道[7-9]。根据荚膜多糖的不同,合成溶血性曼氏杆菌荚膜血清型1、2 和6 特异引物对分离菌株进行血清分型(表1)。
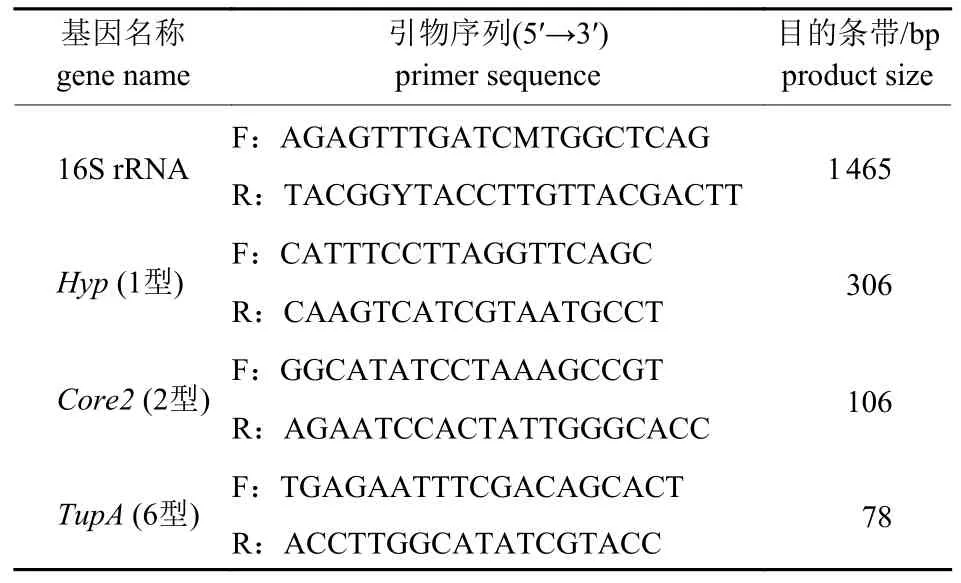
表1 血清型鉴定引物Tab.1 The primer of serotype identification
1.8 分离菌全基因组测序及序列分析
利用Illumina Miseq 测序平台对分离菌株全基因组进行测序,经过原始下机数据处理,使用A5-MiSeq 和 SPAdes 软件对去除接头序列的测序数据进行组装和拼接,使用 Pilon 软件进行碱基校正,从而得到最终的拼接结果。采用Gene-MarkS 软件对分离菌全基因组的蛋白质编码基因进行预测。选择提供KEGG 和COG 注释的通用功能数据库,将预测基因与各功能数据库进行BLAST 比对(blastp,E-value≤1e-6),对于每一条序列的 BLAST 结果,选取score 最高的比对结果(默认identity≥40%,coverage≥40%)进行注释。选取NCBI 上传的18 株相关菌株进行全基因组对比分析,使用MLST (https://pubmlst.org/databases.shtml)数据库测定分离菌株的序列类型,选择在线网站EzBioCloud 的比对工具ANI Calculator (https://www.ezbiocloud.net/tools/ani)与分离菌株对比平均核苷酸一致性(ANI),并基于各个基因组的7 个管家基因进行多基因联合建树分析。基于 VFDB 和CARD 数据库对其携带的毒力基因和耐药基因进行注释。基因组测序工作由上海派森诺生物科技有限公司完成。
2 结果与分析
2.1 细菌的分离培养及镜检
初步分离接种,血平板长出光滑、圆润、半透明菌落,菌落底部可看见溶血环(图1);纯培养后,TSA 培养基上长出了光滑、圆润、透明并呈露珠状菌落。革兰氏镜检为单个或成对分散排列的阴性短杆菌(图2)。
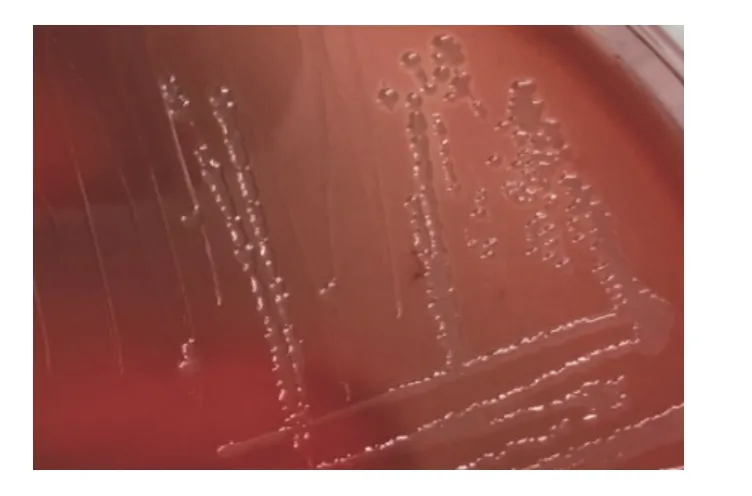
图1 分离菌的菌落特征)Fig.1 The culture characteristics of isolated bacteria
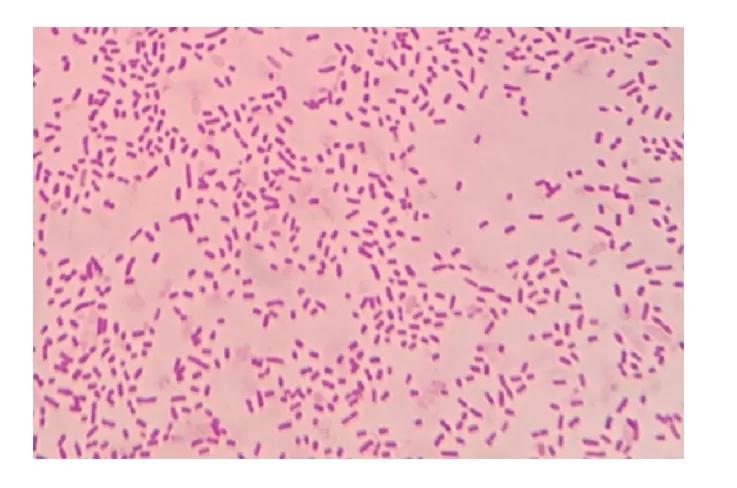
图2 分离菌的革兰氏染色结果(100×))Fig.2 Gram staining of isolated bacteria (100×)
2.2 分离菌株的生化鉴定
分离菌株可以发酵七叶苷、蔗糖、麦芽糖、甘露醇、葡萄糖和阿拉伯糖,发酵糖产酸而不产气;脲酶、靛基质、硫化氢和苯丙氨酸脱氨酶试验为阴性,试验结果符合溶血性曼氏杆菌的生化特性。
2.3 分离菌株致病性试验结果
攻毒6 h 后,部分小鼠精神不振,被毛凌乱,10 h 后小鼠陆续死亡,观察7 d 记录死亡个数并计算LD50。由表2 所示:该病原菌的LD50为4.4×107CFU/mL。剖解死亡小鼠发现肺脏有严重的淤血和出血,伴随肝脏肿大且边缘有白色梗死灶。随后从病死小鼠的肺脏和肝脏分离出与感染菌形态特征相同的菌株。
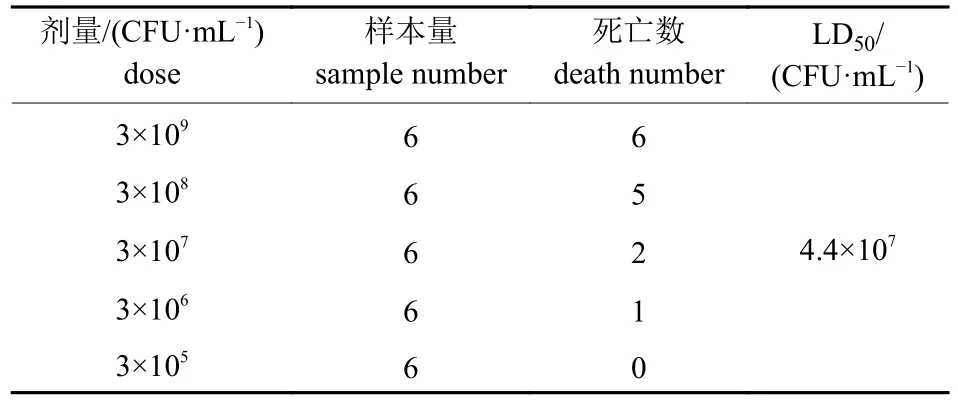
表2 小鼠LD50 的测定结果Tab.2 Determination results of LD50 in mice
2.4 药敏试验结果
选取12 种抗生素对溶血性曼氏杆菌做药敏试验,进行3 组对照试验。结果(表3)表明:溶血性曼氏杆菌对阿莫西林、多西环素、林可霉素、复方新诺明、诺氟沙星、万古霉素和利福平敏感;对头孢曲松、头孢唑林和环丙沙星中度敏感;对红霉素和链霉素耐药。
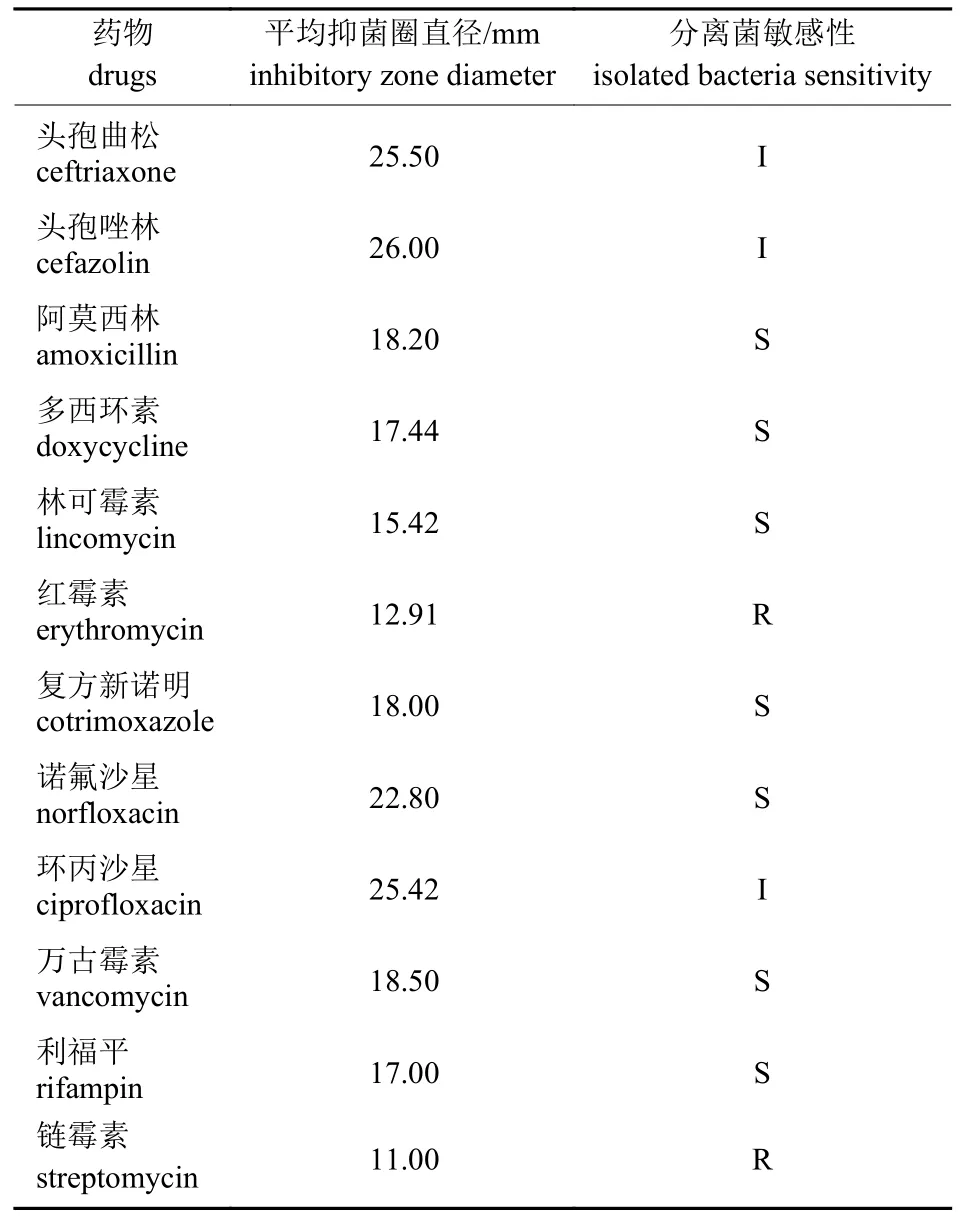
表3 溶血性曼氏杆菌药敏试验结果Tab.3 The results of M.haemolytica drug sensitive test
2.5 分离菌株16S rRNA 基因扩增结果及荚膜血清鉴定结果
根据16S rRNA 基因引物扩增出相应1 465 bp大小的片段(图3)。将测序结果上传至Gen-Bank,获得登录号MN907437.1。将其序列与GenBank 中已发表序列进行BLAST 比对,结果显示:与该菌株相似度较高的均为溶血性曼氏杆菌,且相似性高达99%以上。其中与CP017484.1相似度最高,达99.35%。
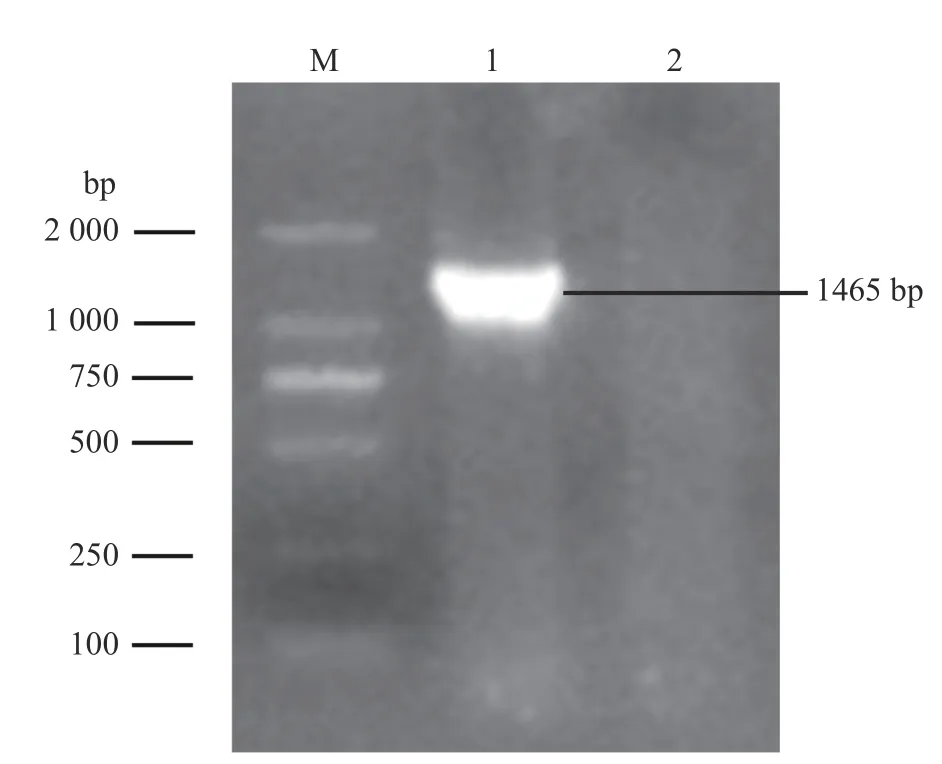
图3 16S rRNA 基因的PCR 扩增)Fig.3 The PCR amplification of the 16S rRNA gene
荚膜血清型鉴定结果显示扩增出Core2(106 bp)基因,Hyp和TupA基因未出现目的条带(图4)。综合分离菌形态特征、理化特性、16S rRNA 基因序列比对和荚膜血清型鉴定结果,证实该分离菌株为2 型溶血性曼氏杆菌。
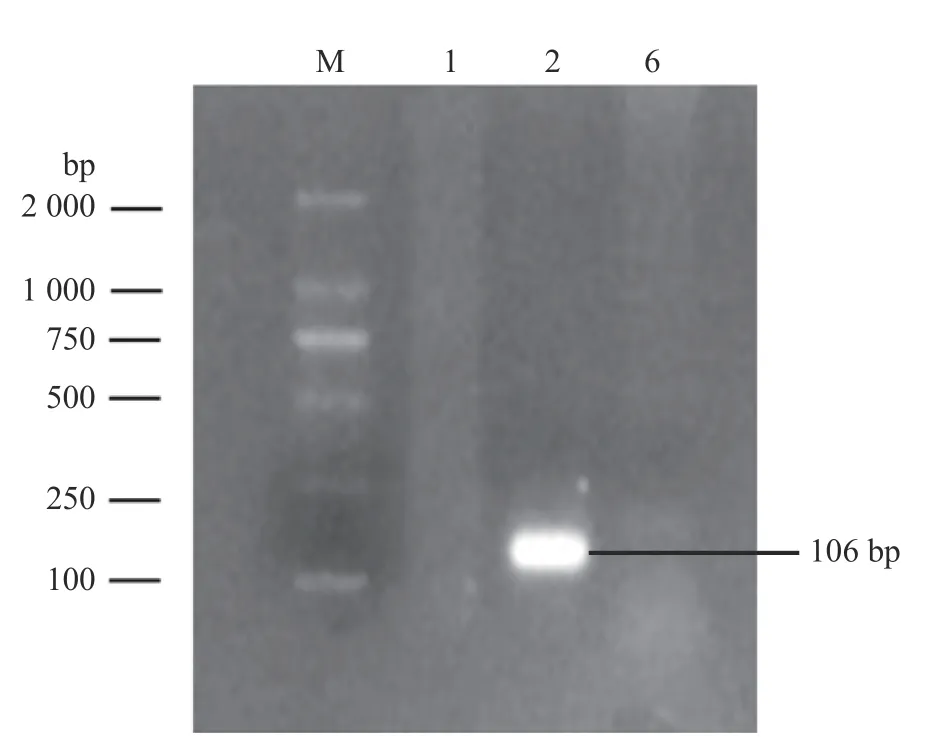
图4 荚膜血清型鉴定的PCR 扩增)Fig.4 The PCR amplification of capsular serotype identification
2.6 分离菌株全基因组基本信息
分离菌株全基因组大小为2 580 488 bp,G+C 含量为41.12%,编码2 610 个基因,占整个序列的88.36%,包含tRNA 52 个,rRNA 6 个。从组装结果来看,Contig 数量为56,该基因组序列的完整性一般。将菌株命名为MHLB002 菌株,组装后的序列以FASTA 形式上传至Genome 数据库,获得登录号为JAAAMS000000000。
2.7 MHLB002 菌株基因组基本特征分析
利用MLST 数据库,基于溶血性曼氏杆菌的adk、aroE、deoD、gapDH、gnd、mdh和Zwf7 个管家基因得到MHLB002 菌株的菌株序列类型为ST-43。选择GenBank 中来源于不同国家、不同宿主以及不同分离部位的18 株溶血性曼氏杆菌与本研究的MHLB002 菌株共同构建系统发育树(图5)。分离菌株与标准菌株M42548 对比,ANI 值为98.45%,与分离自牛源肺脏的美国MH1475 菌株同源性最近,其ANI 值达98.60%。同时与选取的18 株溶血性曼氏杆菌的ANI 值均在98%以上,根据全基因组ANI 值>96%作为同一菌种判定的依据,MHLB002 菌株可明确鉴定为溶血性曼氏杆菌。
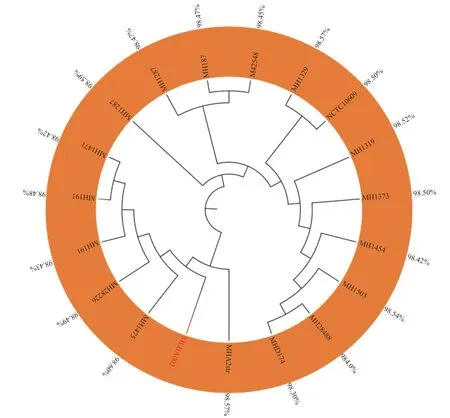
图5 MHLB002 的系统进化树)Fig.5 The phylogenetic tree of MHLB002
2.8 MHLB002 菌株基因功能分析
2.8.1 KEGG 通路分析
经KEGG 数据库分类注释,在MHLB002 菌株基因组中共有1 576 个基因能够找到其参与代谢通路的信息,其中新陈代谢类的基因占比最多,有923 个基因参与细菌的新陈代谢,占注释基因总数的58.57%;其次是代谢加工通路的基因有428 个,参与疾病通路和过程通路的基因分别有88 和93 个;参与代谢系统通路的基因仅有44 个,仅占注释基因总数的2.79%。
2.8.2 COG 聚类分析
与String 数据库进行对比注释,MHLB002 菌株基因组共有2 302 个基因被注释到21 组COG的功能中,有4 组COG 功能未注释到。其中1 743个蛋白与已知蛋白或已知的假设蛋白同源,有559 个蛋白功能未知。用于糖类和氨基酸转运代谢的蛋白数量最多,分别是176 和167 个。COG功能分类图见图6。
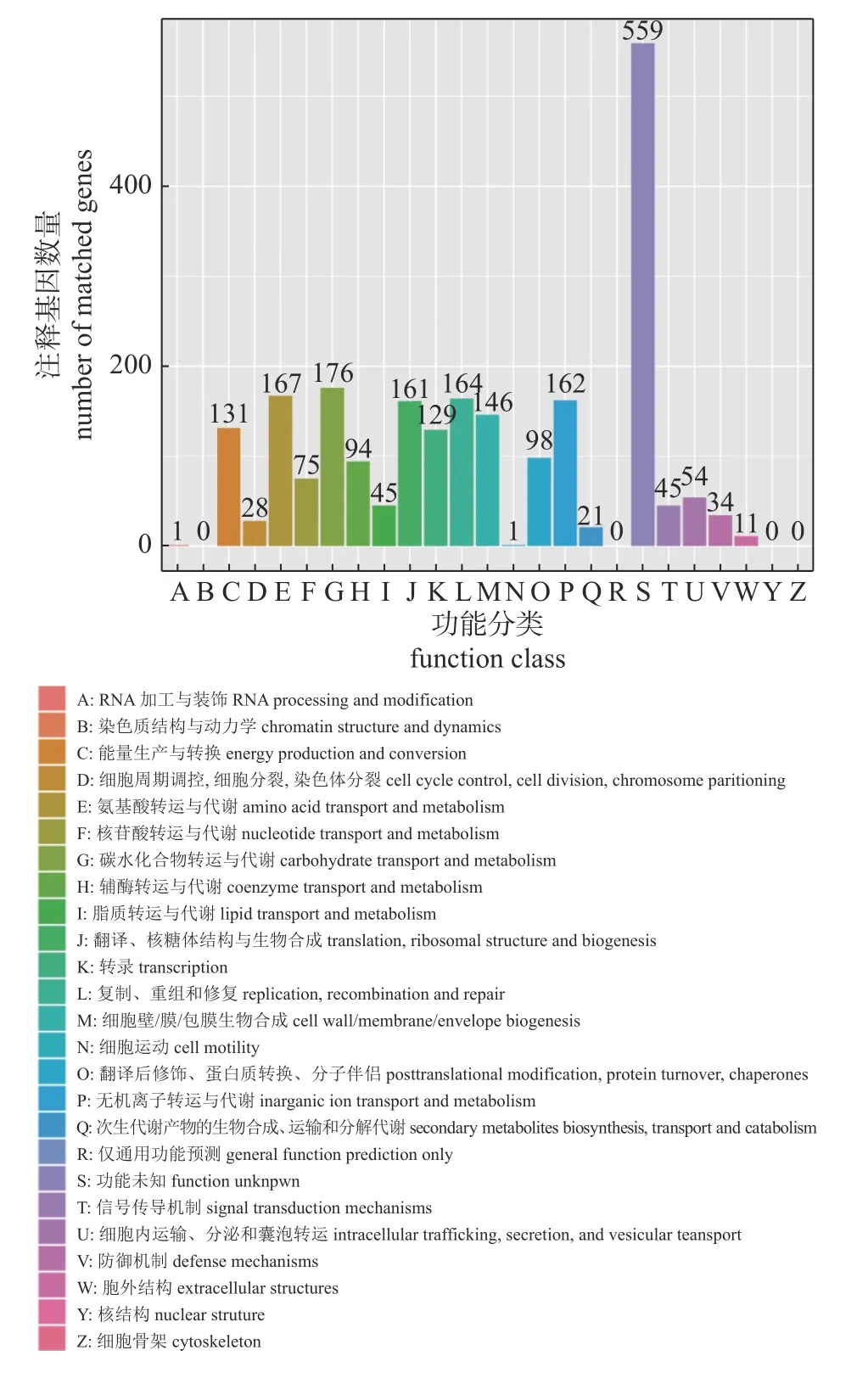
图6 MHLB002 菌株COG 功能分类结果)Fig.6 COG function classification of MHLB002 genes
2.8.3 毒力基因注释
经VFDB 注释和BLAST 比对,选取identity≥90%的结果,共有19 个ORF 编码MHLB002菌株与致病性相关的基因。各个毒力因子的功能存在交叉,可根据其主要作用进行分类(表4)。除了溶血性曼氏杆菌分泌的毒素能够作为毒力因子直接对宿主产生作用之外,其他调控生物膜形成相关的蛋白也能调控毒力因子躲避宿主免疫系统的攻击而间接发挥自身的致病作用。

表4 MHLB002 基因组中与致病性相关的毒力因子Tab.4 Virulence factors associated with pathogenicity in MHLB002 genome
2.8.4 耐药基因注释
经本地比对和BLAST 验证,在MHLB002 菌株基因组中共有9 个ORF 编码多种耐药基因,分别编码β-内酰胺类、氟喹诺酮类、利福霉素类和普拉霉素类耐药基因。其中3 个ORF 编码同一个耐药基因,即EF-Tu。还有部分耐药基因注释为产生抗生素耐药性的外排泵,相关耐药基因注释见表5。
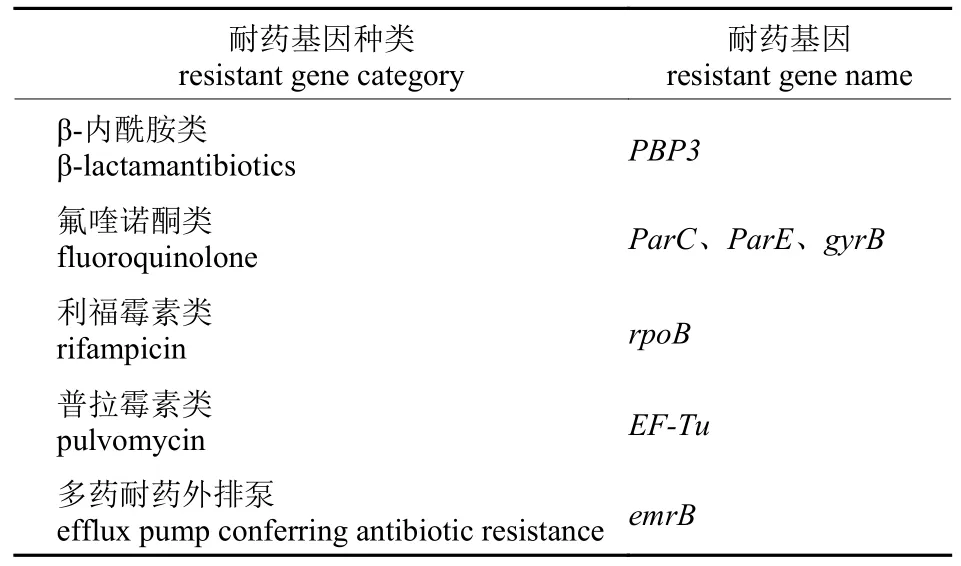
表5 MHLB002 基因组注释的耐药基因Tab.5 Predicted resistance genes on MHLB002 genome
3 讨论
目前,国内外牛源溶血性曼氏杆菌分离鉴定的相关报道较多[8,10-11],而山羊源溶血性曼氏杆菌分离鉴定的相关报道却很少[12]。关于该菌的病原流行病学资料也比较欠缺。本研究在四川地区从患有呼吸道疾病的病死山羊鼻液、气管、肺脏和肝脏中分离出同一种菌,经鉴定为2 型溶血性曼氏杆菌。溶血性曼氏杆菌根据荚膜抗原区分荚膜血清型,目前已报道12 种血清型,不同血清型毒力差别较大[13]。有流行病学资料表明[14]:血清1、2 和6 型在不同宿主之间流行较为广泛,也是引起山羊肺炎较为常见血清型。本试验分别设计血清1、2 和6 型的特异性引物来鉴定分离菌株,确定其为荚膜血清2 型。目前,溶血性曼氏杆菌分离鉴定的相关报道较多,但其血清型鉴定的研究很少,且荚膜血清2 型溶血性曼氏杆菌在山羊体内首次分离。
通过全基因组测序,MHLB002 菌株序列注释表明其强大的代谢能力和复杂的蛋白功能,而通常基因组的代谢能力越强,细菌适应环境的能力越强。在基因组比较分析中,菌种鉴定和同源性研究使用基于全基因组的ANI 分析既准确又高效。与传统的DNA-DNA 杂交试验(DNA-DNAhy-bridization,DDH)相比,95% ANI 值与70%DDH 水平效果类似[15]。通过进化树可以看出:MHLB002 菌株与已知的溶血性曼氏杆菌ANI 值均较高,且差异性小,表明亲缘性很近,可以明确鉴定MHLB002 菌株为溶血性曼氏杆菌。本研究分离到的MHLB002 菌株是独特存在的序列,Pub-MLST 数据库仅收录到1 株ST-43 的菌株,是2012 年分离自牛源脾脏的中国117 株,目前还没有关于该型的流行病学报道。因此,本研究对溶血性曼氏杆菌病的系统流行学调查和疾病防控有一定的借鉴意义。
通过与VFDB 数据库比对,发现MHLB002 菌株株携带19 种与致病性相关基因。其中白细胞毒素和脂多糖是溶血性曼氏杆菌的主要致病因子[16]。白细胞毒素基因lktC对白细胞的毒性作用是诱导白细胞发生细胞凋亡和细胞溶解,从而导致组织坏死,最终肺部病变[17]。脂多糖基因htrB具有内毒素作用,可以释放肿瘤坏死因子和诱导机体低血压发生休克[18]。在MHLB002 菌株的毒力因子中,外膜蛋白ompA、PlpC和gs60等基因、延伸因子基因tufA和Ⅳ型菌毛基因apfA提供黏附及侵袭能力;内毒素kdsA、lpcA、rffG和yhxB等基因破坏机体中由β 防御素和阴离子多肽组成的抗微生物屏障,从而使溶血性曼氏杆菌从通常的共生状态中释放出来致病[17]。细菌的铁摄取通过转铁结合蛋白fbpA和tbpB等基因来转移宿主的转铁蛋白和乳铁蛋白[19],血红素结合酶hemB和hxuC等基因通过转移宿主的血红素来达到溶血特性。免疫回避bexD、gnd、pgi和IS1016-V2等基因保护细菌免受吞噬、补体的抑菌作用以及免疫监视,从而协助细菌避开宿主免疫系统的清除。在这些毒力因子中,多种基因调控生物膜的形成,它们共同构成了抗生素的第一道防线机制[20]。
有研究[21-22]显示:细菌基因组中的外排泵基因是产生多重耐药性的重要因素之一,外排泵基因与细菌的多重耐药性呈正相关。本研究分离到的MHLB002 菌株仅含有1 个外排泵基因,同时有编码β-内酰胺类、氟喹诺酮类、利福霉素类和普拉霉素类的耐药基因共5 种,为非多重耐药菌株,与研究结果相符。为验证MHLB002 菌株的耐药基因型,本试验采用12 种抗生素对其进行药物敏感性试验。结果显示:对头孢类、β-内酰胺类、磺胺类、喹诺酮类和利福霉素类药物敏感,对部分大环内酯类和氨基糖苷类药物耐药,药敏结果与耐药基因不相符。刘艳红[23]和胡凡[24]研究发现:细菌的表型耐药率高,相关基因的检测率却较低。出现这种现象的原因一方面是与宿主免疫力和抗生素的选择压力有关[25];另一方面是耐药基因在启动表达时,启动子发生突变,使基因在细菌内无法表达,从而失去耐药性,例如大多数RpoB突变后会增加利福平的最低抑菌浓度[26]。因此对由某一菌种引起的疾病治疗需要结合药敏试验结果合理给药。这些研究及其成果可以治疗山羊溶血性曼氏杆菌病,减少其对山羊养殖的经济损失,同时有利于抵制多重耐药菌的出现。
4 结论
本研究对成都江油市养殖的自然感染发病且出现呼吸道疾病典型临床症状的山羊进行病原菌分离纯化,获得分离菌株MHLB002 菌株,通过形态学和分子生物学鉴定该菌为溶血性曼氏杆菌。通过全基因组测序对该溶血性曼氏杆菌进行检测和分析,比对基因组中的毒力因子及耐药基因,可较为全面地预测溶血性曼氏杆菌耐药基因、耐药谱和相关毒力基因等致病特性。研究结果可以为四川地区防控溶血性曼氏杆菌及合理用药提供借鉴。

