草甘膦为筛选标记的水稻高效遗传转化体系的建立*
袁 冰,丁 筠,曹含章,吕尊富,李飞飞
(浙江农林大学 农业与食品科学学院,浙江 临安 311300)
以农杆菌介导法的水稻遗传转化技术非常成熟,在粳稻、籼稻和爪哇稻都已经建立了转基因体系[1]。RACHMAWATI 等[2]对爪哇稻品种Rojolele 进行转化,用50 mg/L 潮霉素筛选,转化率达23%;林拥军等[3]对粳稻品种牡丹江8 号建立了农杆菌介导的转化体系,利用50 mg/L 潮霉素进行筛选,转化率达38.7%;LIN 等[4]对4 种籼稻品种进行转化,利用60 和50 mg/L 潮霉素筛选,得到转化率较高的明恢63 和W9864S 以及转化率较低的珍汕97 和中419;李丹丹[5]对籼稻品种湘晚籼17 号和R299 进行转化,利用50 mg/L卡那霉素对胚性愈伤组织进行抗性筛选,转化率低于10%。通过对转化技术的创新,以潮霉素为选择标记的转化试验也能获得70%以上的较高转化率[6-8]。这些成熟体系多以潮霉素作为筛选标记,但抗生素作为筛选标记均存在抗性愈伤组织筛选不够有效灵敏和转化频率不高等问题。
除受体基因型外,水稻遗传转化技术中的筛选剂也非常重要。目前常用的筛选剂有抗生素和除草剂。相比于潮霉素和卡那霉素等抗生素而言,除草剂筛选较抗生素更为快捷和灵敏[9-11]。草甘膦是一种非选择性、无残留和灭生性除草剂。在植物吸收后,它可以竞争性地抑制植物体内影响芳香族氨基酸生物合成的关键酶5-烯醇丙酮酰莽草酸-3-磷酸合成酶 (5-enolpyruvylshikimate-3-phosphate synthase,EPSPS) 的活性,使蛋白质合成受阻,导致植物死亡[12-16]。因此,常用草甘膦(glyphosate)或草丁膦作为水稻遗传转化的筛选标记,利用转基因技术培育抗草甘膦水稻新品种成为一种重要的手段。常用的草甘膦抗性基因有CP4、GR79-EPSPS、GAT4621和GAT等[17-18]。吴涛等[19]对豫农梗和方欣4 号进行转化,用2 mmol/L 草甘膦筛选,PCR 阳性率分别为75.10%和72.00%;王云鹏等[20]对吉农大878 进行转化,用含0.5%草甘膦培养基筛选,草甘膦抗性率为42.56%;胡利华等[21]对明恢86 进行转化,用600 mg/L 草甘膦筛选,PCR 阳性率为45.83%。但这些以草甘膦抗性基因为筛选标记的转基因水稻转化效率普遍偏低,且还未得到一个高效的转化体系[22-24]。
因此,本研究以粳稻日本晴胚性愈伤组织作为受体,选取10、20 和40 mg/L 的草甘膦对其进行抗性筛选,获得抗性愈伤组织后进行分化生根培养,最终获得抗草甘膦转基因水稻。本研究对提高以草甘膦抗性基因为选择标记的水稻遗传转化效率具有重要指导意义。
1 材料与方法
1.1 材料
草甘膦抗性基因CP4和具有草甘膦抗性的P1300 载体(图1)均由浙江大学张天真课题组提供;日本晴成熟胚来自中国水稻研究所;农杆菌菌株LBA 4404 由浙江农林大学农学实验室提供;水稻组织培养的基础培养基为NB,由N6 培养基和维生素B5 配制而成。试验在浙江省农产品品质改良技术研究重点实验室完成。
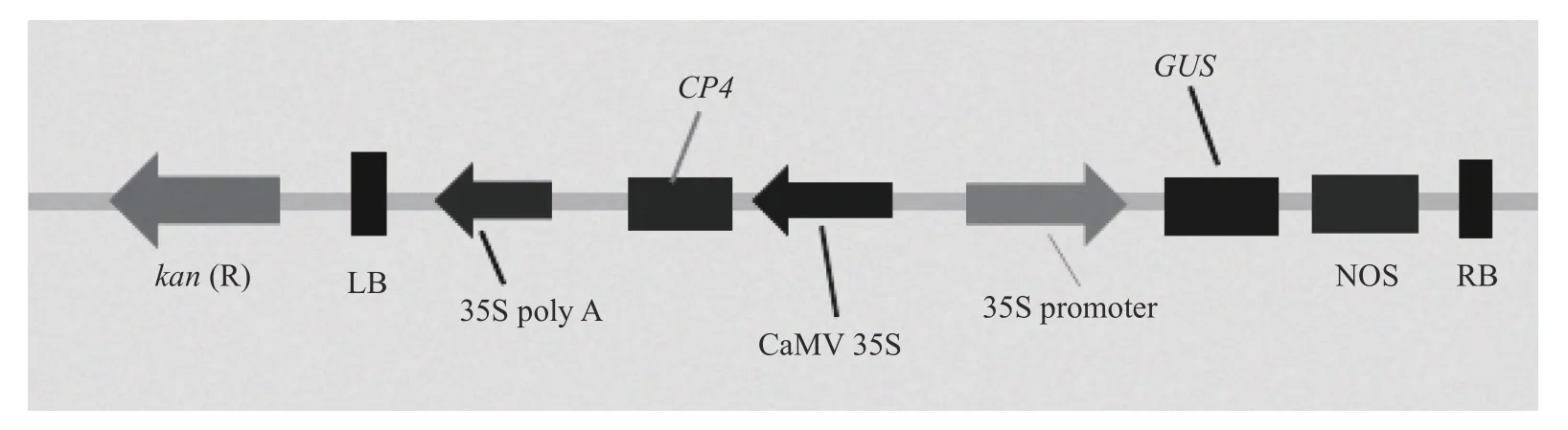
图1 含有CP4 基因的表达载体)Fig.1 Expression vector map containing CP4 gene
1.2 方法
1.2.1 水稻愈伤组织诱导和增殖
日本晴成熟种子去壳,用70%酒精消毒1 min,30%次氯酸钠(NaClO)溶液浸泡30 min,用无菌水将种子清洗4~5 次,在无菌水中浸泡30 min,最后倒去无菌水,用含有500 mg/L 头孢霉素的无菌水洗1~2 次,将成熟胚在成熟胚诱导培养基(NB+2.0 mg/L 2.4-D+0.5 g/L 脯氨酸+0.3 g/L水解酪蛋白+30 g/L 蔗糖+4.0 g/L 非特胶)上进行愈伤组织诱导。在27 ℃的组培室进行培养,每20~25 d 继代1 次,获得的胚性愈伤组织放在培养基R1 (NB+2.5 mg/L 2.4-D+0.5 g/L 脯氨酸+0.3 g/L水解酪蛋白+30 g/L 蔗糖+4.0 g/L 非特胶)上进行增殖培养,得到的大量愈伤组织用作转化受体。
1.2.2 水稻遗传转化
将含有CP4基因载体的农杆菌菌液在28 ℃、200 r/min 的摇床上震荡培养20~36 h,直至菌液OD600达到约1.0。用悬浮培养基R2 (NB+500 mg/L脯氨酸+300 mg/L 水解酪蛋白+30 g/L 蔗糖+20 mg/L乙酰丁香酮)稀释农杆菌菌液,侵染有光泽、金黄色、疏松、小块颗粒状的愈伤组织10 min,期间不停摇动;之后放在含有滤纸的空培养皿上吸干多余的菌液,分散地放置在铺有1 层滤纸的共培养基R3 (NB+500 mg/L 脯氨酸+300 mg/L 水解酪蛋白+30 g/L 蔗糖+20 mg/L 乙酰丁香酮+4.0 g/L非特胶)上,封口,放在28 ℃恒温培养箱里暗培养2 d。培养后的愈伤组织用含有500 mg/L 头孢霉素的无菌水洗3~5 次,用滤纸充分吸干后,将这些愈伤组织每隔约20 d 依次接种在含10、20和40 mg/L 草甘膦的胚性愈伤组织诱导培养基R4(NB+2 mg/L 2.4-D+500 mg/L 脯氨酸+300 mg/L水解酪蛋白+500 mg/L 谷氨酰胺+30 g/L 蔗糖+4.0 g/L 非特胶+500 mg/L 头孢霉素)上进行3 轮筛选。筛选过程设置3 个重复,每1 个重复初始愈伤组织系均为50 块,3 个重复共计150 块。观察在不同质量浓度草甘膦的分化培养基中胚性愈伤组织的增殖数量以及生长状态,考察不同质量浓度草甘膦对水稻愈伤组织分化的影响。
经过3 轮筛选后,挑取生理状态良好的抗性愈伤组织转入分化培养基R5 (NB+0.5 mg/L NAA+3 mg/L 6-BA+500 mg/L 脯氨酸+300 mg/L 水解酪蛋白+500 mg/L 谷氨酰胺+30 g/L 蔗糖+4.0 g/L 非特胶)中,在27 ℃组培室培养约25 d,直至抗性愈伤组织出现小绿点;继续培养约30 d,苗长至7~8 cm 后,放入生根培养基R6 (1/2 NB+20 g/L蔗糖+8.0 g/L 琼脂)中壮苗1~2 周。
1.2.3 转基因水稻的PCR 检测和草甘膦抗性检测
利用CTAB 法提取转基因水稻叶片的DNA。用CP4基因的引物 (F:5′-ATTACATATGCTTCACGGTGCAAGC-3′;R:5′-ATTACTCGAGTCAGGCAGCCTTCGTATCG-3′) 进行PCR 检测,扩增的目的片段大小为580 bp。对移栽成活的抗草甘膦植株进行抗性检测,将水稻植株的叶片进行编号,剪取叶片后浸泡在含有1 mg/L 6-BA 和100 mg/L 草甘膦的水溶液中,5~7 d 后,观察叶片颜色的变化并进行拍照记录。叶片颜色不变,说明其抗草甘膦;叶片颜色发黄或变褐色,说明其不抗草甘膦。
1.2.4 转基因水稻愈伤组织的分化率、成苗率和PCR 阳性率的测定
经过3 轮抗性筛选后,统计获得抗性愈伤组织系数量、分化的愈伤组织系数量(即分化绿点个数)、成苗数、阳性株数和总苗数,并计算水稻愈伤组织的分化率、成苗率和PCR 阳性率。
分化率=分化绿点个数/抗性愈伤组织系数量×100%;
成苗率=成苗数/分化绿点个数×100%;
PCR 阳性率=阳性株数/总苗数×100%。
2 结果与分析
2.1 转基因水稻的获得
将日本晴成熟胚放在诱导培养基R1 (图2a)上,2 周后在种子的周围出现新的愈伤组织(图2b);将长出的愈伤组织单独挑取出来,放在R1 上增殖,2 个月后得到大量有光泽的米黄色愈伤组织(图2c)。CP4基因转化水稻的愈伤组织,共培养2 d 后,转接在含10 mg/L 草甘膦的培养基R4 上,进行第1 次抗性筛选,大部分愈伤组织发黑或褐变(图2d);20 d 后全部转接在含20 mg/L 草甘膦的培养基R4 上,进行第2 次筛选,会在褐色的愈伤组织周边长出抗性的新生愈伤组织(图2e);20 d 后转接在含40 mg/L 草甘膦的培养基R4 上,进行第3 次筛选,会出现愈伤组织的明显增殖(图2f),共得到122 块抗性愈伤组织系(表1)。

图2 水稻胚性愈伤组织为受体转化到再生植株)Fig.2 Rice embryogenic callus from transformation to regeneration
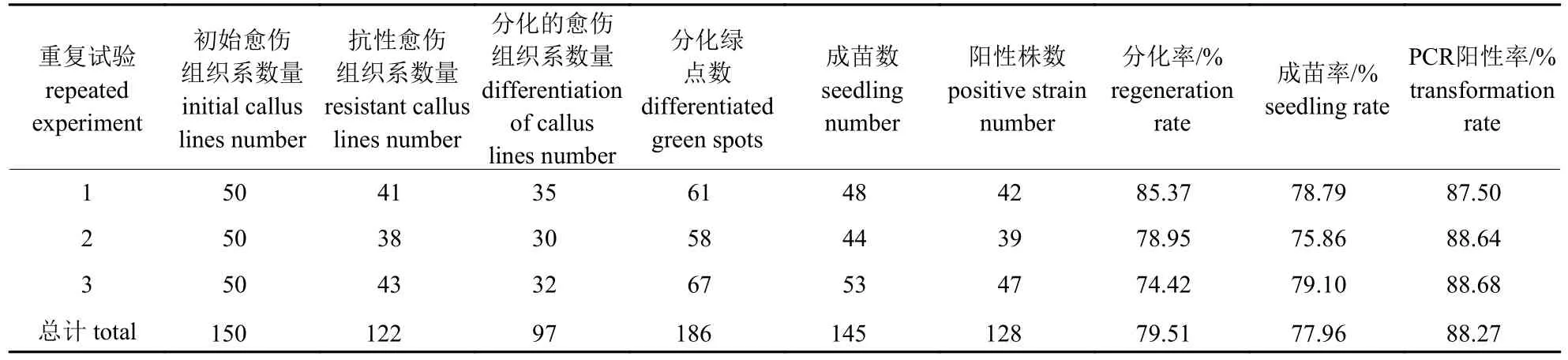
表1 日本晴愈伤组织的分化率、成苗率和PCR 阳性率Tab.1 Differentiation rate,seedling rate and PCR positive rate of callus from Nipponbare
抗性愈伤组织增殖足够多时,转接到分化培养基R5 进行分化诱导,有97 块愈伤组织系出现了186 个绿点(图2g),分化率为79.51% (表1);20 d 后,186 个绿点成功长出145 株幼苗(图2h),成苗率为77.96% (表1);10 d 后,叶片长到约2 cm 时,转接到生根培养基R6 中;40 d 后再生苗生根发育获得完整的再生植株(图2i)。从胚性愈伤组织进行农杆菌介导转化到获得抗性愈伤组织约2 个月,抗性愈伤组织分化成苗约2 个月,整个过程约4 个月。
2.2 PCR 检测结果和移栽成活
对获得的145 株转基因幼苗叶片用CTAB 法提取DNA 后,以CP4基因引物进行PCR 扩增。经过PCR 检测,获得128 株阳性植株,PCR 阳性率为88.27% (表1)。将得到的128 株转基因阳性苗从培养基中取出,用无菌水洗去幼苗根部的琼脂后移栽到有基质的花盆中,放在温室中培养记录,最终得到99 株转基因植株。图3 为随机的15 株转基因植株检测图。泳道5 没有扩增出目的片段,说明检测的转基因植株中不含有抗草甘膦CP4基因,为阴性株,泳道4 和6~18 为扩增出目的片段,表示它们对应的植株中成功转入抗草甘膦CP4基因,为阳性株。
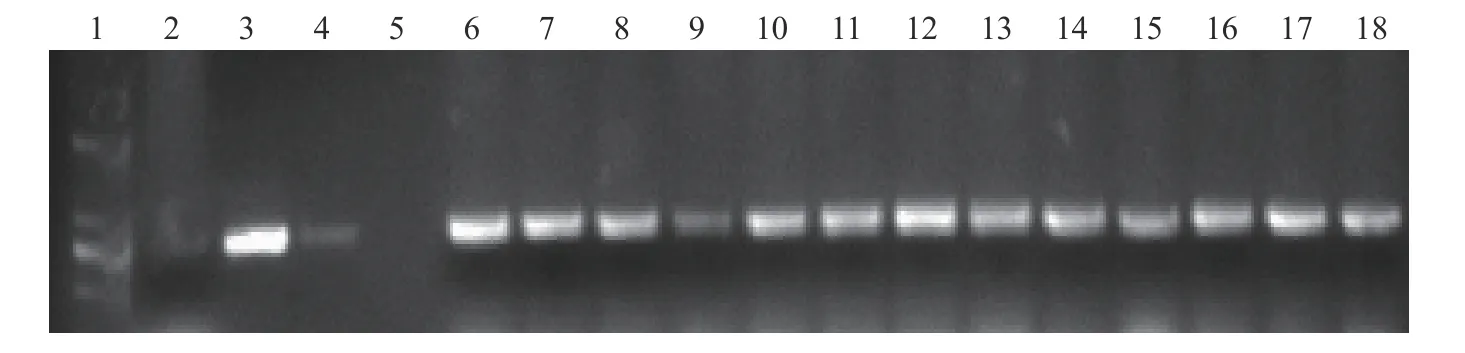
图3 转基因植株CP4 基因的PCR 检测图)Fig.3 The PCR detection for CP4 in transgenic plants
2.3 转基因水稻植株的草甘膦抗性鉴定
将99 株转基因水稻叶片浸泡在含有1 mg/L 6-BA 和100 mg/L 草甘膦的水溶液5 d 后,叶片状态出现了明显的不同;其中,34 株转基因苗叶片表面出现枯黄、褐色的斑点,表现为非抗性;65 株转基因苗叶片表面无明显变化,表现为抗性,草甘膦抗性率为65.66%。试验成功建立了以草甘膦为筛选标记的水稻转基因体系。图4 为随机的21 株转基因水稻植株的草甘膦抗性检测结果。

图4 转基因植株抗性检测)Fig.4 Resistance testing of transgenic plants
3 讨论
3.1 草甘膦对转化率的影响
转基因水稻的获得依赖于优良的转化体系,而确定适宜的草甘膦质量浓度是建立良好的转化体系和提高转化效率的关键因素。苏军等[25]应用农杆菌介导转化法分别将表达水稻EPSP 酶突变基因epsp102和未经修饰的水稻epsp基因导入籼稻恢复系明辉86 中,分别获得转基因水稻84 和109 个克隆,选取质量浓度梯度为0、8.45、16.90、25.35、33.80 和42.25 mg/L 草甘膦筛选后获得完整的再生植株,转化率分别为7%和5%。何少海等[26]用农杆菌介导法对日本晴、秀水131 和中花11 等3 个水稻品种进行转化,分别选取质量浓度为15、10 和5 mg/L 的草丁膦进行筛选后获得完整植株,愈伤组织转化效率分别为76.1%、44.4%和86.7%。王和勇[27]以粳稻品种台北309 愈伤组织作为受体,用农杆菌介导法进行转化后,将愈伤组织用24、20 和12 mg/L 草甘膦进行3 次筛选后获得完整植株,转化率约为26.28%。赵艳等[28]和邓丽蝶[29]用基因枪介导的常规转化法和优化后的方法分别对籼稻观28 和粳稻日本晴的愈伤组织进行转化,用0.34 g/L 草甘膦筛选后,籼稻观28 获得37 株抗性植株,经PCR 检测后31 株为阳性转基因植株,粳稻日本晴的转化效率为17.20%。上述研究表明:选用草甘膦作为筛选标记时,对于不同的水稻品种,草甘膦的质量浓度不同,虽然有以日本晴为受体的转基因体系报道,但是阳性率低,没有确定一个高效的转化体系。本研究用农杆菌介导法对粳稻日本晴愈伤组织进行转化后,分别选择10、20 和40 mg/L 的草甘膦进行抗性愈伤组织的筛选,得到122 块抗性愈伤组织,获得145 株幼苗,其中包括128 株阳性株,PCR 阳性率为88.27%。最终建立了以草甘膦为筛选标记的日本晴高效转基因体系。
3.2 日本晴愈伤组织的状态对转化的影响
日本晴愈伤组织的状态是水稻转基因是否成功的关键点[30]。何少海等[26]将日本晴成熟胚放在诱导培养基上培养15 d,继代2 次,用农杆菌介导法转化后共获得86 块抗性愈伤组织,120 株转基因苗,PCR 阳性率为82.5%,草丁膦阳性率为89.9%;王和勇[27]将台北309 成熟种子放在诱导培养基上培养3~4 周,接种在继代培养基上,用继代2~3 次后的愈伤组织作为农杆菌转化的受体,获得胚性愈伤组织156 个,仅有41 个愈伤组织再生出植株;邓丽蝶[29]以籼稻品种观28 幼胚作为试验材料,将籼稻幼胚放在诱导培养基暗培养15 d,再转接在继代培养基上继代2 次,每次继代15 d 后,用基因枪轰击法进行转化,7 块愈伤组织分化出37 株绿苗,其中31 株为阳性转基因植株,6 株为阴性转基因植株。愈伤组织继代次数太多,会变得无光泽,颜色发白,趋于老化,用这样的愈伤组织进行转化,后期容易造成农杆菌的污染,容易褐化,转化效率低,获得的转基因苗会出现较高的变异;如果愈伤组织继代1~2 次,数量太少,也不利于转化,获得的转基因苗也少。本研究在诱导日本晴的愈伤组织时,成熟胚诱导约1 周会出现愈伤组织,20 d 愈伤组织增多,每20~25 d 转接1 次,转接2~3 次后,增殖出大量的愈伤组织,愈伤组织具有光泽,呈淡黄色、颗粒状和疏松状的状态。选取这样的愈伤组织进行转化,农杆菌污染低,褐变少,转基因苗变异率低,转化效率高。
4 结论
本研究采用草甘膦基因CP4转化日本晴的愈伤组织,再分别选取10、20 和40 mg/L 的草甘膦进行3 轮抗性筛选,共获得122 块抗性愈伤组织。分化生根后,得到145 株转基因苗,经过PCR 检测后有128 株阳性植株,PCR 阳性率为88.27%,将阳性植株移栽成活后获得99 株完整转基因植株。用1 000 mg/L 的草甘膦进行抗性鉴定后,有65 株转基因植株表现抗性,草甘膦阳性率为65.66%,成功建立了以抗草甘膦基因为选择标记的高转化效率的水稻遗传转化体系。该体系为水稻育种提供了材料,并对以抗草甘膦基因作为筛选标记的水稻转基因和一些基因功能验证提供了技术支持。

