DNA微阵列芯片在皮肤分枝杆菌感染中的早期诊断价值
余茜 闻轶旸 高志琴 杨连娟
(同济大学附属皮肤病医院真菌病科,上海 200443)
皮肤分枝杆菌感染是由分枝杆菌感染所致的皮肤及皮下组织的慢性肉芽肿性病变,其致病菌种类繁多。目前皮肤科较为常见的致病菌[1-2]是不典型(非结核)分枝杆菌,主要包括海分枝杆菌、龟分枝杆菌、脓肿分枝杆菌、溃疡分枝杆菌、偶然分枝杆菌、鸟分枝杆菌等。尽管引起皮肤分枝杆菌感染性肉芽肿的致病菌可能不同,但是其组织病理学特征相似,主要表现为混合炎症细胞浸润[3],因此确诊只能通过病原菌的鉴定。
临床上对皮肤分枝杆菌感染的病原学诊断较为困难,传统的检测方法[4]效率低、时间长、操作繁琐,延误诊断可能导致治疗失败,因此临床上亟待一种能快速鉴定病原体的诊断技术。DNA微阵列芯片检测技术[5]是近年来发展起来的一项新技术,以其高敏感、高通量和便捷为特点,可以快速对临床可疑样本做出病原学诊断。本研究以临床上疑似皮肤分枝杆菌感染的患者为研究对象,与传统的分枝杆菌细菌学培养和鉴定作对比,了解DNA微阵列芯片技术在皮肤分枝杆菌感染中的诊断价值。
1 资料与方法
1.1 研究对象
收集2020年1月—2020年12月我院门诊收治的疑似皮肤分枝杆菌感染的患者6例。收集患者的临床资料、病史以及皮肤组织和/或脓液,皮肤组织标本分为3份:1份进行病理学检查,1份进行病原学培养,1份进行DNA微阵列芯片检测。本研究经上海市皮肤病医院伦理委员会批准,全部调查和取样均取得患者同意并签署知情同意书。
1.2 仪器与试剂
应用博奥公司的分枝杆菌菌株鉴定芯片以及微阵列芯片扫描仪LuxScan 10K/B进行芯片检测。分枝杆菌菌株鉴定芯片可检测临床常见分枝杆菌的17个种或群,包括胞内分枝杆菌、鸟分枝杆菌、戈登分枝杆菌、堪萨斯分枝杆菌、偶然分枝杆菌、瘰疬分枝杆菌、浅黄分枝杆菌、土分枝杆菌、龟分枝杆菌和脓肿分枝杆菌、草分枝杆菌、不产色分枝杆菌、海分枝杆菌和溃疡分枝杆菌、金色分枝杆菌、苏尔加分枝杆菌和玛尔摩分枝杆菌、蟾蜍分枝杆菌、耻垢分枝杆菌,以及结核分枝杆菌复合群。
1.3 方法
皮肤组织培养及病原菌鉴定 患者活检后取新鲜皮肤组织和/或脓液,剪碎后研磨,用无菌接种环接种于罗氏培养基上,32℃培养;待有细菌生长(2~12周)后使用无菌接种环挑取合适大小的菌落,提取菌落DNA,使用16S rDNA(引物为27F: 5-AGAGTTTGATCCTGGCTCAG-3; 1492R: 5-CTACGGCTACCTTGTTACGA-3)进行PCR扩增;PCR反应条件:95℃预变性5min, 95℃变性30s,58℃退火30s,72℃延伸90s,35个循环,72℃终延伸7 min,反应完成后取3 μL PCR产物进行1%琼脂糖凝胶电泳检测,确认PCR扩增片段;回收PCR产物,使用测序仪ABI 3730-XL进行DNA测序,将测序得到的基因序列与Genbank数据库的序列作对比分析,进行同源性比较。
DNA微阵列芯片检测皮肤组织分枝杆菌 患者活检后取新鲜皮肤组织和/或脓液,剪碎后研磨,提取皮肤组织DNA备用。取2 μL提取的DNA模板,加入18μL鉴定试剂盒反应体系中,进行PCR扩增;PCR反应条件:37℃ 10 min,94℃ 10 min后, 94℃ 30s,60℃ 30s,72℃ 40s,35个循环,94℃ 30s,72℃ 1 min,10个循环,72℃终延伸7 min。将PCR产物与杂交缓冲液混合后水浴锅中95℃变性5 min,随后立即置于冰水混合物中冰浴3 min,吸取13.5 μL杂交混合物经加样孔加入微阵列芯片中,将密封好的杂交盒置于50℃水浴2 h。洗涤芯片后干燥,置于微阵列扫描仪LuxScan 10K/B中,使用相应软件进行信号的读取和结果判读。
2 结 果
2.1 基本资料
6例患者中男性4例,女性2例;年龄36~62岁,中位数年龄55.5岁;病程1~5个月,平均2.67±1.63个月。发病诱因多为海鲜接触史或外伤史,发病起始部位多为暴露部位或是外伤部位;皮损多表现为多发性,呈淋巴管样排列模式,也可表现为单发性(见表1)。
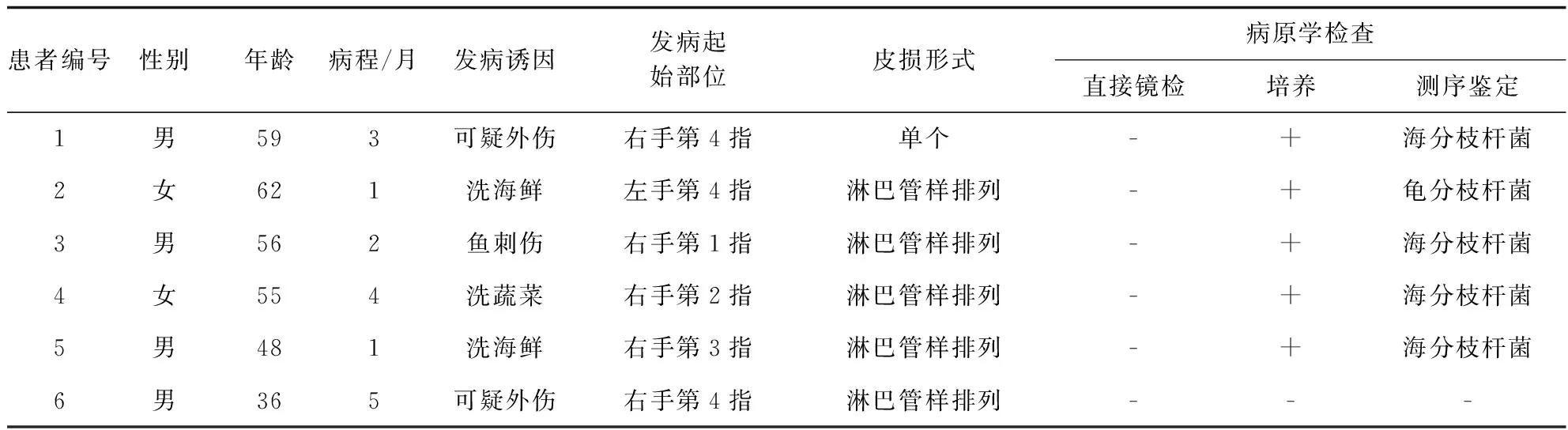
表1 6例皮肤分枝杆菌感染性肉芽肿患者临床资料
2.2 病理学检查
6例患者均进行组织病理学检查,病理学结果无特异性,主要表现为真皮内弥漫性混合炎细胞浸润,包括多核巨细胞、淋巴细胞、嗜中性粒细胞、浆细胞等,形成肉芽肿样结构,部分区域可见局灶坏死(见图1a、b);GMS及PAS染色均未见明显菌丝和孢子,抗酸染色未见阳性表达。
2.3 病原学检查
6例患者皮肤组织研磨后接种于罗氏培养基。32℃培养14~28 d培养后,前5例可见黄白色湿润菌落生长(见图2a),最后1例未见菌落生长。挑取菌落进行抗酸染色后可见分隔状菌丝(见图2b)。菌落经过测序鉴定,依次为:①海分枝杆菌;②龟分枝杆菌;③海分枝杆菌;④海分枝杆菌;⑤海分枝杆菌。

图1 a. 组织病理学表现可见弥漫性混合炎症细胞浸润(HE染色×100);b. 高倍镜下可见多核巨细胞、上皮样细胞、淋巴细胞、嗜中性粒细胞等(HE染色×400) 图2 a. 皮肤组织在罗氏培养基培养14~28 d后,可见黄白色湿润菌落;b. 抗酸染色可见红色棒状菌丝(HE染色×1000)
2.4 DNA微阵列芯片检测结果
6例患者皮肤组织提取DNA后进行DNA微阵列芯片检测,6 h后检测结果如图3所示。前5例DNA微阵列芯片检测结果与传统培养、菌株测序结果一致,并且DNA微阵列芯片技术检测率(6/6)高于传统的培养方法(5/6),耗时更短(见图3)。
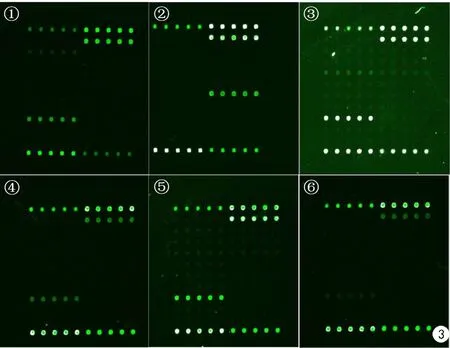
图3 6例患者DNA微阵列芯片检测结果:①、③~⑥号标本为海分枝杆菌/溃疡分枝杆菌;②号标本为龟分枝杆菌/脓肿分枝杆菌
2.5 治疗
6例患者均给予利福平300 mg,2次/日联合克拉霉素250 mg,2次/日治疗,3个月后6例患者皮损均消退。
3 讨 论
近年来,皮肤分枝杆菌感染的报道逐年增加,这类疾病多与外伤[6-7]、整形外科手术[8-9]、纹身[10]、美容注射、假体填充[11]等有关。另外,免疫抑制剂和糖皮质激素[12]的广泛使用,以及艾滋病、器官移植、肿瘤、糖尿病等疾病的发病率逐年升高,重症及播散型的分枝杆菌感染的发病率和致死率也呈逐年上升趋势。皮肤分枝杆菌感染的病原体难以被短期清除,延误治疗可能会造成患者毁容、器官功能受限甚至是残疾。一旦确诊患者需接受长疗程的抗分枝杆菌治疗[4],因此早期病原学检测是治疗成功的关键。
传统的实验室诊断方法[13]主要包括结核菌素皮肤实验、组织病理学、细菌培养和以PCR为基础的分子生物学检查等。结核菌素实验阳性支持结核分枝杆菌或是非典型结核分枝杆菌感染,但是不能确定致病菌种[14],同时可能存在假阳性结果,例如接种卡介苗。组织病理学是检测皮肤分枝杆菌感染最常规的方法,但镜下表现无特异性,即使是最具代表性的结核样肉芽肿,也难以与梅毒、肉芽肿性玫瑰痤疮、利什曼病、真菌感染性肉芽肿相鉴别;通常需配合抗酸染色,对于检测分枝杆菌感染,特别是少菌型,阳性率较低,同样也不能鉴定分枝杆菌的菌种类型。细菌培养是诊断分枝杆菌性肉芽肿的“金标准”,是制定诊疗方案必不可少的一部分,但不同的分枝杆菌培养温度有所差异,且不同的分枝杆菌培养所需时间也不相同,一般需要2~12周[15];分枝杆菌的培养耗时耗力,阳性率低,因此传统的诊断方法可能导致诊疗计划被延误。近年来,以PCR 为基础的分子生物学诊断技术也应用于疾病的诊断中[16],如基因序列分析以及基因组分析等,但这些技术可能存在检测范围有限,或试验结果不稳定,亦或是操作步骤繁琐等缺陷,故而限制了其在临床上的广泛使用。本研究所使用的DNA微阵列芯片检测技术,操作简洁快速,整体检测过程6~8 h即可做出诊断,并且能有同时做出17种分枝杆菌的菌种鉴定,缩短了临床诊断过程。
基因芯片技术始创于20世纪90年代,近年来DNA微阵列芯片技术逐渐用于临床上的病原学诊断[5],可对痰液[17]、分泌物、脓液、尿液、穿刺液(胸腹水、脑脊液[18]、心包积液、关节液、胆汁)等多种标本进行检测,然而目前尚未见该技术用于皮肤组织的病原学检测。本研究首次使用DNA微针芯片直接对皮肤新鲜组织进行检查,前5例患者的检测结果与培养测序结果一致,准确率高,因此DNA微阵列芯片诊断技术可以作为皮肤分枝杆菌感染的早期诊断方法。此外,我们发现临床上高度怀疑皮肤分枝杆菌感染的病例,其培养阳性率不高。这一现象可能是由于患者就诊前局部或系统抗生素的不合理使用,致使分枝杆菌感染在一定程度上得到缓解和治疗,使得病原体的检出率降低。DNA微阵列芯片检测的灵敏度为1×103个菌/PCR反应,敏感性高,对于临床怀疑分枝杆菌感染的病例可进行芯片检测,有助于提高诊断阳性率。本研究中6例患者,DNA微阵列芯片检测出6例患者阳性,而皮肤组织培养5例阳性,因此提示DNA微阵列芯片检测阳性率高于传统的培养,但这一结果尚需大样本的研究进一步证实。
综上,DNA微阵列芯片诊断技术用于皮肤分枝杆菌感染的诊断具有简洁、快速、灵敏度高等特点,可准确鉴定出常见的致病菌种,可为临床早期诊断和治疗提供有力的支持。但是该技术仍有缺陷,不能在检测病原菌的同时做出药敏检测,因此尚不能完全替代传统的培养和药敏检测。临床上建议芯片检测与传统培养相结合,以期对皮肤分枝杆菌感染做出早期诊断,制定精准的治疗方案。

