基于六氮杂苯并菲呋喃衍生物的银离子荧光探针
张 翔, 余小光, 李崇裔, 廖红光, 谈 瑛, 刘海路, 童孟良, 李继睿, 王晓钟
(1. 湖南化工职业技术学院 化学工程学院, 湖南 株洲 412000;2. 浙江大学衢州研究院, 浙江 衢州 324000)
1 前 言
设计构筑具有新颖结构的化学传感器分子,实现对特定分子或离子的高选择性、高灵敏度和快速响应性识别是当前超分子化学领域备受关注的研究内容之一[1-2]。其中,Ag+在催化[3]以及超分子自组装[4-5]等领域具有重要应用。传统的Ag+检测方法包括原子吸收光谱法[6]、电感耦合等离子体发射质谱法[7]及电化学法等[8],这些方法往往存在成本高、耗时长、技术要求高等不足。相较而言,荧光探针具有高选择性、高灵敏性等特点,是实现高效离子识别的理想工具[9-10]。在众多荧光探针分子中,具有共轭骨架结构的芳香化合物如四苯乙烯[11]、芘[12]、罗丹明[13]、吡咯亚甲基[14]等具有良好的π-电子离域性和强荧光信号等特点而被广泛地应用于银离子的识别。
六氮杂苯并菲(hexaazatriphenylene,HAT)作为一类具有刚性平面结构的共轭分子,具有丰富的含氮识别位点,易于合成和衍生化,已被成功用于构筑离子识别和自组装体系[15]。例如,在前期工作中,Zhang等[16]设计并合成了基于HAT 的苯酚衍生物,能够选择性识别氟离子或铜离子[17]。此外,Zhao 等[18]发现含吡啶基团的HAT 衍生物可以作为Cd2+的荧光探针,并将该探针分子应用于细胞显影检测。然而,目前尚未有基于HAT 衍生物选择性识别银离子的研究报道。
为了进一步丰富银离子传感器的结构类型,同时扩展HAT 衍生物的应用,本文设计合成了一类外围含有六个呋喃基团的HAT 衍生化合物1。由于呋喃基团的缺电特征和合适的空间位阻,预期化合物1 在溶液中具有强的荧光发射信号,并且能够选择性地对溶液中的银离子产生显著的荧光淬灭效应。
2 实验(材料与方法)
2.1 实验材料与仪器
2.1.1 实验材料
所有试剂均采购自国药集团化学试剂有限公司,规格为分析纯,使用前未进一步处理。详细信息如下:呋喃-2-甲醛、1,3,5-三氯苯、50% 发烟硫酸、浓盐酸、SnCl2·2H2O、盐酸硫胺、1,8-二氮杂双环[5.4.0]十一碳-7-烯、CuSO4·5H2O、冰乙酸、硝酸银、Cu(NO3)2·3H2O、Zn(NO3)2·6H2O、硝酸铅、Hg(NO3)2·H2O、Cd(NO3)2·4H2O、Co(NO3)2·6H2O、Ni(NO3)2·6H2O、Ca(NO3)2·4H2O、Mg(NO3)2·6H2O、Fe(NO3)3·9H2O、硝酸钠、二甲亚砜、氯仿。所有的金属盐(Ag+,Fe3+,Zn2+,Cu2+,Ni2+,Co2+,Cd2+,Pd2+,Hg2+,Ca2+,Mg2+,Na+)溶液都是以硝酸盐的形式配制于分析纯的二甲亚砜溶剂中成为10×10-3mol·L-1的溶液。裸眼实验、紫外-可见吸收和荧光光谱实验在分析纯的氯仿溶剂中进行。
2.1.2 实验仪器
所有的氢谱和碳谱测试是在型号为Varian Unity Plus 400 MHz 的核磁共振仪中25 ℃下进行,化学位移以四甲基硅为参照标准。质谱测试在型号为Agilent Technologies 5973N 和AXIMA Performance-MALDI TOF/TOF 的质谱仪上进行,紫外-可见吸收光谱测试在型号为Unico 4802 UV-Vis 的光谱仪上完成,荧光光谱测试在型号为F-4600 FL 的光谱仪上完成。
2.2 实验方法
2.2.1 化合物1 的合成
将化合物 2 (C10H6O4,质量m=847 mg,物质的量n=4.46 mmol) 和化合物 3 (C6H12O6,m=259.2 mg,n=1.44 mmol) 溶于10 mL CH3COOH中,加热至140 ℃回流反应 18 h。反应结束后,用 CH2Cl2(体积V=100 mL)进行3次萃取,合并有机相再经饱和Na2CO3(V=100 mL)、水 (V=100 mL) 以及饱和食盐水 (V=100 mL)洗涤处理后,用无水 MgSO4进行干燥。过滤除去干燥剂,并通过减压旋蒸除去溶剂,所得粗产物经柱层析 (淋洗剂:丙酮与二氯甲烷的体积比为 1/25) 分离纯化后得到黄色固体化合物1 (m=359.4 mg,产率28.6%)。氢谱1H NMR(500 MHz, CDCl3) 化学位移δ为7.69 (双峰d,耦合常数J= 1.0 Hz,1H),7.11 (d,J=3.4 Hz,1H),6.64 (双重双峰dd,J= 3.4,1.7 Hz,1H)。质谱MS (MALDI-TOF):质核比m/z=631.9 [M+H]+,测定m/z=653.9 [M+Na]+。高分辨质谱HRMS (MALDI-TOF):C36H19N6O6的理论质核比m/z=631.136 6[M +H]+,测定m/z=631.136 1。[M+H]+和[M+Na]+分别为化合物1加H+和Na+。碳谱13C NMR (125 MHz,CDCl3)δ:150.72、 144.87、143.06、 138.98、114.75、112.29。
3 实验结果与讨论
3.1 化合物1 的合成
如图1 所示,化合物2[19]与化合物3[20]进行缩合反应得到化合物1,其化学结构通过核磁氢谱、碳谱和高分辨质谱进行表征。
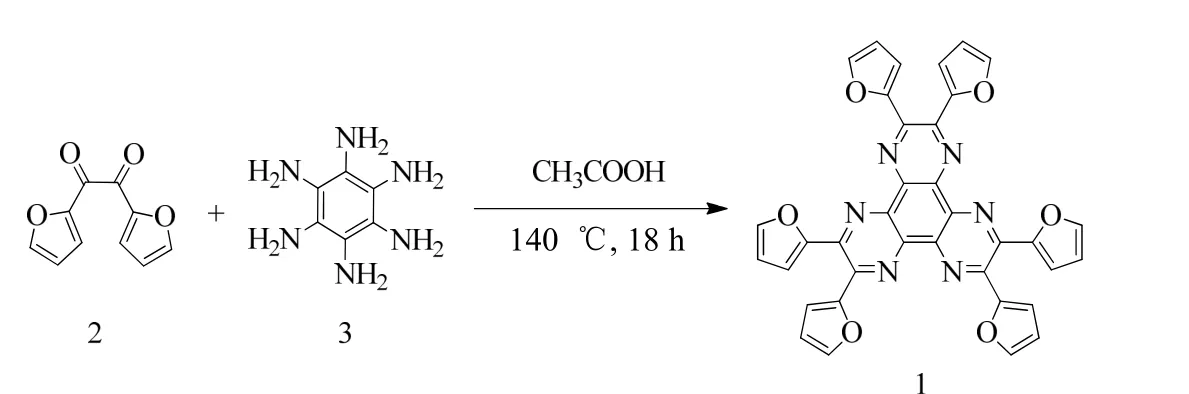
图1 化合物1 的合成路径Fig.1 Synthetic route of compound 1
3.2 化合物1 对银离子识别的裸眼实验
首先,化合物1 的氯仿溶液在自然光照射下呈现浅黄色(如图2(a)所示),而在365 nm 紫外光激发下则呈现出蓝绿色荧光(图2(b))。在化合物1的氯仿溶液中添加银离子(n(Ag+):n(化合物1) =4:1)后,溶液颜色明显向深黄色转变(图2(a)),并观察到其在紫外光激发下的荧光几乎完全淬灭(图2(b))。然而,在化合物1 的氯仿溶液中加入其他金属离子(Fe3+,Zn2+,Cu2+,Ni2+,Co2+,Cd2+,Pd2+,Hg2+,Ca2+,Mg2+,Na+,n(其他金属离子):n(化合物1) =4:1))时,溶液在自然光条件下的颜色几乎不变化(图2(a)),并且除了Cu2+、Cd2+和Hg2+能使其溶液在紫外光激发下的荧光发生一定程度的减弱以外,加入其他金属离子后其溶液的荧光可以保持(图2(b))。上述结果表明,化合物1 能够在溶液中选择性地识别银离子,并发生显著荧光淬灭。

图2 在不同光源下向化合物1 的氯仿溶液(5×10-6 mol·L-1)添加各种金属离子(2×10-5 mol·L-1)前后的变化情况Fig.2 Results of compound 1 (5 × 10-6 mol·L-1) in chloroform before and after the addition of various metal cations (2×10-5 mol·L-1)
3.3 化合物1 对银离子识别的紫外-可见光谱实验
进一步通过紫外-可见光谱分析化合物1 对银离子的选择性识别行为,结果如图3(a)所示。可见,随着溶液中银离子浓度的增加,化合物1 在418 nm 处的吸光度(Abs)逐渐减弱,同时,在450 nm 处则出现了一个新的吸收峰。这一光谱变化表明化合物1 与银离子发生了配位作用[21]。然而,当向化合物1 的溶液中加入过量的其他金属离子时,其吸收光谱并未出现类似于加入银离子时的显著变化(图3(b))。

图3 在化合物1 的氯仿溶液(1×10-5 mol·L-1)中滴加金属离子的紫外-可见吸收光谱图Fig.3 UV-vis spectra of compound 1 (1×10-5 mol·L-1) upon the addition of Ag+ and other metal ions in CHCl3
3.4 化合物1 对银离子识别的荧光光谱实验
通过荧光滴定实验进一步研究了化合物1 对银离子识别的选择性和敏感性,结果如图4(a)所示。在化合物1 的氯仿溶液中添加银离子(n(Ag+):n(化合物1) =6:1)后,在486 nm 处的荧光强度逐渐下降直至完全淬灭。在化合物1 的氯仿溶液中加入其他金属离子(n(其他金属离子):n(化合物1) =6:1))时,溶液的荧光强度变化不明显(如图4(b))。当加入Cd2+、Cu2+和Hg2+时,荧光强度发生一定幅度地下降。计算得到化合物1 在氯仿中对Ag+的理论检测限[22]为3.35 × 10-6mol·L-1。

图4 在化合物1 (5×10-6 mol·L-1)的氯仿溶液中滴加金属离子荧光光谱图Fig.4 Fluorescent spectra of compound 1 (5×10-6 mol·L-1) upon the addition of Ag+ and other metal ions in CHCl3
3.5 化合物1 对银离子识别的抗干扰、重复性和时间响应实验
考虑到银离子识别在实际应用场景中对抵抗干扰、重复利用以及快速响应的要求,分别进行了抗干扰、重复性及时间响应性实验,结果如图5 所示。化合物1在其他金属离子共存的情况下加入银离子后出现了与对照组类似的荧光猝灭现象,这说明其他金属离子的存在并未干扰化合物1 对Ag+的选择性识别。通过向化合物1 的氯仿溶液中反复加入Ag+和乙二胺四乙酸,并记录486 nm 处的荧光强度,重复6 个周期形成可逆性曲线。由于乙二胺四乙酸对Ag+的络合作用,化合物1 在486 nm 处的荧光强度值出现了数值相当、反复性的增强和淬灭现象,表明化合物1对Ag+的识别具有良好的可逆性。通过记录在化合物1 的氯仿溶液中加入Ag+后荧光强度随时间变化的情况形成了识别响应时间依赖曲线,结果显示在35 s 后荧光强度趋于稳定,证明化合物1 对Ag+的快速响应性能。
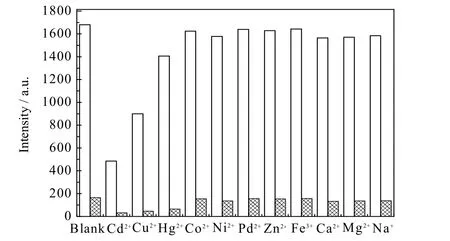
图5 在他金属离子(n(其他金属离子):n(化合物1)=4:1)共存的情况下向化合物1 的氯仿溶液(5×10-6 mol·L-1)中添加银离子(n(Ag+):n(化合物1)=4:1),添加前:白色柱体,添加后:格网柱体)的荧光强度变化情况Fig.5 Fluorescence intensity variation of compound 1 (5 × 10-6 mol·L-1)without (white column) or with (grid column) the addition of Ag+ at the existence of various other metal ions
3.6 化合物1 对银离子识别的核磁分析
为了揭示化合物1 对银离子的识别机理,进行了滴定不同量AgNO3后的化合物的核磁分析,结果如图6 所示。随着银离子的加入,化合物1 中呋喃基团的芳香氢信号峰(H1~H3)逐渐从尖峰变成宽峰,并向高场发生小幅移动。这表明化合物1 的呋喃基团与银离子发生配位作用。在化合物1 的氯仿溶液中添加银离子(n(Ag+):n(化合物1) =1.5:1)后,H1~ H3的信号峰几乎消失,并且在继续添加银离子后,核磁谱图不再发生变化。
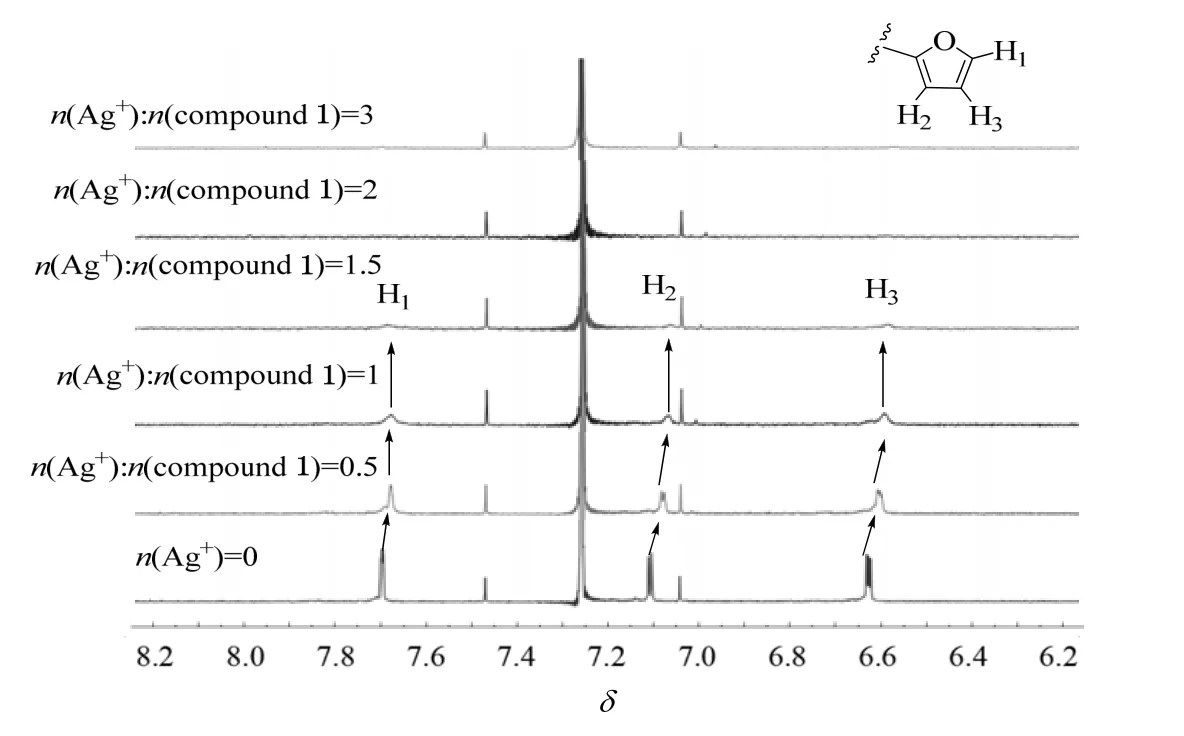
图6 在化合物1 的氘代氯仿溶液(5×10-6 mol·L-1)中添加银离子(n(Ag+):n(化合物1) =3:1)的核磁图谱(400 MHz, CDCl3, 298 K)Fig.6 1H NMR spectra (400 MHz, CDCl3, 298 K) of compound 1 (5×10-6 mol·L-1) before and after the addition of AgNO3
3.7 化合物1 对银离子识别的Job’s 实验
为了进一步确定化合物1 和银离子之间形成稳定络合物时的量比,进行了Job’s 实验。结果表明,当(n(Ag+):n(化合物1) =3:2 时,混合物溶液在418 nm 处的吸光度与未加入银离子的化合物1 的吸光度相比变化最为显著。进一步线性拟合,并利用B-H 公式[23]计算得到化合物1 和银离子形成络合物的表观结合常数为1.24 × 107L·mol-1,拟合曲线的相关系数R2为0.997,所展现出的良好线性也进一步确认二者形成了络合物((n(Ag+):n(化合物1) =3:2)。
4 结 论
成功构筑了基于六氮杂苯并菲呋喃衍生的化合物1,能够在氯仿溶液中特异性地识别银离子,并产生显著的吸收光谱变化和荧光淬灭现象。实验研究结果表明,该分子具有抗干扰、可重复、响应快等特性,且与银离子能够在氯仿溶液中形成络合物((n(Ag+):n(化合物1) =3:2),其理论检测限为3.35×10-6mol·L-1。研究结果可以为开发具有高效银离子检测性能的新型传感器,并在环境检测等领域应用提供基础。

