夏季闽东沿海水体中透明胞外聚合颗粒物的分布特征及影响因素
薛思佑,胡佶*,韩正兵,蔡昱明,刘小涯,冯毓彬,于培松,张慧娟,潘建明
( 1.自然资源部第二海洋研究所 海洋生态系统动力学重点实验室,浙江 杭州 310012)
1 引言
近岸河口是河流中的淡水生物群落和沿海、海湾中的海洋生物群落两个水生生物群落之间的过渡带,其通常以群落和种群组成的显著变化为特征[1],这些变化可能对海洋系统、元素计量比、碳储存和生物地球化学产生重大影响[2]。河口作为许多生物筑巢和觅食的栖息地[3],逐渐受到人为压力和气候变化的威胁[4],亟需我们更好地理解河口基于食物网有机体的结构和功能[5]。
水体中部分初级生产的有机物质是以胞外多糖(Extracellular Polymeric Substances,EPS)的形式存在[6],并可以形成透明胞外聚合颗粒物(Transparent Exopolymer Particles,TEP),其中的酸性多糖能被爱尔新蓝染色剂染色[7],表现为溶解有机物与颗粒有机物的双重特性,在水生生态系统的颗粒聚集、沉积和碳埋藏等过程中起着重要作用[8-9]。TEP具有黏性[6],能够吸附溶解有机物或者其他小颗粒物聚集成较大颗粒物,且TEP密度比海水小[10],使得这些较大颗粒聚合物质的密度取决于TEP与其他颗粒物的相对含量,从而在整个海洋生态系统中发挥作用,其中包括对海洋碳库[11]、海气交换[12]等动态过程的影响。此外,TEP可以通过凝集作用使溶解有机物、细菌、微型鞭毛藻、浮游植物等形成凝聚体[13],供浮游动物[14]、鱼类或其他海洋生物[15]摄食。经此过程,TEP能将食物链的途径缩短,并将微食物环和经典食物链相连[13]。
自Alldredge等[7]首次提出TEP的定义后,国际上针对TEP的研究逐渐展开,例如Discart等[16]对TEP的测定方法进行了系统地分析,使TEP分类更为明确;Villacorte等[17]发现,TEP在不同水源中含量不同,且胶体态TEP占主要成分;Mari等[18]在实验中发现,营养状况可能影响TEP产生,从而控制球形棕囊藻繁殖期的输出和滞留平衡;Fukao等[19]通过实验培养发现,不同藻类间产生的TEP存在差异;孙军等[12]通过建立概念模型,对TEP在海洋微表层积累、对气溶胶产生作用等方面有更全面的认识,并指出了未来TEP的重点研究方向。但我国仅对九龙江河口[20]、珠江口[21]和白令海峡[22]的TEP有研究。
福建东部沿海,属于亚热带海洋性季风气候。在冬季,海域主要受低温、低盐且富含营养盐的闽浙沿岸流影响[23]。而在夏季,闽浙沿岸流的影响范围主要分布于浙江省北部沿岸海域,对浙江南部和福建海域无明显影响。闽东海域拥有沙埕、三沙、赛岐等天然良港,其中沙埕港[24]是调查海域最为主要的港口,其海域总面积为87.07 km2,是一个深入内陆的弯曲形狭长港湾。港口外海的台山渔场资源丰富,是闽东主要渔场之一,盛产黄鱼、带鱼、鳗鱼、墨鱼、虾、梭子蟹等。由于TEP可以被浮游动物和鱼类摄食,因此探究闽东海域TEP的分布特征及影响因素在一定程度上也可以为准确评估该海域的渔场资源分布提供重要信息。此外,闽东沿岸海域赤潮生物种类繁多[25],且夏季是赤潮高发时期,赤潮发生后,浮游植物产生的TEP也会随之增加。
2 采样与方法
2.1 采样区域
本文以闽东沿海(26.7°~27.3°N,120.2°~121°E)为研究区域,由于沙埕港周边无大河溪注入,故调查海域受陆地径流影响较小。研究区域设置16个站点,形成自近岸向离岸的4条平行断面,站位分布见图1。采样时间为2019年7月24-27日,测量的参数包括水温、盐度、pH、溶解氧(Dissolved Oxygen,DO)浓度、浊度、5项营养盐浓度、叶绿素a(Chlorophylla,Chla)浓度、颗粒有机碳(Particulate Organic Carbon,POC)含量以及TEP含量。每个站位采样层参照《海洋调查规范GB/T 12763.4》进行设置,包括0 m、5 m、10 m、20 m、30 m和底层(距离海底2 m),现场实际采水层根据站位水深进行选择。
图1 2019年闽东沿海夏季采样站位Fig.1 The sampling stations in the coast of eastern Fujian in summer of 2019
2.2 研究方法
2.2.1 基本参数测定
水温、盐度、浊度等基础数据主要由RBR传感器(XRX-620 CTD)直接进行获取。溶解氧、pH、5项营养盐样品测定参照《海洋调查规范GB/T 12763.4》的方法。溶解氧采样时依序往棕色广口瓶中注入1 mL氯化锰溶液和1 mL碱性碘化钾溶液进行固定,随后在24 h内带回实验室利用碘量滴定法测定分析。pH水样用50 mL聚乙烯瓶装取,利用pH计测定。硅酸盐、磷酸盐、硝酸盐、亚硝酸盐和铵盐水样合并装于同一水样瓶中,量取一定体积海水(0.3 L),用孔径为0.45 μm的醋酸纤维膜过滤。滤液放于高密度聚乙烯水样瓶中,并用氯化汞溶液固定,常温保存并带回实验室测定:硅酸盐测定采用硅钼蓝法,用7230G型分光光度计于812 nm波长下测定吸光度(检测下限为0.10 μmol/L);磷酸盐测定采用抗坏血酸还原磷钼蓝法,于882 nm波长下测定吸光度(检测下限为0.02 μmol/L);亚硝酸盐测定采用重氮-偶氮法,于543 nm波长下测定吸光度(检测下限为0.02 μmol/L);硝酸盐测定采用锌镉还原法,于543 nm波长下测定吸光度(检测下限为0.05 μmol/L);铵盐测定采用靛酚蓝法,于630 nm波长下测定吸光度(检测下限为0.05 μmol/L)。分析过程中所用标准溶液均由自然资源部第二海洋研究所标准物质中心生产(GBW 08617-08645),且所有的采样瓶与过滤装置均无其他外来污染物干扰。
2.2.2 POC测定
POC样品采集:量取0.3~0.5 L海水,用450℃灼烧过的GF/F玻璃纤维膜过滤,滤膜于-20℃下冷冻保存并带回实验室测定分析。
POC样品测定:膜样用浓盐酸熏蒸12 h以除去无机碳,用去离子水清洗残留盐酸后在50℃条件下烘干,用元素分析仪(Elementar,德国)测定样品(分析精度为CHNS小于0.1%)。此外,为了评估海域中TEP对POC的贡献,本文利用文献[26]中的转换因子将TEP含量转换成碳含量计算了TEP对POC的贡献率。由于文献中的转换因子(f为0.53~0.88,其中f为POC含量和TEP含量的比值)是在盐度比河口高的环境中对多种硅藻进行实验室培养测定,相比于现场环境,其受干扰程度小,实际海水环境下的转换因子可能达不到上述计算值,故本文使用保守的转换因子f为0.53进行计算。
2.2.3 叶绿素a浓度测定
50 mL水样依次通过孔径为20 μm筛绢、2 μm核孔滤膜和孔径为0.7 μm的GF/F滤膜过滤,并记为小型浮游生物(Net):体长大于20 μm;微型浮游生物(Nano):体长为 2~20 μm;微微型浮游生物(Pico):体长为 0.7~2 μm。膜样于-20 ℃冷冻保存,于实验室内使用Trilogy荧光计分析测量叶绿素a浓度,测定依据《海洋调查规范GB/T 12763.6》。为了更直观展示结果,下文图片中出现的不同粒径浮游生物以Net、Nano和Pico表示。此外,叶绿素a浓度遥感数据则是从海洋遥感在线分析平台(SatCO2-Pro.V1.0,http: //www.SatCO2.com)获取。
2.2.4 TEP测定
TEP的测定方法主要参考Passow和Alldredge[27]的实验方法,量取300~500 mL海水样品,在负压不大于0.02 MPa的情况下,过滤到直径为25 mm、孔径为0.4 μm的聚碳酸酯滤膜上。再加入500 μL质量分数为0.02%的爱尔新蓝(pH为2.5,Sigma-Aldrich公司)染色2 s至膜表面完全浸没。用去离子水洗去多余染液后,将膜样置于6 mL 80%的硫酸中进行溶解,放置2 h,期间手动振荡试管3~5次。最后取上清液于1 cm比色皿中,在787 nm波长下测定吸光值,每个水层均采样2~3次,测定结果扣除滤膜空白后取平均值记录。测定的吸光值以改进的黄原胶标定方法[28]进行计算:首先配制一系列浓度梯度的黄原胶标准溶液,量取2 mL各个浓度梯度溶液于试管中(事先加入500 μL爱尔新蓝溶液)进行混合,然后过滤至相同聚碳酸酯滤膜上,膜样溶解及测定步骤与TEP相同。
2.2.5 数据分析
本文应用IBM SPSS Statistics 22对参数数据进行分析,采用Ocean Data View 5.1.7以及OriginPro 9.0进行作图。
3 结果
3.1 温度、盐度和其他参数分布特征
该海域所有水层的温度为23.52~28.80℃,平均为(25.90±1.57)℃;盐度为 29.513~34.467,平均值为33.165±1.235。调查海域由于采样时间处于夏季,水体温度整体较高。水温从表层向底层逐渐降低,近岸远岸温度变化不大。盐度从表层向底层逐渐增加,且近岸向远岸略微增加。海域中pH范围为7.94~8.26,平均值为8.07±0.08,基本呈现近岸低、远岸高的趋势;溶解氧浓度为3.98~9.36 mg/L,均值为(6.22±1.41)mg/L,主要分布特征为远岸高、近岸低;浊度则为 0.7~115.7 NTU,平均为(14.6±19.3)NTU,整体变化为从表层向底层逐渐增加;各项营养盐浓度范围及均值如表1所示,其整体变化趋势为从近岸高值向远岸减小,呈现底层高于表层的变化特征。
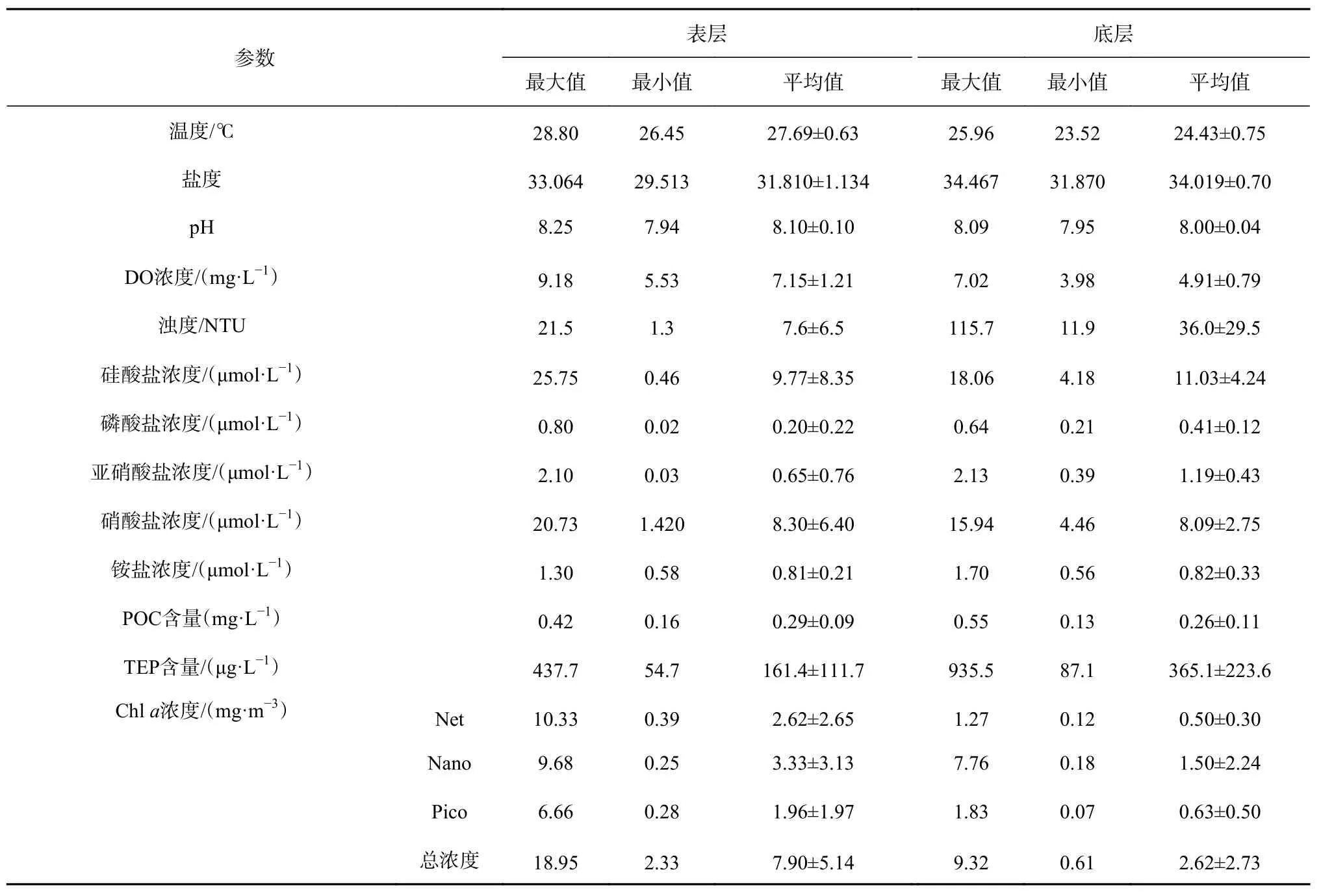
表1 夏季闽东海域TEP及其他环境参数Table 1 TEP and other environmental parameters in the coast of eastern Fujian
3.2 TEP含量及分布特征
在整个调查海域中,TEP含量(以黄原胶为标准物质计算,后同)范围为 25.2~935.5 μg/L,平均值为(201.8±177.9)μg/L。表层 TEP 平均含量为 161.4 μg/L,其在霞关与三个尖附近(M08站位)达到最高,最高浓度为437.7 μg/L,随后向周围海域逐渐递减。底层平均含量为365.1 μg/L,其最高值出现在鱼寮与三个尖附近(M01站位),含量为935.5 μg/L。在各个断面中,TEP含量分布均呈现为近岸高,远岸低的趋势,且底层TEP含量高于表层(图2)。整体而言,TEP呈近岸向远岸逐渐减小的变化趋势,且底层含量较表层要高。

图2 2019年闽东沿海夏季TEP分布Fig.2 The distribution of TEP in the coast of eastern Fujian in summer of 2019
3.3 POC含量及分布特征
海域中POC含量的变化范围为0.13~0.55 mg/L,平均为(0.24±0.09) mg/L。表层POC平均含量为0.29 mg/L,底层POC平均含量为0.26 mg/L,在三个尖(M01站位)附近的底层POC含量最高。从图3的断面与平面分布看,POC的分布在海域中呈现不同模式:POC含量呈近岸高、远岸低,且呈表层低于底层的分布趋势(图3a);POC在近岸表层与底层含量相当,但比中间水层高,而远岸呈表层高、底层低的变化趋势(图3b);POC仅在M11和M12站位附近的远岸表层呈现较高含量(图3c);POC含量在近岸附近相较于远岸要高(图3d);表层POC分布主要呈现为区块状,分别在M05、M07和M16站位附近出现高值(图3e)。

图3 2019年闽东沿海夏季POC分布Fig.3 The distribution of POC in the coast of eastern Fujian in summer of 2019
3.4 叶绿素a浓度及浮游植物粒径分布特征
调查期间,闽东沿海的叶绿素a浓度范围为0.61~18.95 mg/m3,平均浓度为(5.36±4.70)mg/m3。表层叶绿素a浓度(平均为7.90 mg/m3)要高于底层叶绿素a浓度(平均为2.62 mg/m3)。图4中显示,叶绿素a浓度呈区块分布,与POC分布存在部分相似变化,如图4b至图4d结果的变化趋势;图4a的叶绿素a浓度主要在近岸表层(M16站位附近)出现高值;图4e的叶绿素a浓度分布也同样与POC表层分布相似。粒径分级叶绿素a浓度结果显示(图5),不同粒径浮游生物对叶绿素a浓度的贡献存在差异。近岸水体中微型浮游生物粒径占主导,即在霞关与三个尖附近海域(站位 M02、M07、M08和 M09)对叶绿素a浓度贡献较大的是微型浮游生物。而在远岸水域,小型浮游生物逐渐增加,并且在离岸最远的调查海域(站位M04、M05、M12和 M13),小型浮游生物成为主要的优势种群。
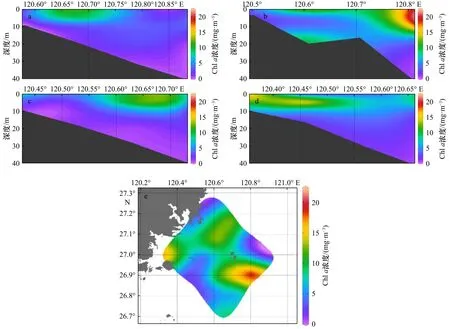
图4 2019年闽东沿海夏季Chl a浓度分布Fig.4 The distribution of Chl a concentration in the coast of eastern Fujian in summer of 2019
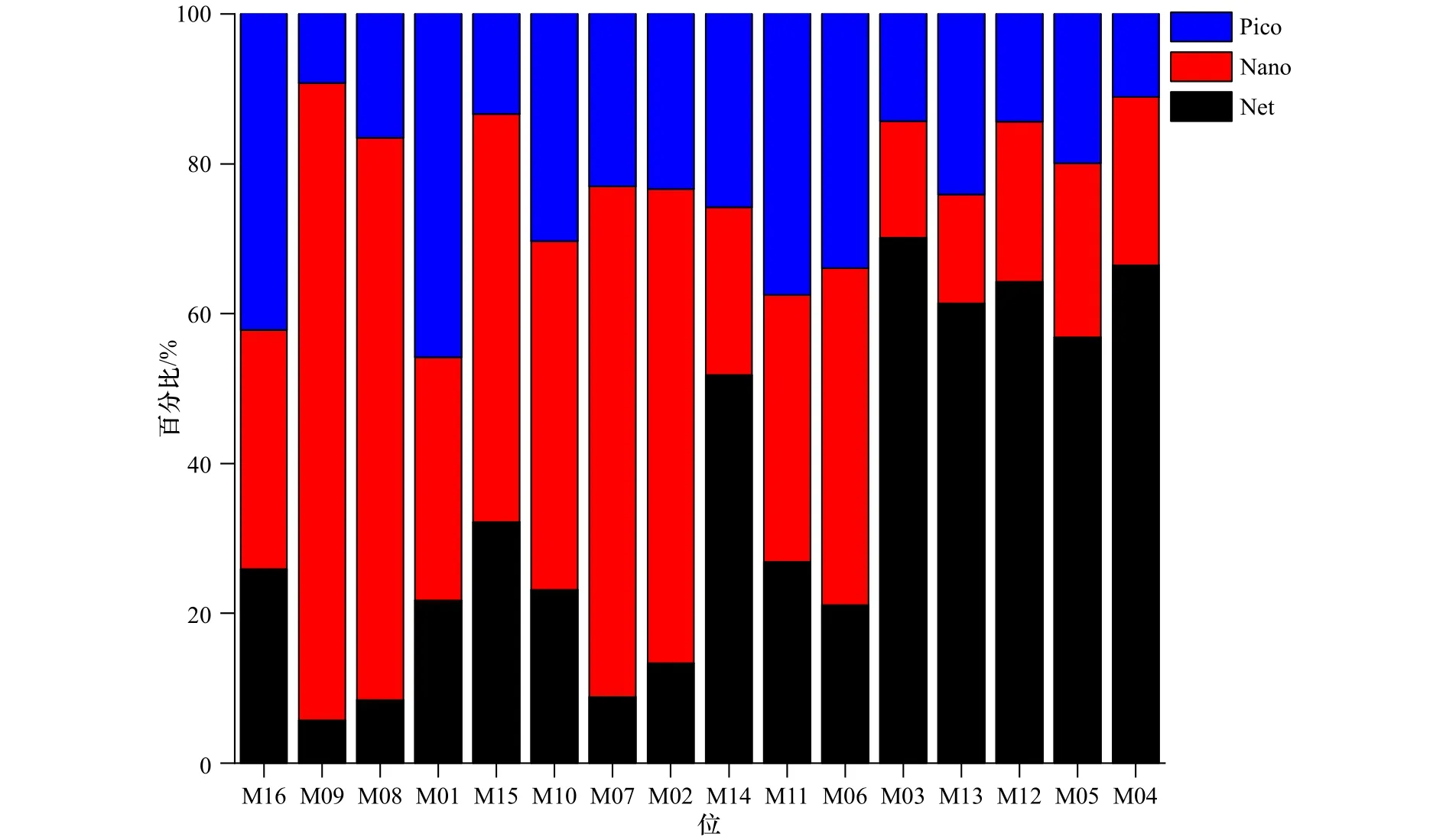
图5 闽东沿海叶绿素a粒径相对组成结构Fig.5 Size fractions of Chl a in the coast of eastern Fujian
3.5 各参数相关性分析
为了能进一步探究TEP与各项参数之间的内在联系,本文分别对TEP(图6a)、TEP含量/Chla浓度(图6b)和TEP对POC的贡献率(图6c)与其他环境因素进行了相关性分析。从图6a中我们可以看到,TEP含量与浊度和5项营养盐浓度呈正相关,与pH、DO浓度和小型浮游生物(Net)量呈负相关。在图6b中,TEP含量和Chla浓度比值与水温、pH和DO浓度呈负相关,与盐度、浊度、5项营养盐浓度(除硝酸盐外)呈正相关。在图6c中,TEP对POC的贡献率与浊度和5项营养盐呈正相关,与水温、pH、DO浓度、小型浮游生物(Net)量和Chla浓度呈负相关。
4 讨论
4.1 不同地区TEP含量比较
对比世界上其他海域TEP的含量(表2),我们可以看到,夏季闽东沿海的TEP含量范围与圣劳伦斯河口[29]相近,高于大西洋东北部[30]、南极半岛[31]、以色列亚喀巴海湾[32]以及印度多纳波拉湾[33]等海域,低于珠江口[21]、英吉利海峡[34]和日本Otsuchi海湾[35]等地区。TEP大体的变化趋势为从近岸河口向大洋开阔海区逐渐减小。这种变化主要是由于TEP的生产过程受多种因素影响造成。相对于开阔大洋来说,近岸河口区域营养盐水平较高,其TEP的形成一方面受多种浮游植物、底栖生物以及细菌等种群影响,另一方面也受悬浮颗粒物等非生物因素影响,TEP往往能在该区域产生较高的聚集累积。所以TEP的分布主要表现为近岸高于开阔大洋,此外,开阔大洋区域TEP的高值往往在表层,而本文研究中TEP高值出现在底层。这种差异产生可以有两种解释:(1)开阔大洋垂直水深远大于近岸水深,TEP从表层沉降至底层历时较长,故其被细菌等微生物分解的程度明显大于近岸,到达底层的TEP也就少于表层;(2)近岸底层水体扰动要比开阔大洋剧烈,来不及分解的TEP在近岸沉积后又会被搅动至底层水体中,导致底层TEP含量增多。实际上,非所有海域TEP分布模型都如此,TEP的分布必须要视当地环境进行具体分析。

表2 世界不同海域TEP含量分布Table 2 Summary of TEP contents around the world
4.2 夏季闽东沿海TEP含量变化的驱动因素
盐度、浊度和营养盐变化作为生物的选择驱动力影响着浮游植物的时空演替[38],而浮游植物分泌的胞外多糖是TEP的主要来源之一[6],因此,TEP也会受到盐度、浊度和营养盐的间接影响。同时,TEP通过其前体的非生物形成也主要受环境条件[6]影响,例如湍流混合、离子作用和无机胶体的浓度,而这些前体的类型和浓度往往取决于浮游植物本身。由此可见,TEP一般与浮游植物直接关联,与盐度、浊度、营养盐等环境因素有良好的相关性。但本文图6a结果显示,TEP仅与浊度和各项营养盐有良好的相关性,与Chla的相关性不佳,说明TEP与Chla之间的联系可能受其他因素影响而被打破。
研究表明,酸性多糖的生产速率或者藻类适应能力存在差异,TEP含量的峰值相对于TEP生产者的峰值会具有时滞效应[38],即在浮游植物开始衰退阶段,TEP会大量产生。根据营养盐数据(表1),此时硅酸盐、磷酸盐等营养盐浓度仍处于浮游植物生长的最低阈值之上,说明海域受营养盐限制的可能性较小。计算得到的溶解氧饱和度整体上小于100%,即溶解氧在调查期间处于不饱和状态,说明海域此时的生物呼吸作用大于光合作用。遥感数据(图7)显示,曲线的峰值代表藻华暴发的最高值,峰值左侧则表示藻华处于暴发阶段,右侧则表示藻华开始进入衰退阶段,因此调查期间该海域近岸表层水体(除M15站位)处于藻华暴发之后的衰退阶段,仅M04、M05、M12和M13站位所处的远岸水体处于藻华暴发阶段。本文图6a结果显示,TEP含量分别与DO浓度和pH呈负相关(R=-0.572,p<0.01;R=-0.667,p<0.01),表明海域浮游植物整体趋向于衰退阶段,此时浮游植物的分解和代谢活动远大于光合作用,从而导致海域溶解氧处于不饱和状态。伴随着DO的减少和CO2的增加,pH降低,TEP也因浮游植物衰老死亡而大量产生。

图6 闽东沿海各参数的相关性Fig.6 Correlation of various parameters along the the coast of eastern Fujian
此外,TEP含量与叶绿素a浓度的比值能间接反映浮游植物生长状况与周围环境因素的关系[39],因此,在营养盐受限制的区域或者是浮游植物处于衰退期,其比值往往会升高。本文通过计算其比值发现,近岸比值比远岸要高,且最高值出现在M01站位附近。结合图6b来看,TEP含量与叶绿素a浓度的比值与浊度和各项营养盐浓度(除硝酸盐外)呈正相关,与DO浓度和pH呈负相关,其结果与图6a中一致,这便证明海域此时营养盐浓度并非限制因素,海域TEP的大量形成与浮游植物衰退有关。浮游植物在近岸达到衰退阶段,同时受浊度等因素影响,释放大量TEP,此时叶绿素a的浓度已经降低,因此TEP含量与叶绿素a浓度的比值在近岸较高。而随着离岸距离增加,浮游植物生长状态发生变化,远岸仍处于生长阶段,此时的比值较近岸低。造成其比值南北差异的原因有可能是因为南部海域浮游植物已经过了生长衰退期,又开始新的生长期阶段,之前累积的TEP大部分已经沉降和降解。至于TEP含量与叶绿素a浓度的比值与水温呈现负相关的结果,本文认为,这可能与底层生物有关。随着深度增加,水温逐渐降低,相对于浮游植物,底层环境更适合一些微型底栖生物等生长。Wolfstein等[40]利用潮间带数据估算出了微型底栖生物在胞外聚合物(包含TEP)中的贡献,其释放的碳含量可达70%左右。此外,高含量的碎屑物质和异养细菌[41]能够产生TEP,并通过TEP的黏性聚集沉降至底层。说明微型底栖生物及一些异养细菌也可能会影响TEP的形成,从而导致TEP含量与叶绿素a浓度的比值增大。由于本研究缺少底栖生物与细菌的有关鉴定信息,因此底栖生物及异养细菌对底层TEP的贡献比例仍待进一步研究。
浊度往往反映海域颗粒再悬浮作用的影响,当悬浮颗粒物含量达到一定水平,光线透过水体受阻,从而导致海域处于光限制环境[5]。已有许多研究分别通过现场以及实验室培养证明,受环境胁迫的浮游植物产生的TEP要比健康的浮游植物产生的多[35],并且由于TEP的黏性特征[6,42],使其在伴随着由潮汐涨落导致的盐度梯度和湍流作用过程中,促进了悬浮颗粒物质的聚集和沉降,反过来影响河口悬浮颗粒的动态分布[5]。在沉降管实验[43]中也发现,TEP富集与沉降颗粒物的比例呈正相关,使得悬浮颗粒物聚集的高浊度水体往往是TEP的高值区。本文图6a显示,TEP含量与浊度具有良好的正相关性,且其相关性(R=0.812,p<0.01)较其他参数而言最大,由此可见,海域TEP分布主要受颗粒再悬浮作用影响。颗粒物再悬浮作用不仅扰动水体导致营养盐的增加,同时也遮蔽光线抑制了浮游生物的生长,而且水体混合促进了TEP的形成。因此,相比于开阔大洋的主控因素为浮游植物,影响本研究海域TEP分布的主控因素为颗粒物再悬浮作用,TEP与浮游植物之间的直接联系受其影响而改变。其他研究中报道的TEP含量与叶绿素a浓度相关性较弱的地区大多为贫营养海域[33],本文调查海域TEP含量与叶绿素a浓度之间的相关性问题并非营养盐造成,而是浮游植物生长衰退后释放的TEP受再悬浮作用等水动力因素造成。
4.3 闽东沿海TEP含量变化与浮游植物粒径的关系
图6a结果显示,TEP含量与Net粒径级别的小型浮游生物量整体上呈负相关关系(R=-0.352,p<0.01),表明随着海域中小型浮游生物整体上处于生长衰退阶段,Chla浓度降低但生物释放的TEP含量增加。通过图5的叶绿素a粒径组分分析,我们发现,近岸海域以微型浮游生物为主,远岸以小型浮游生物为主要优势种。闽东沿岸夏季硅藻类在种类和数量上均占主导地位,且优势种主要是中肋骨条藻(Skeletonema costatum)、旋链角毛藻(Chaetoceros curvisetus)和柔弱伪菱形藻(Pseudonitzschia delicatissina)等[25],而这些硅藻类主要为Net级的小型浮游植物。结合遥感数据(图7)结果推测,闽东海域近岸可能经历了小型浮游生物向微型浮游生物转变的过程,而远岸正处于小型浮游生物旺发阶段。这些小型浮游生物以上述的硅藻为主,因此近岸海域的硅藻在衰退阶段释放的TEP会比远岸要高。

图7 闽东沿海遥感Chl a浓度数据Fig.7 Remote sensing data of of Chl a concentration in the coast of eastern Fujian
此外,近岸海域浮游生物尺寸发生变化可能受到再悬浮作用的影响。有研究发现,在浊度较大的水层中经常观察到一系列适应弱光的浮游植物种类[44],这类浮游植物种类往往体积较小,比表面积较大。其能够在高度混浊的环境中生长,通过降低暗呼吸速率,增加附属色素和叶绿素a细胞含量来提高它们光合利用的效率[44]。而且河口的高度垂直混合和再悬浮条件增加了水体中的营养盐供给[45],也为这些适合低光照条件的类群提供生长环境,形成竞争优势[46],因此其常出现在河口等浑浊系统中。闽东海域硅藻作为主要的优势种群,虽然其主要属于小型浮游生物,但在海域中常常会有微型以及微微型级别的浮游生物存在(图5中Pico、Nano粒径的浮游生物仍有一定占比),因此其在一定程度上证明了海域再悬浮作用的影响。由于目前仍然缺乏浮游植物尺寸对其TEP生产能力差异的研究,因此对该海域不同尺寸浮游植物对TEP的贡献方面还需要更深入的研究。
4.4 闽东沿海TEP含量与POC的关系
在本文相关性数据分析中,TEP含量与POC含量 表 现 为 正 相 关 (R=0.573,p<0.05),说 明 TEP与POC存在耦合关系。TEP是多糖物质,其具有黏性特征,可以与其他颗粒有机质相结合,从而形成更大的颗粒有机物[10],因此TEP在POC中往往会占有较大比例。通过换算,本研究中TEP对POC的贡献率为9.8%~110.8%,平均为(44.8±101.7)%。考虑到本文TEP与POC过滤采用的膜截留效率存在差异[27](孔径分别为 0.4 μm 和 0.7 μm),转换因子计算值偏高,同时 TEP黏性作用聚集POC,本文结果可能高估了TEP对POC贡献率。Malpezzi等[43]计算也发现,TEP的平均碳含量占切萨皮克湾上游总POC测量值的32%,最高可达89%,本文结果与文献中描述的结论相近,也再次表明TEP对海水中POC的重要贡献。
POC的来源途径分为陆源(陆地径流等输入)、海源(海洋生物生产)以及海底沉积物的再悬浮[47]。由于本文的研究海域受陆地径流影响不明显,陆源对海域的影响相对较小,因此POC主要来源于海洋生物及其新陈代谢产物[47]。浮游植物及其残骸作为POC的主要贡献者,受光照、营养盐和其他生物活动影响往往会导致POC含量分布发生变化。此外,沉积物中POC的再悬浮作为海洋POC的一个重要来源,其受风、海流和底栖生物扰动因素影响也会导致POC含量产生变化。本研究中TEP对POC的贡献率与TEP分布情况相近,这表明,影响TEP对POC贡献率的因素也可能与TEP分布的影响因素相似。从图6c的结果中,我们可以看到TEP对POC的贡献率与各参数的相关性与图6a的结果相近,说明海域此刻处于高营养环境,浮游植物(主要是Net粒径的小型浮游生物)在衰退阶段为水体提供了大量的POC,而这当中很大一部分POC可能是由TEP在颗粒物再悬浮作用下形成。另外,我们发现,贡献率与水温出现负相关,这与TEP含量与Chla浓度比值类似,表示底栖生物可能部分通过TEP的形式对POC有所贡献。
5 结论
综上所述,夏季闽东海域TEP分布具有较强的区域特性,表现为近岸高、远岸低,表层低、底层高的趋势。闽东沿海TEP含量与浊度、营养盐浓度等呈正相关,与DO浓度、pH和小型浮游生物量呈负相关。近岸海域在调查期间处于藻类水华衰退阶段,TEP在此时大量产生,而其分布主要受控于颗粒物再悬浮作用。相对于其他尺寸浮游植物,小型浮游生物可能对海域TEP的贡献最大。此外,TEP对POC的贡献程度与TEP分布结果相近,这当中很大一部分POC可能是由TEP形成。浮游植物的生长及群落结构受季节变化的影响,因此,进一步了解闽东海域TEP的时空变化及产生机制需要我们开展长时间尺度的观测及研究。

