山东地区1056例新生儿听力筛查联合耳聋基因筛查结果分析
孙毅 刘雅琳 刘晓莉 孙丽丽 潘持国 张斌
山东省康复研究中心(山东省康复医院)(济南250109)
耳聋是由遗传因素或环境因素导致的生理机能缺陷,严重影响人类健康和生活质量。耳聋可以由单个基因位点突变或多基因位点突变引起,也可以由环境因素或基因和环境因素共同导致[1]。研究发现65%的耳聋是由遗传因素引起的[2]。随着对新生儿听力筛查工作的开展,常规听力学筛查逐渐显现一定的局限性,不能及时发现药物性耳聋和迟发性耳聋。因此,遗传性耳聋基因筛查联合听力筛查尤为重要。本研究利用NGS Panel技术对山东地区新生儿进行遗传性耳聋基因检测,相比于质谱检测方法和微阵列芯片检测方法,该方法可覆盖更多致聋基因和致聋位点,有利于实现早预防、早发现、早干预、早康复的长效机制,为政府制定听力残疾防控体系提供科学依据,最终达到防聋减残、提高人口素质的目标[3]。
1 对象和方法
1.1 研究对象
研究对象样本主要来源于2019年4月至2019年10月,在山东省内各地分娩的新生儿1056例,筛查前已明确告知听力筛查和遗传性耳聋基因检测的相关知识,监护人或家属签订知情同意书。
1.2 听力检测方法
新生儿出生2-3天后,在自然睡眠状态或喂奶安静状态下,在环境噪声小于40dB(A)的房间内,分娩医院使用耳声发射(Oto-acoustic Emissions,OAE)进行听力筛查,由仪器自动判读“通过”或“不通过”,听力初筛未通过的新生儿,需要42天后进行复筛。复筛未通过会将检测结果告知家长,并要求3月龄时进行听力学诊断。
本研究听力损失程度以听性脑干反应(audi‐tory brainstem response,ABR)检测结果为参照标准进行判定。ABR波Ⅴ反应阈值≤30dB nHL为听力正常的标准,波Ⅴ反应阈值为31~ 50dB nHL视为轻度听力损失,波Ⅴ反应阈值为51~ 70dB nHL视为中度听力损失,波Ⅴ反应阈值为71~ 90dB nHL视为重度听力损失,波Ⅴ反应阈值>90dB nHL视为极重度听力损失。
1.3 耳聋基因检测方法
新生儿出生2天后,由各助产机构使用特定采血卡,采集新生儿足跟血2个血斑,每个血斑直径不得小于8mm,常温下自然晾干,分别装入自封袋内。实验室负责对标本质量进行验收,验收合格后邮寄至北京博奥医学检验所有限公司进行18个遗传性耳聋基因100个位点NGS Panel检测,并在10个工作日内将检测结果反馈至新生儿出生分娩机构。最后联合听力筛查结果和遗传性耳聋基因检测结果,随访新生儿听力损失发生情况。
1.4 检测流程
北京博奥医学检验所有限公司实验室首先进行核酸提取,使用多重PCR技术一次性对GJB2,SLC26A4,GJB3,MYO15A,TECTA,DIABLO,COCH,DSPP,GPR98,DFNA5,TMC1,MT-CO1,MT-RNR1,MT-TH,MT-TS1,MT-TL1,PRPS1,MYO7A,18个致聋基因的100个已知致病位点进行检测。对于阳性结果,使用Sanger测序复核结果后再进行报告发放。
2 结果
2.1 听力检测结果分析
在1056例新生儿中,其中听力筛查未通过者5人(0.47%),经听力学诊断确诊听力损失患儿3人(见表2),占筛查未通过的60.00%。其中,1例右耳中度听力损失,左耳轻度听力损失,另外2例单独左耳轻度听力损失。
2.2 基因检测结果分析
对1056例新生儿全部进行18个遗传性耳聋基因100个位点检测,发现耳聋基因突变者77例,检出率为7.29%(见表1)。通过检测结果分析显示SLC26A4基因杂合突变检出37例,检出率为3.50%;GJB2基因突变检出30例,检出率2.84%,其中杂合突变29例,复合杂合突变1例;GJB3基因杂合突变检出8例,检出率0.76%;线粒体12SrRNA基因均质突变1例,检出率0.10%。SLC26A4基因突变合并线粒体12SrRNA基因突变的双基因突变检出1例。在3个听力损失患儿中遗传性耳聋基因检测阳性2例,分别为SLC26A4基因c.2168A>G杂合突变和GJB2基因c.176-191del16/c.253T>C复合杂合突变,阴性1人。

表1 1056例新生儿中100个致聋基因突变的携带率Table 1 Carrier frequency of 100 hotspot mutations 1056 randomly-selected cases
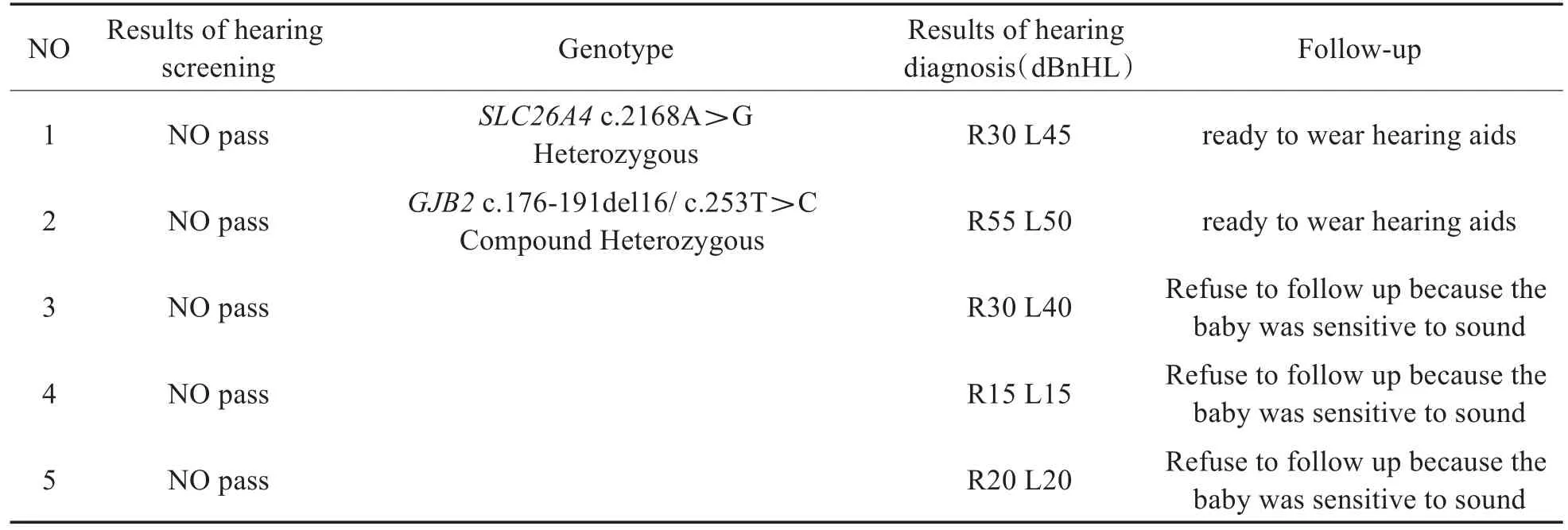
表2 儿童基本信息及听力结果Table 2 Demographic information and audiological diagnoses of subjects
3 讨论
耳聋是影响人类健康和造成人类残疾的常见疾病。目前研究主要针对少数常见的与耳聋相关的基因中有限的热点突变位点,只有少数能通过检测寻找突变[4]。本研究采用NGS Panel的方法,检测与耳聋相关的18个遗传性耳聋基因中的100个致聋位点。如此大范围的基因检测覆盖率有效的弥补了常规检测方法的不足,不仅对耳聋相关基因突变频率的预期更加准确,也可以为医务工作者对患者明确病因提供更加可靠的检测结果。
3.1 耳聋基因携带者检出结果分析
本研究共检测山东地区新生儿1056例,耳聋基因筛查突变者77例,检出率7.29%。高敏等对1737名孕妇进行18个遗传性耳聋基因100个致聋位点检测,发现遗传性耳聋携带率7.25%[5],本研究结果与其报道基本一致。Shui lian Chen等对近年来全国各地区报道的18篇新生儿遗传性耳聋基因检测的文献进行meta分析,发现全国各地新生儿遗传性耳聋基因携带率为4.70%[6]。王秋菊等对近年来全国出生的110余万例新生儿进行遗传性耳聋基因检测结果分析,发现遗传性耳聋基因在新生儿中的携带率为4.78%[7]。两项研究结果表明,在我国常见的遗传性耳聋基因携带率基本一致。在此之前,山东地区学者报道了本地的遗传性耳聋基因携带率,孙磊报道山东省济宁市新生儿耳聋基因阳性检出率为5.60%[8]。本研究的遗传性耳聋基因阳性检出率高于孙磊报道的5.60%,原因可能是检测的目的致聋基因数量、方法及突变位点存在差异。查阅文献发现,目前我国最常见的耳聋基因检测为9项、15项耳聋基因芯片检测和20项飞行时间质谱检测。每个地区检测结果显示,GJB2基因与SLC26A4基因变异携带率较接近[9]。参考孙磊报道数据(SLC26A4基因突变携带率2.19%),发现本研究的SLC26A4基因检出率增加最明显,增加率占总检出率的17.97%(1.31%/7.29%)。孙磊、王秋菊等的检测方法为飞行时间质谱技术和耳聋基因芯片技术,对中国人常见GJB2、GJB3、SLC26A4和线粒体12srRNA等4个耳聋易感基因进行检测。本研究的检测方法为NGS Panel法,对18个遗传性耳聋基因100个致聋位点进行检测。因此造成本研究遗传性耳聋基因携带检出率高于孙磊等报道的5.60%及王秋菊等报道的4.78%。
3.2 遗传性耳聋基因携带者等位基因检出率分析
依据检测结果中遗传性耳聋基因携带者等位基因分析,本研究中SLC26A4基因的c.IVS7-2A>G位点突变检出率最高,为1.80%(19/1056),其次分别为c.2168A>G 位点0.66%(7/1056),c.697G>C位点 0.28%(3/1056),c.1174A>T、c.2027T>A 位点0.19%(2/1056),c.1975G>C、c.439A>G、c.259G>T、IVS16-6G>A位点0.10%(1/1056)。学者研究报道,SLC26A4基因含有21个外显子,在我国,约96%的前庭水管扩大由此基因突变致病,在欧美国家仅有40%左右。说明在中国人群中SLC26A4基因型与表型关系更密切。许晖雁等的研究分析表明此基因的突变患者人工耳蜗术后听力言语康复效果普遍较好,并且SLC26A4基因突变是独立的预后因素[10]。在中国聋病人群中最常见的突变位点为 c.IVS7-2A>G,其次为 c.2168A>G[11]。2019 年Mahbobeh等对中东伊朗地区聋人基因检测发现,SLC26A4基因的检出率为6.39%,其中以c.1334T>G位点最为常见[12]。因此表明SLC26A4基因位点突变存在着明显的地域和种族差异。本研究结果与我国前人研究结果一致,主要突变位点为c.IVS7-2A>G。
GJB2基因突变发生频率最高位点是c.235delC,突变率为1.80%(19/1056),其它位点依次 为 c.299_300delAT位 点 0.47%(5/1056)、c.176del16位点0.38%(4/1056)、c.94C>T位点0.10%(1/1056)。GJB2基因突变在北欧犹太教徒、高加索人中,出现频率较多的基因位点突变分别是c.35delG、c.167delT 和 c.235delC[13]。 在 亚 洲 ,c.235delC是最常见的位点突变,突变率为5.22%,戴朴等在2009年对2063例中国非综合征性耳聋患者进行GJB2基因突变频谱研究发现,c.235delC突变位点最为常见,占GJB2基因致聋突变的68.9%,其次为c.299_300delAT[14]。本研究GJB2基因致聋位点与戴朴等的研究一致,突变频率最高位点分别为c.235delC和c.299_300delAT。同时本研究发现罕见致病位点c.94C>T[15],但本研究的突变检出率远远低于戴朴等的报道,原因在于本研究的对象为新生儿,前人研究多集中在听障人群。
3.3 听力筛查情况及基因阳性听力学特点
本研究新生儿听力筛查特点,在1056例新生儿中听力筛查未通过者5人,占全部人数的0.47%。经听力学诊断,确诊听力损失患儿3人,其中2人耳聋基因检测阳性。发现GJB2基因复合杂合突变患者1例,听力学诊断结果显示,右耳中度听力损失,左耳轻度听力损失,经过随访发现听力保持稳定,未出现听力再次下降。文献报道,GJB2基因纯合或复合杂合突变的儿童听力损失程度以重度为主[16],需长期跟踪随访。本研究中3例听力筛查未通过的新生儿中,有1例通过18个致聋基因检测,结果未见异常,表明可能存在检测位点之外的基因突变,所以耳聋基因检测并不能取代听力筛查。但若不进行基因检测,由遗传性因素导致的耳聋患者不能明确病因,以及耳聋基因携带个体不会被跟踪随访,可能会对其父母再生育和他们的后代造成影响。目前耳聋疾病没有理想的治疗措施,但新生儿耳聋基因检测是听力筛查的重要补充,听力筛查与耳聋基因联合筛查可最大限度地早期发现聋病人群[17]。听力检测通过组的2名婴儿被检测出带有MT-CO1:m.7444G>A突变,应一生停用氨基糖苷类抗生素,以避免药物诱发性听力受损。特别是我们发现听力检测通过组的一名婴儿同时也带有其他基因突变。我们建议其尽早注意听觉易感性变化,并且关注听力健康。
4 结论
基因突变具有随机性、不定向性、多害少利等特点,因此,本研究利用NGS Panel检测技术对山东地区1056例新生儿进行检测,旨在提高检测率,了解该地区可能致聋基因携带情况,为山东省新生儿耳聋的积极干预和治疗提供了指导,为耳聋相关基因突变频率的准确估计提供了依据。

