有机胺非水溶液吸收CO2的动力学研究进展
平甜甜,尹鑫,董玉,申淑锋
(河北科技大学化学与制药工程学院,河北石家庄 050018)
引 言
二氧化碳排放引起的全球气候变化是21世纪人类面临的严峻挑战,限制CO2大规模排放已成为全球普遍共识和大势所趋。二氧化碳捕集、利用和封存(CCUS)作为一项有望实现化石能源利用近零排放的技术,受到国际社会的广泛关注[1-2]。化学溶剂吸收法是目前二氧化碳捕集最常用且成熟度最高的技术,其中有机胺水溶液是常用的化学吸收剂[3]。在现代工业烟气处理中,单乙醇胺(MEA)、二乙醇胺(DEA)和甲基二乙醇胺(MDEA)等是典型的有机醇胺类吸收剂。与其他有机胺相比,MEA具有分子量小、与CO2反应速率快且价格低廉等优点,在处理不同碳排放源中应用广泛,被认为是具有代表性的第一代吸收剂,常作为比较基准评价开发的新型吸收剂。然而,再生能耗大、捕集成本高和严重降解问题是阻碍该技术大规模工业化推广和应用的关键。从吸收剂再生能耗角度考虑,使用有机胺水溶液,特别是采用水溶剂,是该技术存在的最大弱点。主要原因是由于水溶剂的比热容大和高温解吸条件下水分大量汽化,升温显热和汽化潜热造成的高再生能耗(约占总能耗的50%~70%)以及水溶液对设备的较强腐蚀性成为限制该类吸收剂进一步大规模发展的两大缺点。同时在高温再生过程中MEA发生降解使吸收性能下降,需要不断地补充新吸收剂,使捕集成本增加。采用有机溶剂如甲醇、乙醇、丙醇、乙二醇(EG)等代替水溶剂在降低能耗方面具有较大的潜力,并且还具有减少设备腐蚀、加快反应速率以及降低解吸温度的优点,因此引起了国内外学者的广泛关注。与传统吸收剂水溶液相比,非水吸收剂比热容低,在与CO2反应时没有水参与反应,在极性较弱的溶剂中反应产物稳定性差、易分解,可以降低吸收剂的再生温度,并且一些有机溶剂的沸点较高,蒸发损失小,可以显著降低再生过程的显热和汽化潜热的能耗[4-5],从而达到了降低能耗的目的。
为了提高吸收性能,降低捕集能耗和成本,学者们在开发性能优良的有机胺方面也做了大量的研究工作。一类有机胺是在MEA的氮原子上连接供电子的直链烷基基团,可以增加胺的碱性,但不会产生明显的空间位阻效应,从而能够加快反应速率[6]。比如2-(甲氨基)乙醇(MMEA)、2-(乙氨基)乙醇(EMEA)、2-(丁氨基)乙醇(BUMEA)等[7-8]。另一类研究较多的是空间位阻胺,主要包括分子中的氨基与叔碳原子相连的伯胺,或氨基与仲碳或叔碳原子相连的仲胺,由于与氨基连接的烷基基团有显著的空间位阻效应,使吸收产物氨基甲酸离子的稳定性降低,因而比传统的有机伯胺的再生热低,而且吸收负载量可以达到1.0[9]。典型的空间位阻胺包括2-氨基-2-甲基-1-丙醇(AMP)[10-11]、2-哌啶醇(2-PE)[12-13]等。但是空间位阻胺在增大吸收容量的同时不可避免地会降低吸收速率,通常与高活性的添加剂如哌嗪(PZ)配合使用来弥补由于空间位阻效应而导致的吸收速率降低的影响[9]。从吸收反应热的角度看,不管是水溶液还是非水溶液,有机叔胺的反应热均低于伯胺和仲胺。通常认为叔胺在水溶液通过碱催化水合反应促进CO2吸收,但在非水体系中CO2和叔胺之间的反应近似为零,理论上吸收速率和吸收容量与物理吸收和物理溶解度相当。另外,近年来国内外研究者对多元胺吸收CO2的关注也逐渐增加,其中包括乙二胺(EDA)[14-15]、二乙烯三胺(DETA)[16]、三乙烯四胺(TETA)[17]、四乙烯三胺(TEPA)[17]等含多个伯胺或仲胺基团的化合物,可使吸收剂的负载量和反应速率大大提高,常被用作高效活化剂。CO2吸收效率是评价新型吸收剂捕集性能的关键参数。Barzagli等[8]对一系列单组分胺及其与乙二醇或丙醇的混合非水体系进行了连续吸收-解吸循环实验。张永春等[18]构建了吸收性能优良的EMEA/N,N-二乙基乙醇胺(DEEA)混合非水吸收剂。Kang等[19-20]在MEA水溶液中加入甲醇、乙醇、乙二醇和丙三醇来降低水的质量分数,并在连续循环工艺中评估了它们的吸收解吸性能。Im等[21]的研究证明仲胺与乙二醇混合体系是高效可逆的CO2吸收剂。Liu等[22]将叔胺TETA与AMP在乙醇中混合,作为非水吸收剂用于CO2捕集,与水溶液相比有更高吸收负载和再生效率。另外,MEA、DEA[23]、二异丙醇胺(DIPA)[24]、MDEA[25]在一系列有机溶剂中的吸收速率也被测定,这些有机溶剂包括甲醇、乙醇、2-丙醇、丁醇、乙二醇、丙二醇、碳酸丙烯酯。Masuda等[26]研究了二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、吡啶、乙腈、苯和水等溶剂对CO2反应产物的影响。另一个重要参数是评价吸收剂在解吸过程中的再生能耗。Hutchinson[27]用乙二醇代替水与MEA混合用于酸性气体脱除,比MEA水的能耗更低。Lin等[28]研究了一些有更高的吸收解吸性能和更低的再生能耗的胺/醇/贫水体系。Barbarossa等[29]研究了AMP与不同的有机溶剂混合,并提出了低温溶剂再生工艺。Yu等[30]提出了MEA/甲醇非水解吸工艺,该吸收剂能够在低于373 K的温度下再生,大大节约了能量消耗。Yu等[31]在旋转填充床中研究了哌嗪与二甘醇混合体系的再生,发现该非水溶剂在再生过程中几乎不挥发,避免了热降解。Guo等[32]提出采用MEA和醇醚溶剂组成的非水体系吸收捕集CO2,发现其捕集循环容量约为水体系的2倍,而且再生能耗降低约50%。非水胺吸收体系在降低热能消耗或低热值能源利用等方面呈现了较大潜力,因而在一些碳排放源治理方面具有较好的应用前景。然而,从报道的非水溶液物性数据发现,大部分非水体系的黏度较高,特别是吸收CO2后溶液黏度急剧增加,这将对吸收过程传质性能产生不利影响[5,25,32]。同时,对挥发性、降解性等吸收剂物化性质评价也是应用考虑的重要方面。
在新型碳捕集工艺和吸收剂实现工业化的过程中,反应动力学数据不仅是评价新型吸收剂性能优劣的重要参考依据,更是过程工艺设计、吸收过程模拟优化等方面的重要指标。例如,有机胺与CO2的反应动力学对吸收塔的高度有显著影响,吸收相同量的CO2,反应速率高的体系所需的吸收塔高度更低,从而有效降低吸收塔的设备投资成本[33]。因此,对不同体系吸收剂的动力学研究,建立动力学模型具有重要的实际应用价值。Garcia等[34]研究了四种有机溶剂对有机胺水溶液吸收动力学的影响。Kadiwala等[35]研究了两个伯胺,EDA和3-氨基-1-丙醇(3-AP)在极性溶剂如甲醇、乙醇中的吸收动力学。为了结合不同类型有机胺的优势,一些学者提出了混合胺溶液体系,并进行了吸收动力学方面的研究。文娟等[16]以MEA为基体,添加DETA构建混合胺溶液,发现比单胺MEA溶液的CO2吸收量提高了20%,吸收速率增加了12%。陆诗建等[36]对羟乙基乙二胺(AEEA)/哌嗪(PZ)和AMP-PZ复合体系进行了吸收CO2的反应动力学研究。虽然目前对CO2与各种有机胺之间的反应机理和动力学做了许多研究,然而在非水溶剂中的反应动力学研究缺乏较系统的分析。由于没有水的存在,有机胺非水体系在反应产物、吸收机理等方面有较大的不同,而且对同一种有机胺在不同非水溶剂的动力学行为差异性有待深入的理解。本文对CO2与各类有机胺在非水溶剂中的反应机理,对动力学研究常用实验装置及原理,动力学研究的基础理论分别进行了阐述,重点对文献中报道的动力学数据进行了汇总分析,并对非水吸收剂的发展方向进行了展望,为后续有机胺非水吸收剂CO2捕集技术的研究提供必要的参考。
1 非水有机胺溶液吸收CO2 反应机理
1.1 有机胺与CO2反应
与有机胺水溶液吸收CO2的反应机理类似,在非水溶液中伯胺和仲胺与CO2的反应也可以用两性离子机理[37-41]和三分子机理[42-43]来解释。两性离子机理包括一种中间产物即两性离子的形成[式(1)]及其在碱的作用下去质子化[式(2)]两步反应:
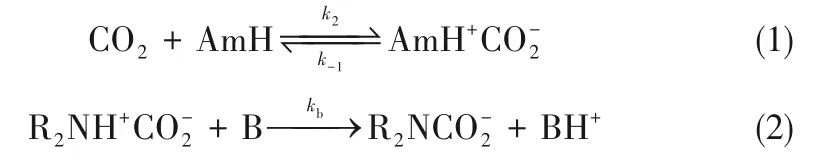
式中,k2代表正反应速率常数,k-1代表逆反应速率常数,kb代表碱作用两性离子去质子化的反应速率常数,非水溶液中的碱B可以代表胺和非水溶剂。当两性离子浓度和CO2的一级行为均在准稳态时,CO2的总反应速率可以表示为式(3):

由于在拟一级反应条件下,胺的浓度Camine一直保持远大于CO2的浓度,所以式(3)可以被写为式(4):

此时,总拟一级反应速率常数k0(s-1)用式(5)表示:

在上述的式(3)或式(5)中存在两个边界条件:
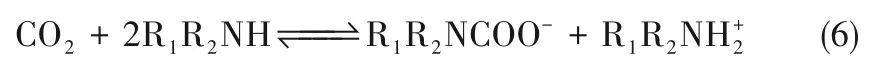
实际上在非水溶剂中,胺的去质子化过程会受到碱度和空间位阻效应等影响,因此对胺的反应级数大部分在1~2之间[41]。
三分子机理是指有机胺与CO2发生反应的同时也与一分子碱性物质反应,该过程一步进行并生成较弱键合的络合物形式,如式(7):
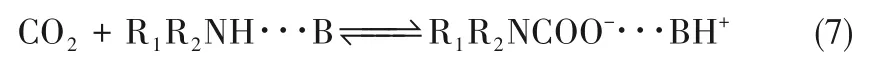
在非水溶液中,一般情况下仅有机胺作为碱性物质(B)参与中间态络合物形成,所以吸收CO2的总反应速率可以表示为式(8)。反应速率表达式与两性离子机理的第二种边界条件表达式相似。
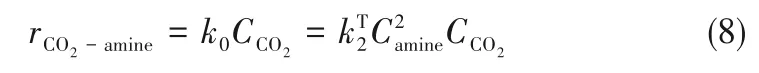
叔胺与CO2的反应机理不同于伯胺和仲胺,通常用碱催化水合反应机理[25]来解释CO2与叔胺在水溶液中碳酸氢盐的反应产物。在非水溶剂中,叔胺理论上不会与CO2发生反应。
1.2 非水溶剂与CO2的反应
一些研究发现,有机溶剂(如乙醇、乙二醇等)在碱性环境中可以与CO2发生反应,生成少量稳定性较差的烷基碳酸酯反应产物,如式(9),文献[44-45]中也有报道。由于该反应对CO2吸收过程的贡献较小,在大部分的动力学研究中通常被忽略。
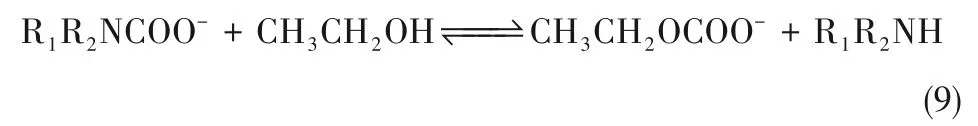
另外,在一些非水醇溶剂(HSol)中溶剂化的碱性叔胺能与溶解的二氧化碳反应,形成离子对产物,如式(10)。
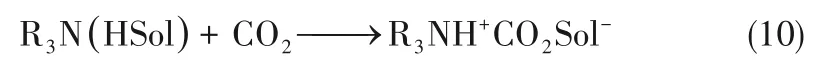
2 动力学实验装置
反应动力学研究常用的实验装置包括停流法装 置(stopped-flow technique)、搅 拌 池 反 应 器(stirred cell reactor)、湿 壁 柱 装 置(wetted wall column)、微流控制(microfluidic technique)、层流射流 吸 收 器(laminar jet absorber)、湿 球 吸 收 器(wetted-sphere absorber)等[46-47]。
停流装置研究的是液相内的反应,属于均质反应器的范畴[48]。通过等体积的CO2饱和溶液和一定的胺溶液采用共同的推动板同时注入混合室内,瞬间碰撞发生反应,溶液中有离子产生就会导致电导率的变化,通过监测短时间内溶液电导率随时间的变化获得总拟一级反应速率常数。停流法是一种直接测定法,具有反应速率大、实验数据重复性好、对溶剂用量小、实验过程简单、没有气液相间的传质干扰等优点。此外,注入到停流装置中的溶液浓度必须相对较低,一般不高于0.5 mol·L-1,反应物浓度较高将导致瞬间剧烈反应,温度和电导率极值增大,造成实验结果的不准确。
搅拌池反应器内吸收过程是在一个具有较稳定的气液界面基础上进行的,在气液两相内均配备搅拌器,气相一般以纯CO2注入。通常可采用两种方式进行测定:(1)压降法[47]。在短时间内反应器中注入CO2,连续测定反应器内的压力随时间变化。(2)恒压法[49]。利用压力控制器维持反应器内不同分压时对应的CO2流量,测定拟一级范围内的斜率。该动力学研究装置只需要测量气相压力和/或流量的变化就可以得到吸收速率,操作简单,也可以用于测量CO2在胺溶液中的液相传质系数。但需要获得稳定的气液接触面积,并确定不同体系的拟一级操作范围。
湿壁柱装置利用泵持续将液体从湿壁柱底部输送到反应器内腔,从内腔溢流出的液体会在内腔外表面形成一层很薄的液膜,同时,气体通过反应器底部向上与液体逆流发生反应。基于溶质渗透理论或双膜理论计算沿湿壁柱的气液接触时间,进而获得CO2吸收速率[50]。
微流控技术一般包括输送系统、微型反应器和观测通道等三个部分[51]。在真空的密闭体系中,气相与液相在微反应器中接触,气相以离散气泡的形式分散在连续的液相中,随着CO2的吸收,气泡的大小沿观测通道逐渐减小,根据守恒原理,气相体积的减少量等于CO2的吸收量,计算单个气泡的传质速率。该装置具有传质效率高、安全性好、可重复性好、可控性好等优点,已广泛应用于许多化学过程的强化。
3 反应速率常数
假设有机胺在非水溶剂吸收CO2的过程中,液膜内胺浓度基本保持不变,化学反应对CO2和胺分别为m和n级,在快速拟一级反应条件下,吸收速率可以表示为式(11):
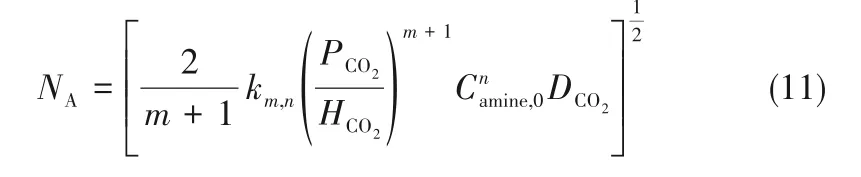
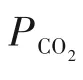
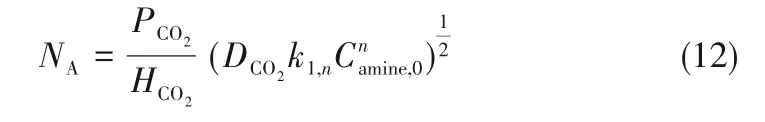
在两性离子反应机理中,反应分两步进行,总的反应速率常数可表示为式(13):
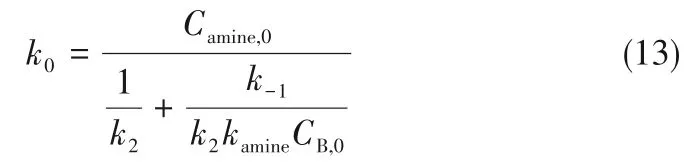
式(13)经过变换得到式(14):
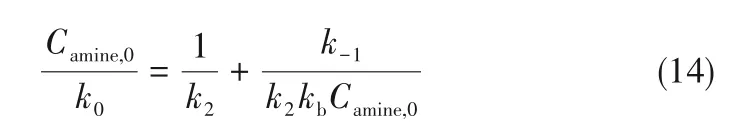
通过对Camine,0/k0和1/Camine,0作图的直线斜率和截距,就可以分别得到两性离子生成步骤和两性离子去质子化步骤对总反应速率的贡献。
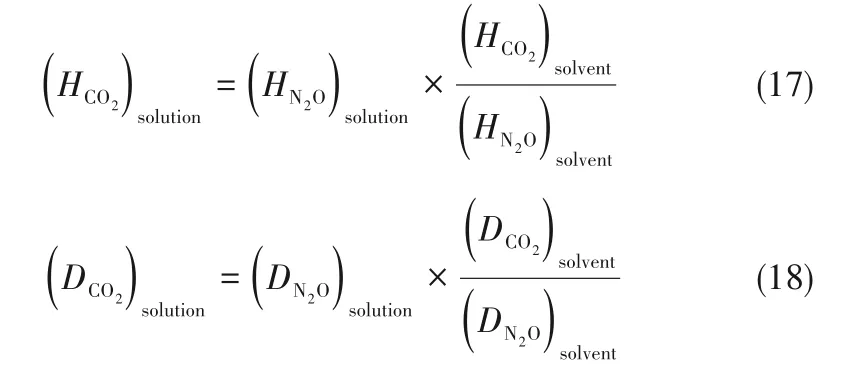
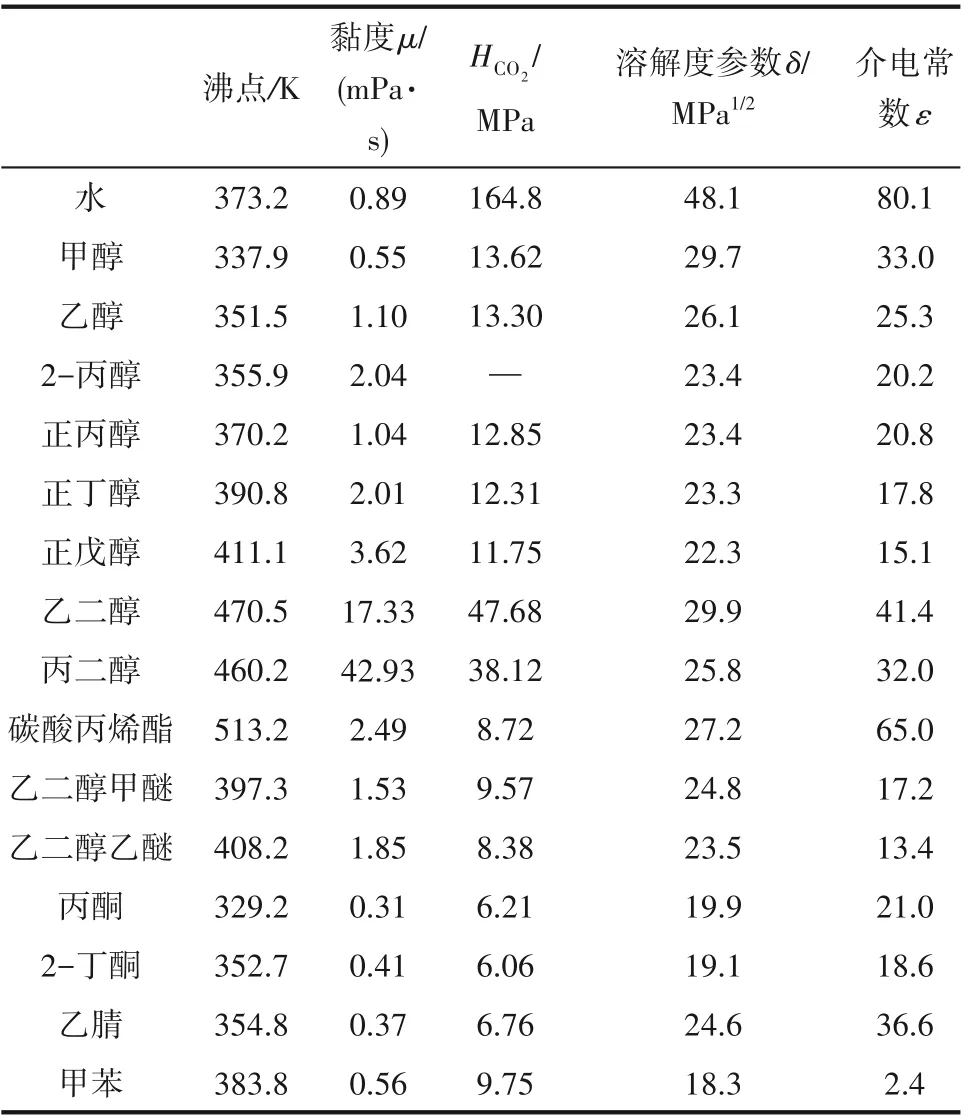
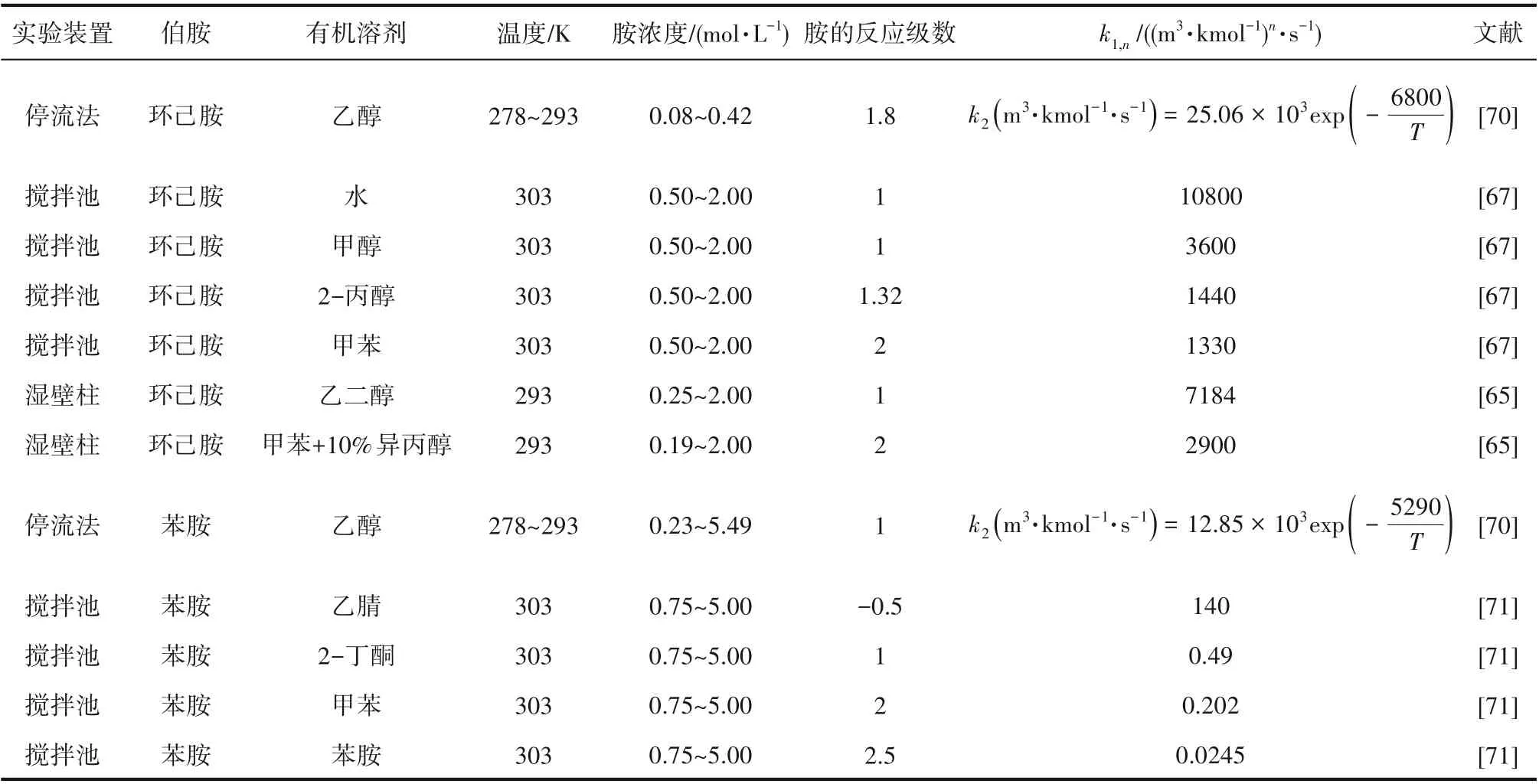
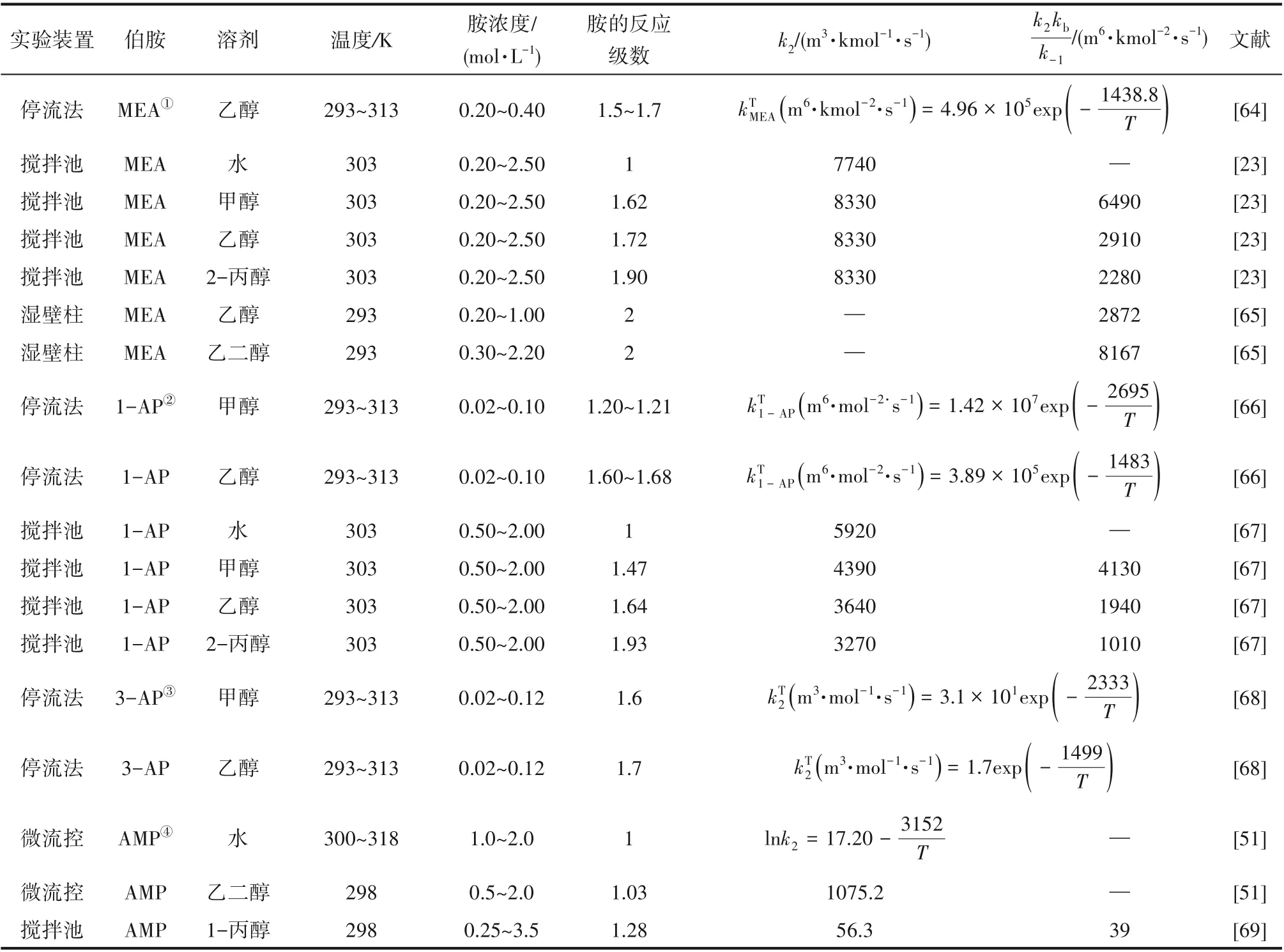
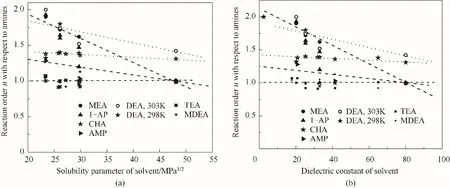
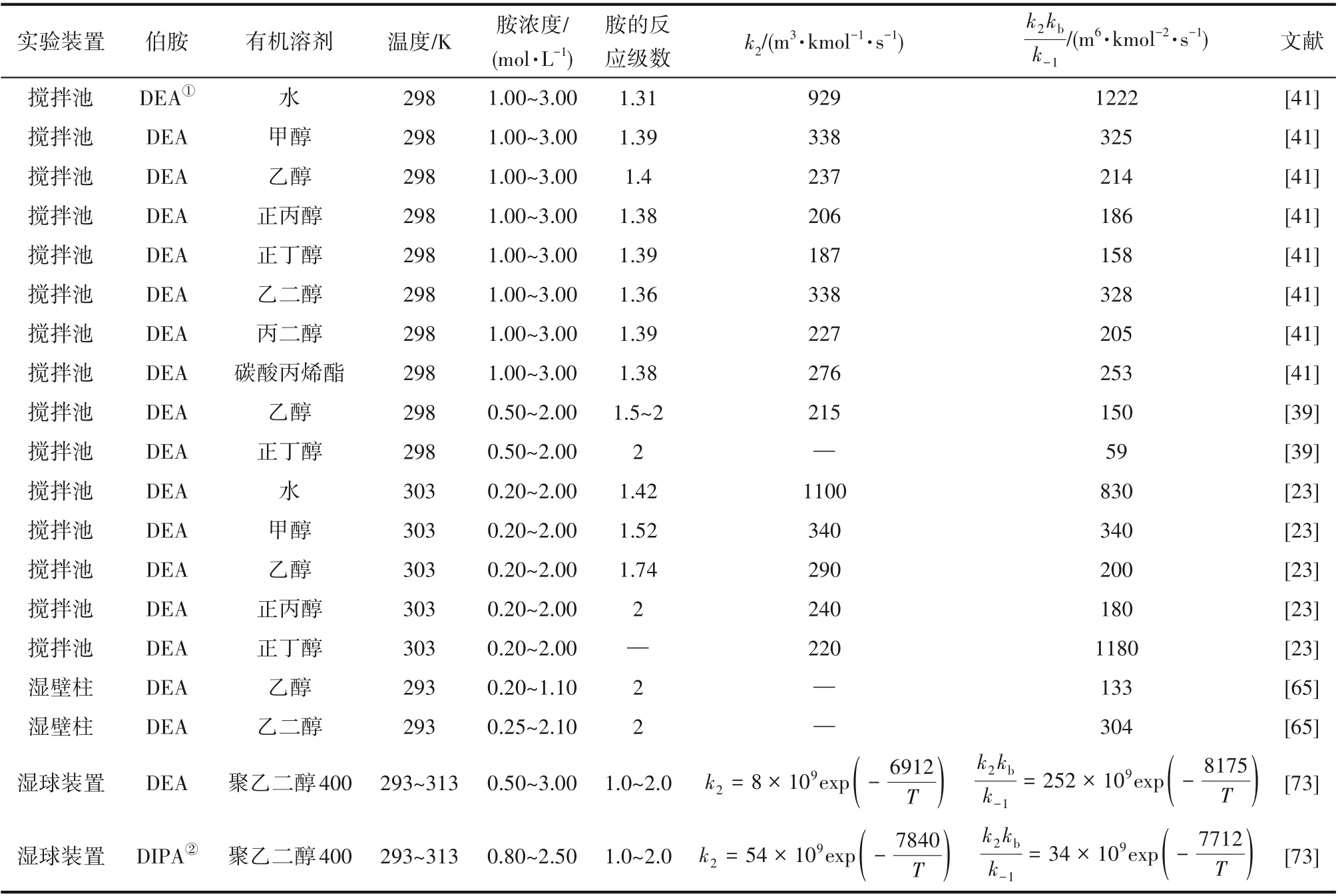
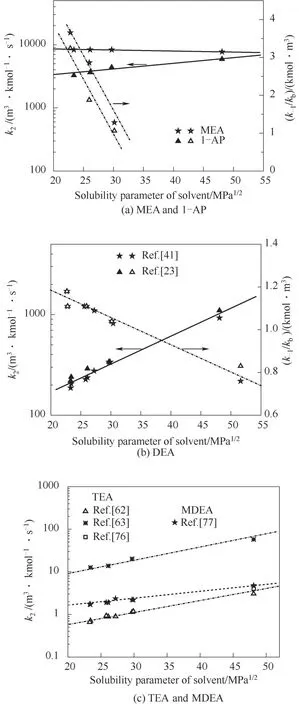
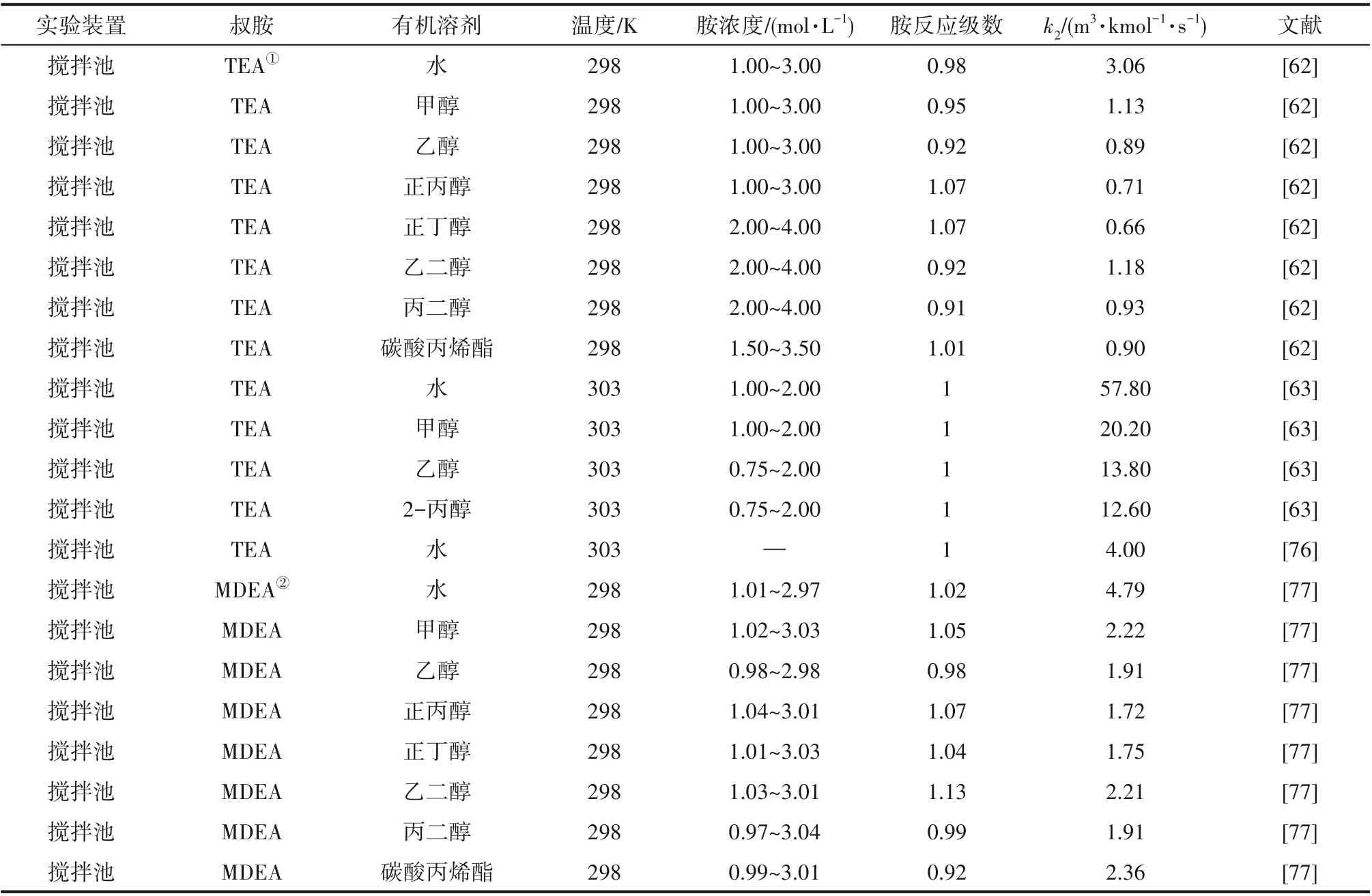
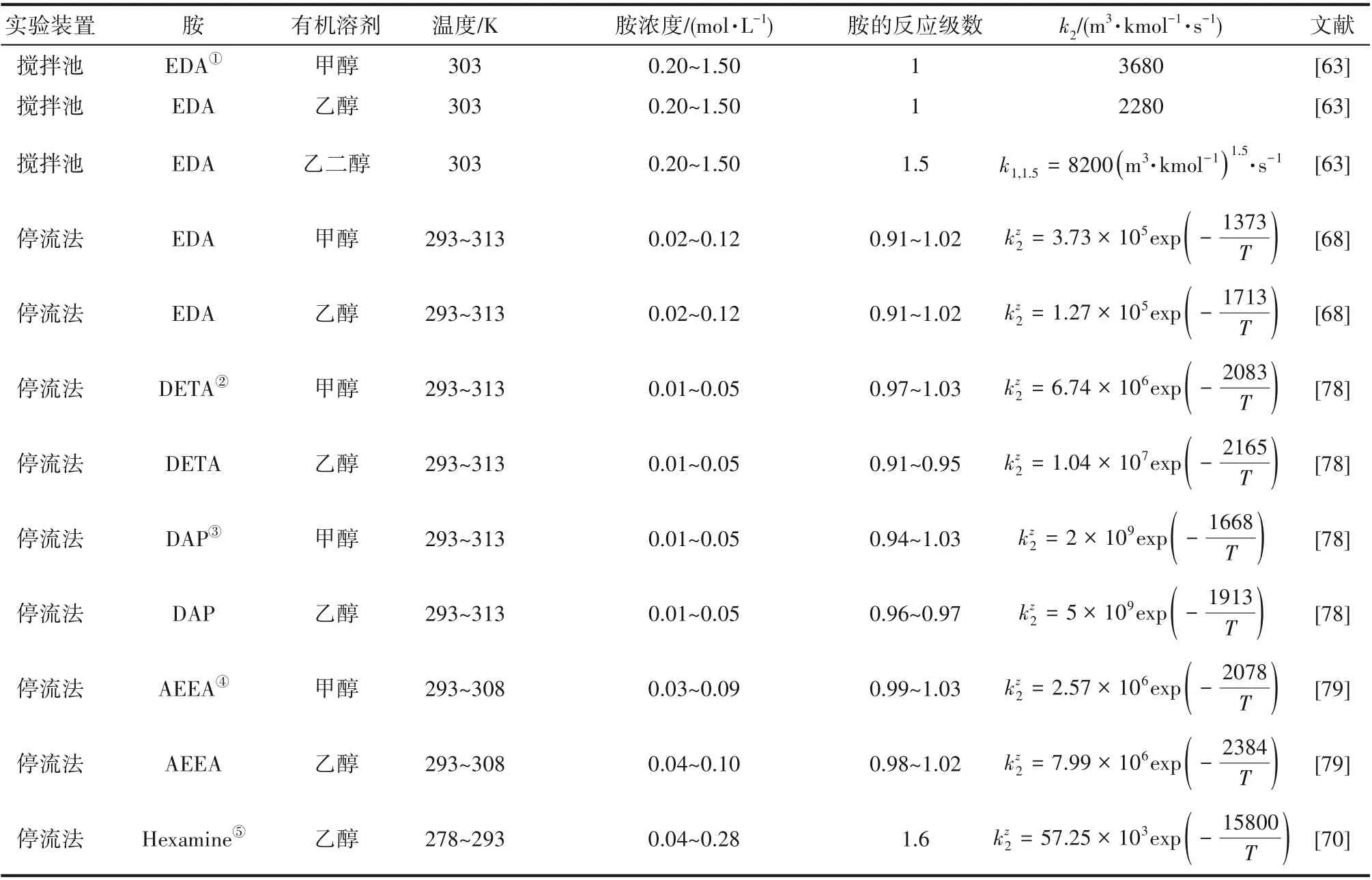
为了验证是否在拟一级反应,必须要满足3 为了计算所述的反应速率常数,必须要得到化学反应速率NA、气相CO2分压PCO2、CO2物理溶解的亨利系数HCO2和扩散系数DCO2,同时为了验证拟一级反应条件,还需要计算胺在溶液中扩散系数Damine,s。 通常采用静态平衡法测定N2O或CO2在纯溶剂或胺溶液中的物理溶解度[53]。 注入平衡罐中的气体物质的量与储气罐的初始状态和平衡状态的参数有关,可以用Peng-Robinson方程式(19)计算: 其中Vv代表储气罐的体积,Pv1、Pv2代表储气罐注气前后的平衡压力,Tv代表储气罐的温度,z1、z2代表注气前后的气体压缩系数。 当平衡罐达到汽液平衡状态,平衡罐中的N2O气体物质的量用式(20)计算: 那么,溶解在溶液中的N2O量就可以用式(21)计算: N2O的浓度可以由式(22)计算: 最后,表示物理溶解度的亨利常数HCO2就可以用亨利定律式(23)计算: 例如,CO2和N2O在环丁砜中亨利常数可以用与温度关联的关系式描述[54]。 CO2在一些常用有机溶剂中的亨利常数实验数据列于表1[52-53,55-56],N2O在不同类型胺中的亨利常数与温度关联式列于表2[57-60]。 表1 298 K不同溶剂的物化性质数据[52-53,55-56]Table 1 Physicochemical properties of different solvents at 298 K[52-53,55-56] 表2 N2O在有机胺中的亨利系数Table 2 The Henry's constant of N2O in pure amines CO2在溶剂中扩散系数可以在湿柱壁装置中测定计算。除此之外,还可以用Wilke-Chang经验公式(26)进行估算: 其中i表示组分CO2或有机胺;Mm表示溶剂的摩尔分子质量,g·mol-1;φ为溶剂的缔合参数,对于非缔合溶剂该值为1,甲醇为1.5,乙醇为1.9,水为2.6;Vb表示溶质在正常沸点下的摩尔体积,m3·kmol-1,已知CO2在正常沸点下的摩尔体积为34×10-3m3·kmol-1;μm为溶液的黏度,mPa·s。 CO2在胺溶液中的扩散系数可以用修正的Stokes-Einstein关联式(27)计算[61-62]: 胺在溶液中的扩散系数用式(28)计算: 文献[14,63]中测定的303 K下CO2和N2O在常用溶剂中的联合物化参数列在表3中。 表3 303 K时CO2和N2O在不同溶剂中的联合物化参数Table 3 Values of the quantity D1/2/H for N2O in different solvents at 303 K 在文献报道的一级胺非水溶剂动力学研究中,一元有机胺主要包括在水溶液体系常用的有机伯胺、仲胺和叔胺,有机溶剂主要为醇类,还包括少量的酮、酯和苯等。 CO2与有机伯胺在不同有机溶剂中的反应动力学研究数据列于表4和表5中[23,51,64-71]。有机胺主要包括MEA、1-氨基-2-丙醇(1-AP)、3-AP、AMP、环己胺和苯胺等。其中MEA在醇类溶剂中动力学在不同的实验装置中进行了研究报道[23,64-65]。如前面1.1节所述,在非水条件下CO2与MEA的反应也可以用两性离子机理解释。在所用的动力学实验方法中,对CO2均符合拟一级反应条件,但不同有机溶剂对MEA的反应级数有较大的影响。在水溶剂中,由于MEA是一种较强的碱,很容易在水中离子化,因此几乎所有的两性离子中间产物在可逆转化为反应物之前都会被去质子化,即两性离子的去质子化阶段是瞬间完成的,两性离子形成为速率控制步骤,所以在水溶液中对MEA的反应级数接近1。而在非水溶剂中,MEA的去质子化作用不像在水中那么容易,即去质子化阶段不是瞬间完成,而且受溶剂性质的影响较大。Herbrandson等[72]提出了溶解度参数、相对介电常数等溶剂特性参数来表征溶剂性质变化。介电常数能够用于表征溶剂分子极性大小,介电常数大表示其极性大,而且对溶质具有较强的溶剂化能力。文献数据表明(表4),非水溶剂中对MEA的反应级数在1.2~2.0之间,且随着甲醇、乙醇、2-丙醇等醇溶剂溶解度参数或介电常数增加而增大。这可能是因为随着溶剂极性的降低,两性离子在非水溶剂中稳定性降低进而提高了逆反应速率,由式(3)分析可提高对胺的反应级数。CO2与1-AP反应过程中,二级反应速率常数低于MEA,但醇溶剂对1-AP的反应级数影响与MEA体系相似。CO2和3-AP在非水溶剂中的动力学表明其反应机理用三分子机理或两性离子去质子反应速率控制描述更为合适。从表4中还可以看到,不同文献中的实验数据有一定的偏差,如Zhong等[66]在293~313 K下测得的1-AP与CO2反应动力学数据与Sada等[67]在303 K时测得的数据相比偏低。这可能与实验中使用的胺浓度、动力学方法等有一定的关系。停流法中胺浓度均在0.1 mol·L-1以下,而在搅拌池装置中胺浓度在0.5~2.0 mol·L-1,不同浓度范围内反应类型是否变化没有进一步考察或说明。另外其他条件如气液接触形式、接触面积和温度测量的精确度等都会造成实验结果的差异。 表5 CO2与伯胺在非水溶剂中的反应动力学数据(Ⅱ)Table5 Kinetic data availablein theliteratureon thereaction between CO2 and primary aminesin nonaqueoussolvents(Ⅱ) 空间位阻伯胺AMP与CO2在非水体系中的反应动力学数据(表4)可以看出,AMP与CO2在乙二醇(EG)溶剂中的二级反应速率常数高于AMP与CO2在水溶液中的数值(746,298 K)[51]。由于EG溶剂的黏度非常大,CO2在EG中的联合物化参数(D1/2/H)明显低于在水溶液中值,如表3中所示,CO2在水中的联合物化参数为1.40,而在EG中的联合物化参数为0.67,这是造成二级反应速率常数k2值不同的主要原因。而对于1-丙醇溶剂,由于两性离子在1-丙醇溶剂中的稳定性较低,导致两性离子产物的逆反应速率常数值较高,298 K时在1-丙醇中的k2值仅为56.3。 表4 CO2与伯胺在非水溶剂中的反应动力学数据(Ⅰ)Table4 Kinetic data availablein theliteratureon thereaction between CO2 and primary aminesin nonaqueoussolvents(Ⅰ) 另外,CO2与环状侧链的伯胺如环己胺(CHA)、苯胺等[65,67,70-71]动力学研究结果列在表5中。环己胺与CO2生成的两性离子在甲苯中稳定性差,两性离子去质子反应为速率控制步骤,总反应近似为三级反应,而在EG溶剂中的1+n级反应动力学速率常数值接近MEA水溶液。苯胺体系的k1,n值都非常低,这可能是因为苯胺分子的碱性较弱,共轭效应使得N原子周围的电子云分布在芳环上,降低了胺的碱性强度。需要指出,在乙腈溶剂中,对苯胺的反应级数报道约为-0.5,这可能与高浓度苯胺溶液中流体力学因素影响有关[71]。 有机胺与CO2反应时在不同溶剂中反应级数和速率常数的变化能够反映溶剂效应。采用溶解度参数、相对介电常数等溶剂特性参数来表征溶剂性质的变化,将不同非水体系中对有机胺的反应级数和反应速率常数与溶剂特性参数作图,分别如图1和图2所示。 图1 CO2-有机胺非水反应体系中溶剂溶解度参数(a)和介电常数(b)对有机胺的反应级数影响Fig.1 Dependence of reaction order on solubility parameter(a)and dielectric constant(b)of solvents in the reaction of CO2 with the primary and secondary amines 从图1中可以看出,CO2-有机胺非水反应体系中,对有机伯胺的反应级数大小随着有机溶剂的溶解度参数[图1(a)]和介电常数[图1(b)]的增加呈现下降的趋势,而且除少数体系(AMP-EG和CHA-EG)外[50,65],它们之间均呈现近似线性关系。另外,苯胺在非水溶剂(乙腈、2-丁酮和甲苯)的反应级数随着介电常数的增大也明显减小。 图2(a)为MEA和1-AP非水体系吸收CO2的反应速率常数(k2和k-1/kb)与溶剂溶解度参数的关系。对于MEA非水体系来说,不同溶剂中二级反应速率常数k2变化不大,但k-1/kb与溶剂溶解度参数在一定范围内呈近似线性关系,即随溶解度参数增大时k-1/kb值降低。对于1-AP非水体系来说,k2和k-1/kb均与溶剂溶解度参数在一定范围内呈近似线性关系,即随溶解度参数增大时,k2值线性增大,k-1/kb值线性降低。 DEA是吸收CO2最常用的仲胺类吸收剂,也是非水体系动力学研究中的主要对象,有关文献[23,39,41,65,73]中的动力学数据列在表6中。与MEA体系的文献数据相似,发现不同文献中的实验数据存在较大的差异性,这与使用的动力学装置、反应条件等不同有较大的关系。对报道的实验数据与溶剂的性质参数(表1)分析发现,DEA的反应级数与溶剂种类也有一定的关联性,但不同文献报道的变化趋势有较大的不同[23,41]。由DEA反应级数与溶剂特性参数的关系图(图1)可以看出,Park等[41]在298 K温度下研究发现反应级数均在1.31~1.40间,随着溶剂极性的降低略有增加但变化不明显。但是Sada等[23]在303 K温度下发现反应级数随着溶剂极性的降低呈明显增加。这可能是由于溶剂的极性降低导致生成的两性离子不稳定,去质子化反应速率降低,k-1/kb值增大,从而对胺的反应级数增大,这与图2(b)中速率常数的实验结果趋势一致。尽管不同研究组在不同实验温度下对DEA反应级数与溶剂特性参数间的规律性不大相同,但是反应速率常数k2和k-1/kb与溶剂的溶解度参数关系[图2(b)]均呈良好的线性关系,即溶剂的溶解度参数增大,k2值线性增大,而k-1/kb值近似线性降低。 表6 CO2与DEA、DIPA等仲胺在非水溶剂中的反应动力学数据Table 6 Kinetic data available in the literature on the reaction between CO2 and secondary amines in nonaqueous solvents 图2 CO2-有机胺非水体系的反应速率常数与溶剂溶解度参数的关系Fig.2 Relationships between reaction rate parameters and solubility parameter of the solvent for in the reaction of CO2 with nonaqueousamines 从吸收反应热的角度看,不管是水溶液还是非水溶液,有机叔胺的反应热均低于伯胺和仲胺。叔胺如TEA和MDEA与CO2的反应机理不同于伯胺、仲胺,因为叔胺分子中的氮原子上没有可以被CO2取代的氢原子,通常用Donaldson等[74]提出的碱催化水合反应机理来解释CO2与叔胺在水溶液中碳酸氢盐的反应产物。鉴于叔胺作为碱催化的性能,研究叔胺在非水溶剂吸收CO2的反应动力学也是很有意义的。根据该机理,反应对叔胺的级数理论上应为0。Versteeg等[75]研究了CO2在MDEA-乙醇溶液中的吸收,以检验该溶液的反应性,发现该溶液吸收CO2的吸收速率和吸收容量都几乎与该溶液中物理吸收和溶解N2O的数值相同。因此,在非水溶液中CO2和叔胺之间的反应近似为零。然而,Sada等[63]提出,溶剂化的叔胺能与溶解的二氧化碳反应形成离子对产物,如式(10),因而对叔胺的表观反应级数应为1。 在最近的一些研究发现,在8种不同溶剂中动力学实验表明,TEA和MDEA的反应级数均在0.92~1.07之间(图1),这也证实了与Sada等[63]提出的反应机理一致。将文献[62-63,76-77]报道的一些叔胺在非水溶剂中的反应速率常数(表7)与有机溶剂的溶解度参数值(δ)作图,如图2(c)。可以发现,不同体系的反应速率常数与溶解度参数之间也存在近似的线性关系。一般来讲,溶解度参数增加,溶剂的极性增加,会提高离子对产物的稳定性,并提高了溶液中溶剂化叔胺的量,促进了式(10)的反应进程,因而k2值增加。但也必须指出,不同研究者的实验数据误差相对较大(图2)。需要指出的是,Park等[62]实验中CO2在叔胺溶液中的物理溶解度假设等于在纯溶剂中的物理溶解度,没有通过N2O/CO2类比法获得。另外,有文献解释可能是伯胺或仲胺等少量杂质的存在促进了CO2吸收速率[76],但表7中在不同溶剂中对胺的反应级数基本一致,如果存在伯胺或仲胺参与了反应,那么反应级数应该会在1~2之间。尽管溶剂性能在一定程度上影响有机胺与CO2的反应速率常数,但影响大小有限。从图2可以看出,不同有机单胺在非水溶剂中的二级反应速率常数k2大小:伯胺>仲胺>叔胺,这与其在水溶液中的情况相似。 表7 CO2与TEA、MDEA等叔胺在非水溶剂中的反应动力学数据Table 7 Kinetic data available in the literature on the reaction between CO2 and tertiary amines in nonaqueous solvents 多元胺是分子中含有两个或多个主要氨基的有机化合物,例如EDA、DETA、1,3-二氨基丙烷(DAP)、2-(2-乙氨基)氨基乙醇(AEEA)等,其分子含有若干个伯胺基团或/与仲胺基团,因为其氨基数目多,所以吸收量大,吸收速率快,也是学者们关注的高效吸收剂[63,68,70,78-80]。多元胺在非水溶剂中动力学研究主要涉及常见的低级醇类如甲醇、乙醇,其相关动力学数据列于表8中。从表中可以看出,除了EDA-乙二醇和六甲基四胺-乙醇两个非水体系外,大部分多元胺在甲醇、乙醇溶剂中的反应级数都接近1,这说明在两性离子机理中,两性离子的生成步骤是控速步骤,这也可能与这些有机胺中含有主要伯氨基团有关。另外,在相同温度下(如303 K),比较不同多元胺的反应速率常数可以发现,在甲醇溶剂中的数值大于乙醇,这与5.1节中发现的溶解度参数与反应速率常数的变化规律一致。 表8 CO2与多元胺在非水溶剂中的反应动力学数据Table 8 Kinetic data available in the literature on the reaction between CO2 and polyamines in nonaqueous solvents 叔胺和环状仲胺具有较好的耐降解能力和耐氧化稳定性,而且叔胺类吸收CO2过程反应热要小于伯仲胺在水和非水溶剂中的反应热。通常将其与反应速度较快的伯胺或仲胺混合,以利用它们的高负载能力、低降解率和低再生能耗等优点。但混合胺非水体系的动力学研究较少,表9汇总了最近几种混合胺非水溶液的动力学数据[64,81]。 表9 CO2在混合胺非水混合溶液中的反应动力学Table 9 Kinetic data available in the literature on the reaction of CO2 into nonaqueous amine blended systems 研究结果发现,叔胺的加入使反应速率显著提高,这是因为在非水体系中,叔胺不发生解离,不能够与CO2直接反应,但会作为碱参与MEA分子的去质子化过程,从而增加了游离的MEA分子的数量,提高了反应速率。二元环状仲胺哌嗪(PZ)也常用作活化剂加入反应体系中。2-氨基-2-甲基-1,3-丙二醇(AMPD)和2-氨基-2-乙基-1,3-丙二醇(AEPD)在乙醇中加入少量的PZ后,表观反应速率常数k0随着PZ浓度的增加而增大,而且少量PZ加入后该体系的二级反应动力学常数k2就显著提高。 (1)目前报道的非水有机胺吸收体系中动力学数据仍不系统。使用的溶剂主要以低级醇类有机溶剂为主,其他非水溶剂如酮、醇醚、酯等涉及较少;尽管对单胺非水体系进行了大量的工作,但是其中研究的都是常见的伯胺、仲胺和叔胺,特别是仲胺仅对DEA进行了动力学探究,而且高浓度的伯胺动力学数据较少。 (2)一些体系的研究结果呈现较大的差异性,由于溶剂效应影响动力学特征的规律性仍需进一步验证。研究的溶剂类型单一导致溶剂特性参数较集中,而且不同动力学实验方法如搅拌池反应器、停留法等研究有机胺的浓度范围有较大不同,反应物浓度对反应模式和动力学特征的影响未见分析报道。 (3)大部分体系的动力学数据测定是在单一温度(如293,298或303 K)下完成的,温度变化对动力学行为的影响仍缺乏研究。另外,物性数据特别是不同有机溶剂中的物理溶解度、扩散系数等实验数据少,参数估算对动力学结果的影响仍需重视。 吸收剂再生能耗高和严重降解问题是阻碍化学溶剂吸收技术大规模工业化推广和应用的关键。由于在CO2溶解性、设备腐蚀性以及低温再生等方面的潜在优势,近年来采用有机胺非水体系捕集CO2的研究再次受到了关注和重视。本文指出了在新型吸收剂开发过程中,有机溶剂与水作为有机胺共溶剂的优缺点。在介绍有机胺在非水体系反应机理基础上,总结了不同类型有机胺在非水溶剂中与CO2反应的动力学。主要发现如下: (1)有机胺在不同溶剂体系中与CO2反应级数均在1.0~2.0之间,主要是与溶剂性质、反应产物的稳定性、氨基类型及碱度等有关。对于目前报道的吸收体系的动力学数据,均可以用两性离子机理解释。 (2)有机溶剂的物化性质参数如溶解度参数和介电常数等与一元伯胺和仲胺的反应动力学特征具有近似线性变化,即有机单胺的反应级数随溶剂极性的降低而增大,反应速率常数k2和k-1/kb均随着溶剂的溶解度参数增大而呈规律性的增加或降低。 (3)与空间位阻叔胺类在其水溶液中碱催化CO2水合反应机理不同,有机叔胺类在非水溶剂中不能直接与CO2反应,但对其反应级数约为1的实验结果初步证实了溶剂化的叔胺参与了CO2吸收反应。 (4)混合胺非水体系中叔胺和环状仲胺可作为活化剂提高伯胺与CO2的反应速率。 系统研究在非水吸收体系的动力学特征,将对有机胺非水吸收剂筛选以及工艺模拟等方面有重要的指导作用,今后可以在以下几个方面进一步开展工作: (1)系统研究一元有机伯胺和仲胺在低级醇、醇醚、砜类及弱极性有机溶剂的动力学,进一步验证溶剂效应对动力学特征的影响。目前报道的有机胺和有机溶剂种类较少,进一步报道详实的物性数据如有机溶剂中的物理溶解度、扩散系数或联合物化参数等,降低动力学数据偏差,对理解不同溶剂特性对反应动力学的影响有较大的帮助。 (2)开展不同动力学研究方法对比实验,并与实际吸收过程相结合。针对不同测定方法的合理测定区间,理解影响反应类型转变的因素。停留法反应动力学实验一般在低浓度胺和低CO2浓度的条件下进行,这与实际工业吸收剂使用的浓度、温度和压力范围等条件有明显差别,可以结合湿壁柱和搅拌池装置测定,建立覆盖面广的动力学计算模型。 (3)进一步理解非水溶剂与CO2反应机理。结合在线检测或产物分析对报道的烷基碳酸酯和溶剂化叔胺离子对产物等反应过程进行探究和验证。 (4)通过优化实验设计,建立溶剂参数和温度等关联的反应速率常数方程如参数k2和k-1/kb,为CO2吸收过程中非水吸收剂的工艺设计提供重要支持。
4 物性参数
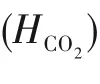
4.1 物理溶解度
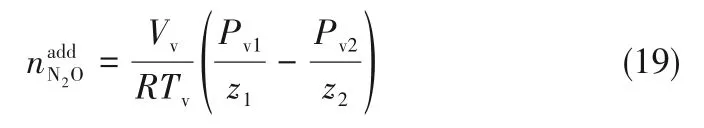
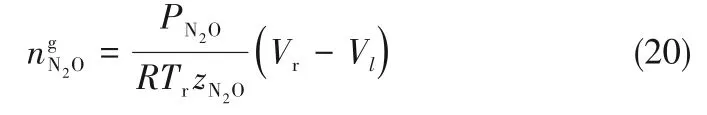
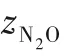
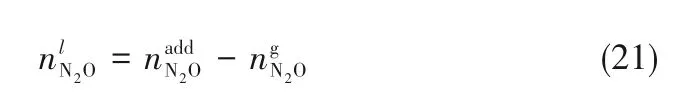


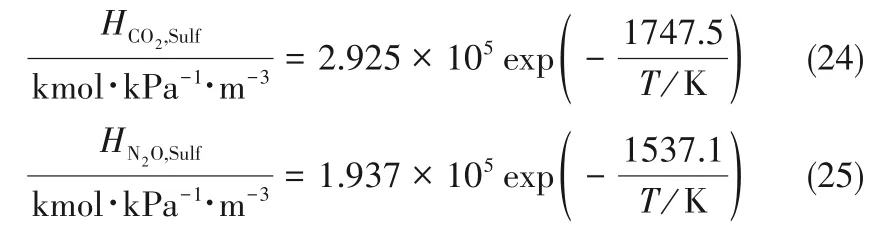

4.2 扩散系数
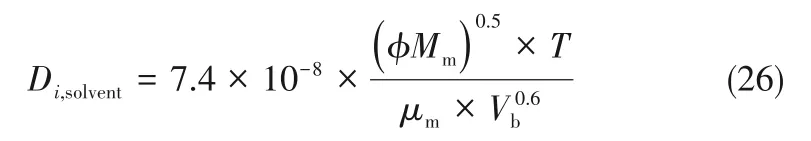
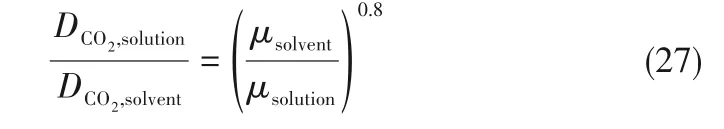
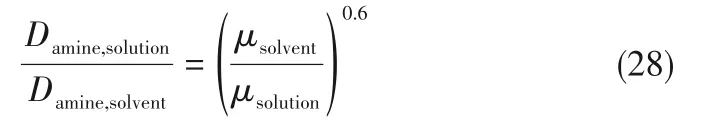
4.3 联合物化参数
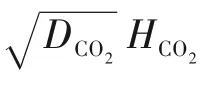
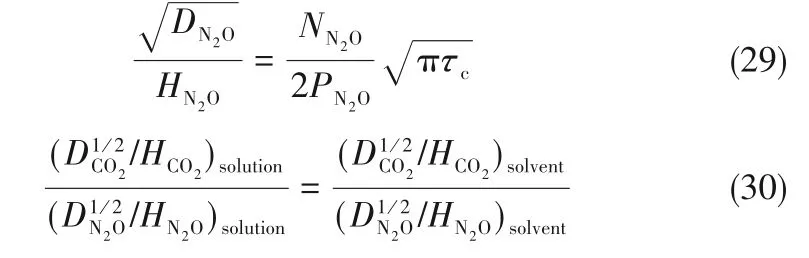

5 非水体系吸收CO2 动力学
5.1 单胺非水体系
5.2 多元胺非水体系
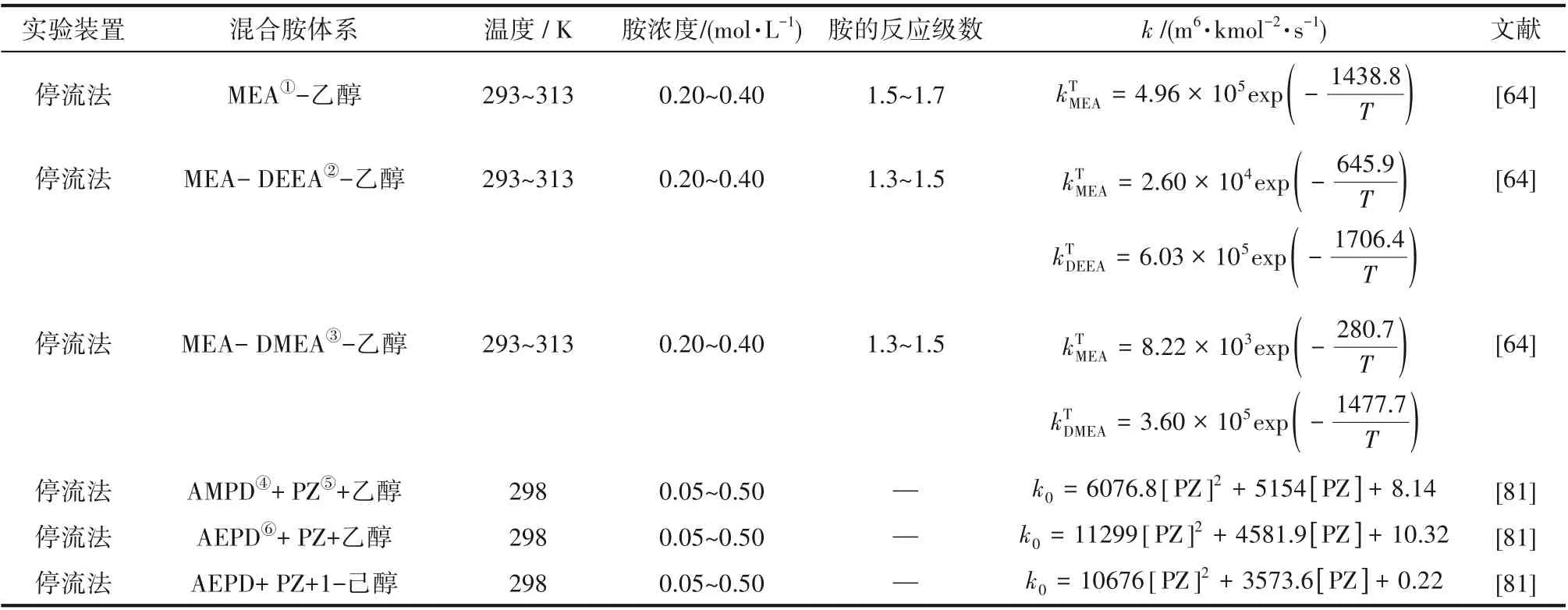
5.3 混合胺非水体系
5.4 动力学研究中存在的问题
6 结语与展望

