基于网络药理学和分子对接分析黄芩治疗类风湿关节炎的作用机制
孙宇洁,付书璠,赵永璐,李 慧,黄 莉
安徽中医药大学 中医学院(合肥 230038)
黄芩(scutellaria baicalensis),又名空心草、黄金茶,唇形科植物。黄芩的根,《药性论》载其:“能治热毒骨蒸……去关节烦闷”。黄芩性寒味苦,归肺、心、胆、大肠经,具有清热燥湿、泻火解毒等功效。现代药理研究发现,黄芩的主要活性成分为黄酮及其苷类、萜类化合物及挥发油等,具有抗炎、解热、杀灭微生物、抑制肿瘤生长等作用,对消化系统、心血管系统、神经系统等多系统的疾病均具有治疗作用[1]。
类风湿关节炎(rheumatoid arthritis,RA)是一种发病机制十分复杂的滑膜关节自身免疫病,典型临床表现为关节滑膜的慢性炎症和关节外血管翳的形成,进一步可累及关节软骨和骨,最终可致关节畸形和功能丧失[2]。由于RA的发病机制目前尚未明确,治疗原则主要是通过延缓疾病进展和降低风湿活动性来减少关节损伤和预防长期残疾,并无规范的治疗方案。临床主要采用非甾体抗炎药、地塞米松、甲氨蝶呤等,然而这些药物长期服用会引起胃、肝、肾等多个脏腑功能的不良反应,对机体伤害较大[3]。因此,开发高疗效、低副作用、低毒性的新型RA 药物具有重要的临床应用价值。中药在治疗RA方面的优势亟待开发,具有广阔的研究前景。本文旨在运用网络药理学技术初步探究黄芩治疗RA的生物学过程,从靶点、信号通路的角度揭示其治疗机制,为实验研究及未来临床应用提供参考。
1 材料与方法
1.1 药物活性成分及作用靶点的筛选
通过检索中药系统药理学分析平台(traditional chinese medicine systems pharmacology database and analysis platform,TCMSP)(http://lsp.nwsuaf.edu.cn/tcmsp.php)检索黄芩的化学成分,以口服生物利用度(oral bioavailability,OB)≥30%和药物相似性(drug likeness,DL)≥0.18作为筛选条件,时间截止至2020年4月10日,筛选出活性成分较高的化合物,同时利用此平台下载相关有效成分对应的蛋白作用靶点。
1.2 RA相关靶点的筛选
将“rheumatoid arthritis”作为关键词,对GeenCards数据库(https://www.genecards.org/)、OMIM 数据库(http://www.omim.org/)进行检索,将两个数据库的检索结果合并后去除重复后作为疾病靶点数据库备用。
1.3 黄芩-RA靶点网络的建立及可视化
利用Venn 在线软件(http://bioinformatics.psb.ugent.be/webtools/Venn/)将药物与疾病靶点取交集,通过Venn图的形式展现黄芩与RA靶点间存在的交集靶点,运用Cytoscape 3.7.2(http://www.Cytoscape.org/)软件构建黄芩治疗RA的“化合物-靶点-疾病”相互作用网络图。
1.4 蛋白相互作用网络(PPI网络)的构建
将筛选得到的药物-疾病共同靶蛋白上传至String(https://string-db.org/)在线平台数据库进行蛋白质与蛋白质相互作用(protein-protein interaction,PPI)分析,限定研究物种为“人”(“homo sapiens”),参数保持默认设置,获得PPI网络。
1.5 GO功能分析和KEGG通路富集分析
将黄芩的有效作用靶点上传至David 6.8(data⁃base for annotation,visualization and integrated discov⁃ery)数据库(https://david.ncifcrf.gov/,version 6.8),指定研究对象为人类进行基因功能(GO,gene ontolo⁃gy)分析,获取靶点主要的作用过程,同时基于京都基因与基因组百科全书(KEGG,kyoto encyclopedia of genes and geomes)(https://www.kegg.jp/)进行通路富集分析,观察黄芩与RA共同靶点在通路中的分布情况。以P<0.01进行靶基因筛选,得到黄芩靶点主要的生物过程和药理作用机制中可能性较大的通路,并进一步筛选与RA相关的信号通路。
1.6 分子对接
检索RSCB PDB数据库(http://www.rcsb.org/pdb/home/home.do)并下载RA 靶蛋白的3D 结构,检索并下载TCMSP 数据库黄芩活性成分的2D 结构,利用Chem 3D 对活性成分小分子逐个进行结构优化。利用PyMOL 2.4.0 软件对RA 靶蛋白进行除水、分离原配体等预处理。利用AutoDock 的可视化软件AutoDock Tools 1.5.6 软件设置GridBox 各项参数,寻找活性口袋,并将活性小分子、预处理后的靶蛋白都转换成pdbqt 格式文件,应用AutoDock Vina 软件进行分子对接,最后运用PyMOL、LigPlot+软件对对接结果进行三维和二维可视化分析。
2 结果
2.1 黄芩活性成分的筛选
在TCMSP数据库中搜索黄芩化学成分,共得到143 个化学成分,再对其ADME 参数进行筛选,以OB ≥30 和DL ≥0.18 为筛选条件,同时筛去无对应靶点的成分,最终共获得36 个黄芩潜在的有效成分,见表1。

表1 黄芩潜在有效成分
2.2 黄芩活性成分-RA靶点预测
将从数据库得到的所有成分和靶点去重整合,得到36 种活性成分及483 个靶点,靶点数较多的活性成分的潜在靶基因见表2(靶点数≥11),通过Unipot 数据库进行标准化处理,汇总去重后得到96个靶点。设置relevance score ≥7,由GeneCards、OMIM数据库检索整合去重后得到RA 靶点共计1 085 个,将黄芩活性成分与RA各自对应靶点取交集,得到活性成分-疾病靶点44个,对应的韦恩图见图1。

表2 黄芩活性成分的潜在靶基因和靶点数(靶点数≥11)
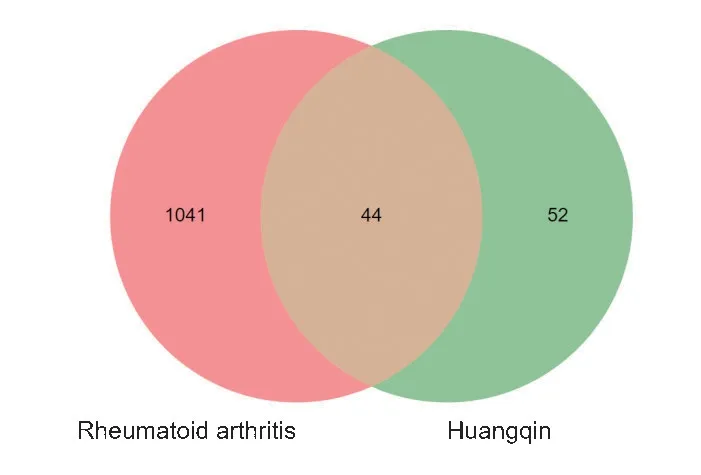
图1 黄芩活性成分与RA基因靶点映射Venn图
2.3 “化合物-靶点-疾病”的网络构建及可视化分析
为更直观的显示黄芩有效成分、靶点与疾病之间的相互作用关系,利用Cytoscape 3.7.2软件构建黄芩与RA的44个共同靶点的“化合物-靶点-疾病”可视化网络图(见图2),结果显示,黄芩中发挥抗RA作用的化学成分主要有豆甾醇(stigmasterol)、β-谷甾醇(beta-sitosterol)、黄芩甙元(baicalein)、汉黄芩素(wogonin)等,协同作用于一氧化氮合酶2(NOS2)、雄激素受体(AR)、前列腺素内过氧化物合成酶1(PTGS1)、前列腺素内过氧化物合成2(PTGS2)、β-2 肾上腺素能受体(ADRB2)、胱天蛋白酶3(CASP3)等靶点。
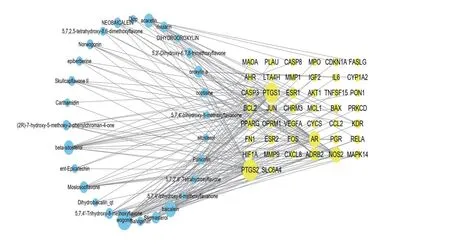
图2 “化合物-靶点-疾病”可视化网络图
2.4 黄芩治疗RA的PPI网络
设置置信度大于0.4,将Venn 图获得的44 个药物-疾病共同靶点上传至STRING 在线数据库平台得到PPI 网络(见图3)。据Count 值筛选列举出黄芩治疗RA的关键靶点蛋白(见图4),主要包括白细胞介素-6(IL-6)、磷酸化蛋白激酶1(AKT1)、血管内皮生长因子A(VEGFA)、Jun激酶(JUN)、胱天蛋白酶3(CASP3)、前列腺素内过氧化物合成2(PTGS2)、基质金属蛋白酶9(MMP9)等。
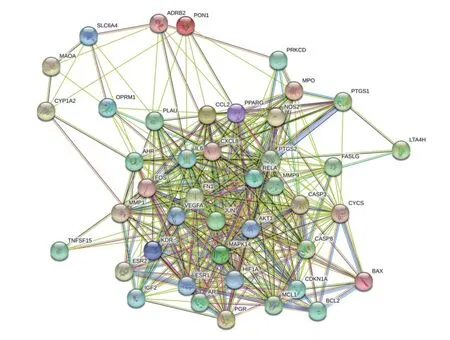
图3 黄芩治疗RA相关靶点的PPI网络

图4 黄芩治疗RA的关键靶点
2.5 黄芩有效成分-靶点-分子功能的GO富集分析
将黄芩有效组分与RA 的共同44 个靶点导入DAVID 6.8数据库,筛选物种为人源(homo sapiens),获得GO 生物学过程条目75 条,涉及到生长因子活性、生物合成过程调控、酶活性、转录因子活性及受体活性、细胞因子活性等各方面,选取GO 富集分析结果所得出的前20位相关靶点分子功能,绘制相应的黄芩有效成分-靶点-对应分子功能的GO富集分析柱状以及气泡图,见图5。结果显示黄芩活性成分与靶点对应的分子功能主要为核受体活性、转录因子活性、细胞因子受体结合、类固醇激素受体活性、血红素结合等方面、蛋白质异源二聚体活动、四吡咯结合、RNA聚合酶II近端启动子序列特异性DNA结合、BH域结合、近端启动子序列特异性DNA结合。
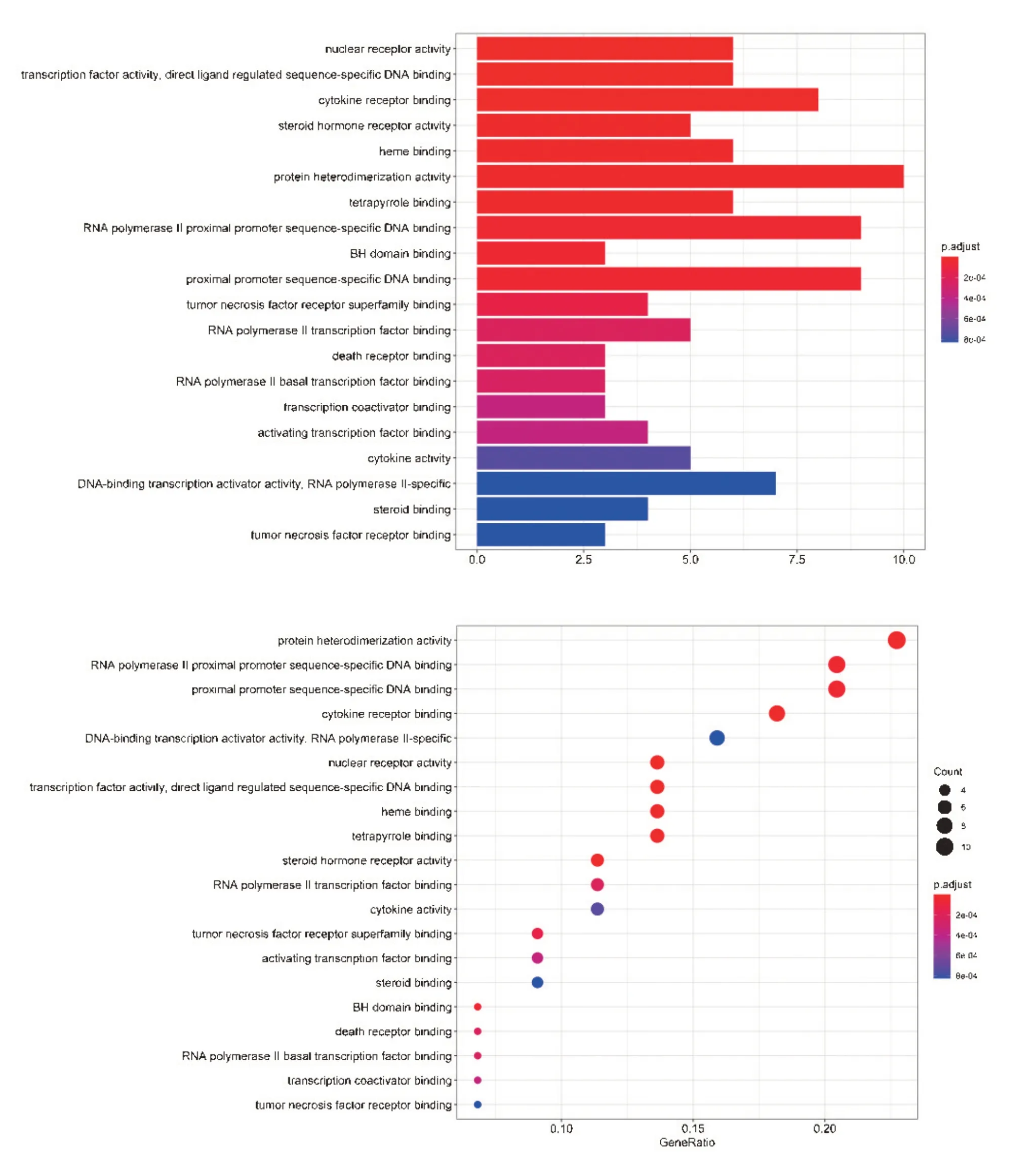
图5 有效组分-基因靶点-分子功能的GO富集分析柱状和气泡图
2.6 黄芩治疗RA的KEGG通路富集分析
在DAVID 6.8在线数据库中对44个靶点进行富集分析,以P<0.01为筛选标准,最终得出24条通路富集结果,见表3,主要是细胞凋亡、PI3K-Akt 信号通路、内分泌抵抗、MAPK 信号通路、铂类耐药、HIF-1信号通路、p53信号通路、EGFR酪氨酸激酶抑制剂耐药、破骨细胞分化、细胞衰老、焦点粘连、Ras信号通路、细多种胞凋亡、VEGF信号通路、NF-kap⁃pa B信号通路、鞘脂类信号通路、FoxO信号通路、趋化因子信号通路等信号通路。

表3 KEGG通路富集
2.7 黄芩活性成分治疗RA分子对接结果分析
使用Cytoscape中的CytoNCA对RA 靶点进行打分,得到网络核心靶点,Degree ≥13的潜在靶点有14个,分别为:FOS、JUN、IL6、VEGFA、CXCL8、RELA、CASP3、MMP9、ESR1、CYCS、AKT1、MAPK14、PTGS2、CCL2。结合能小于0提示配体与受体可自发结合,且结合构象越稳定,所需结合能越低,本研究选取结合能≤-9.0 kcal/mol作为筛选条件,见表4。
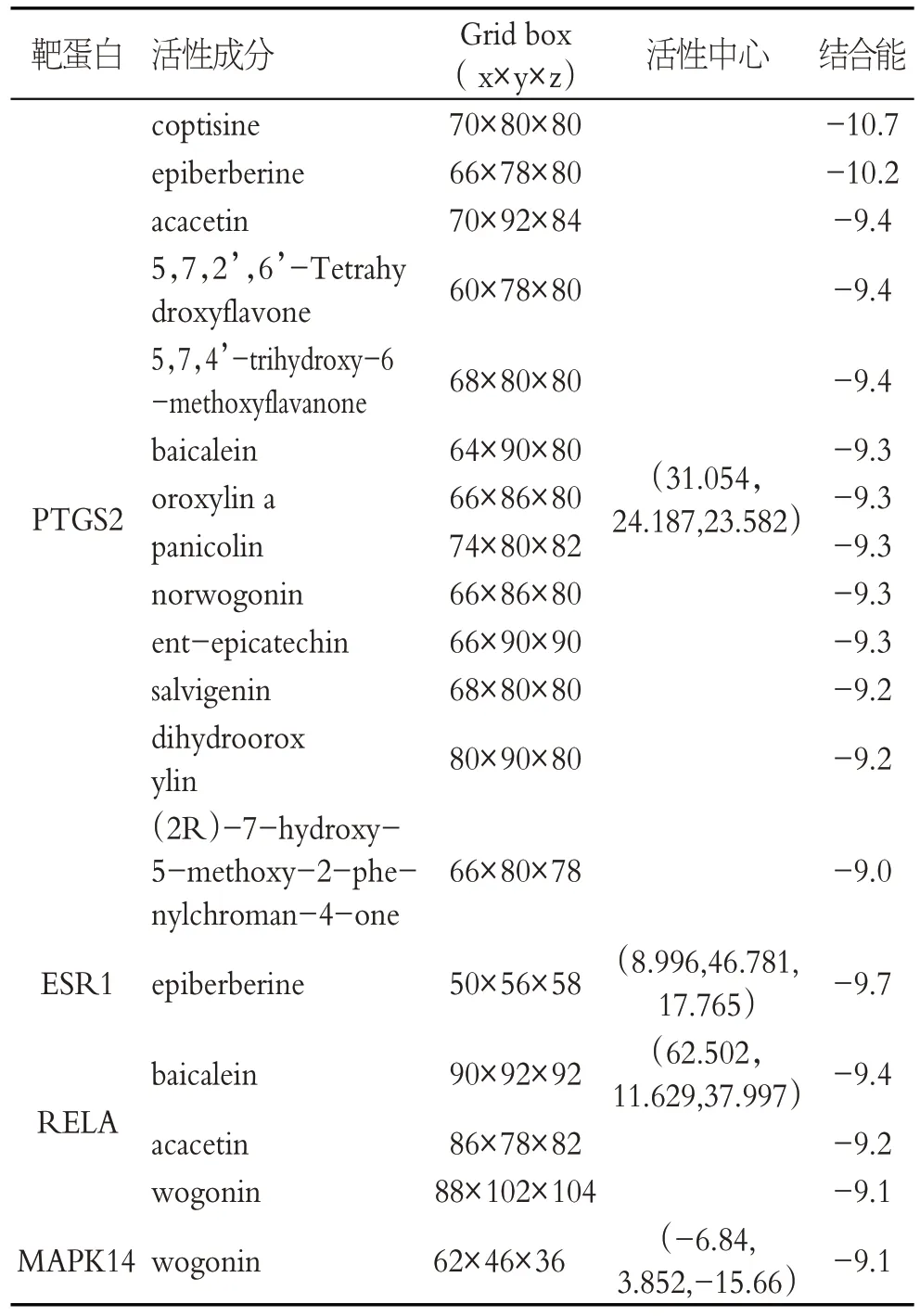
表4 黄芩活性成分与靶蛋白的结合能
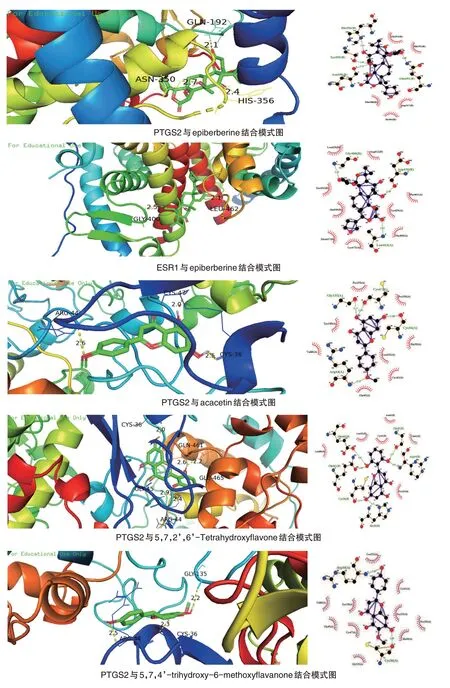
选取结合最稳定的7 对配体受体组合(结合能≤-9.4 kcal/mol,进行可视化分析,相对应三维与二维对接模式图,见图6。
3 讨论
本研究运用网络药理学方法探讨研究了黄芩治疗类风湿关节炎的相互作用网络与潜在治疗机制,综合表1、表2及图2可得出黄芩主要有效化合物有36个,其治疗类风湿关节炎的关键成分有6个,为豆甾醇、β-谷甾醇、黄芩甙元及汉黄芩素。豆甾醇可改善RA大鼠的临床严重程度关节破坏和组织结构,还可下调关节中NF-κBp65 和p38MAPK 的表达,显著抑制促炎介质(TNF-抑制剂、IL-6、IL-1 抑制剂、iN⁃OS 和COX-2)在机体内的表达,增加抗炎细胞因子(IL-10)的表达[4]。当RA组织内巨噬细胞被高度激活时局部炎症增强,可加速RA的发展。β-谷甾醇可抑制巨噬细胞促炎症因子的产生,降低特异性抗体IgG的浓度,以此机制达到治疗RA的作用[5]。黄芩甙元对肿瘤坏死因子-α(TNF-α)所介导的类风湿关节炎成纤维(RAFLS)增殖过程有显著的抑制作用,能够被巨噬细胞游走抑制(MIF)逆转并呈剂量依赖性,提示黄芩甙元可能通过抑制MIF 信号通路来实现对TNF-α介导的RAFLS 增殖的抑制作用[6]。汉黄芩素可抑制RA 的成纤维样滑膜细胞(FLS)中IL-6mRNA的表达,对RA的FLS增殖有明显的抑制作用[7]。以上研究提示豆甾醇、β-谷甾醇、黄芩甙元及汉黄芩素为黄芩治疗RA的重要活性成分。
结合图1、2、3、4 可知,黄芩对应96 个有效作用靶点,类风湿关节炎对应1 085个靶点,二者共有44个交集靶点,其中关键作用靶点有IL-6、VEGFA、PTGS2、FOS、JUN、MMP9等。IL-6可诱导中性粒细胞产生血小板活化因子(PAF),PAF 可通过扩大炎症反应刺激FLS 增殖,促进血瘀形成,从而间接影响RA 药物在体内的吸收、代谢、分布[8]。此外,RA 发病的关键机制之一是IL-6 对骨组织的多效性作用,IL-6 可促使核因子κB 受体活化配体(RANKL)的表达[9]。有研究显示,功能单核苷酸多态性VEGFA的等位基因的表达可能降低老年患者和环瓜氨酸抗体(ACPA)阴性患者患RA 的风险[10]。在RA 中,PTGS2可促进FLS 增殖和炎症反应,PTGS2 的降低可起到挽救被抑制的miR-101-3p 在RA 大鼠滑膜损伤和FLS表型改变的作用[11]。有研究显示,许多参与促炎/促破坏特性的关键蛋白,如趋化因子/细胞因子和基质降解酶,都受到AP-1 及其亚基JUN、JUNB、JUND和FOS 的转录调控。FOS 启动子(rs2239615、rs7101)和JUN 启动子(rs4647009)的功能变异在RA 病例、膝关节炎病例和NC 人群中频繁出现[12]。MMP9 可浸润滑膜和软骨下骨组织(包括破骨细胞)中的炎症细胞、血管膜组织和多核细胞[13]。MMP9参与RA中关节的破坏,激活细胞因子和趋化因子,并通过降解上皮基底膜和血管系统促进组织破坏[14]。
对关键靶点进行GO 功能富集分析和KEGG 通路富集分析,对探究黄芩治疗RA的作用机制进一步进行探究。结果显示,富集的生物学过程主要包括核受体活性、转录因子活性、细胞因子受体结合、类固醇激素受体活性、血红素结合、蛋白质异源二聚体活动、四吡咯结合、RNA聚合酶II近端启动子序列特异性DNA结合、BH域结合、近端启动子序列特异性DNA结合等方面。KEGG通路富集分析得出,这些共同靶点参与了细胞凋亡、PI3K-AKT 信号通路、MAPK信号通路、HIF-1信号通路、破骨细胞分化、细胞衰老、趋化因子信号通路等信号通路的功能的调控。在有关RA 病机的研究中,研究人员在细胞凋亡时发现存在冲动可在病理细胞的大量积累时,可通过不同类型的干扰,致使正常滑膜细胞进一步凋亡,经体外研究证实,这种由细胞凋亡干扰所引起的滑膜细胞集聚被认为是TNF和其他细胞因子的来源[15]。PI3K-AKT 信号通路已被证实与免疫系统介导的疾病存在相关性[16]。MAPK信号通路负责调节产生促炎细胞因子的过程,该过程最终可导致关节发炎和破坏[17]。RA 患者滑膜组织可能通过下调MAPK 通路负向调节成骨细胞增殖[18]。Xue 等[19]研究表明,在关节软骨细胞的自噬和骨关节炎炎症反应过程中,PI3K-AKT信号降低,该现象从侧面反映了PI3K-AKT 信号通路与RA 发病的关联性。Malemud[20]的研究成果也显示PI3K-AKT 信号在RA 细胞死亡中起关键作用。抗RA 的药物通过调节MAPK 和VEGF 信号通路来抑制炎症细胞因子的产生和表达,来减少胶原蛋白的产生、抑制滑膜细胞增殖并减弱其侵袭能力,从而发挥抗RA的作用。HIF-1参与了多条细胞信号通路的作用过程[21],B 细胞中HIF-1α的高表达可通过促使机体内IL-6 的产生进而影响T 细胞的分化[22]。骨细胞分化通路与RA 滑膜中许多物质改变的通路有联系。已有证据表明,RA 滑膜中所含有的破骨细胞可导致相应受累关节的骨降解。Harshan等[23]证明了中性粒细胞胞浆因子(NCF)复合物在RA 滑膜中可产生活性氧(ROS)来驱动破骨细胞形成的信号通路上调。证明了T细胞受体信号通路的增强促进了受影响组织中破骨细胞的分化。类风湿关节炎发病早期,淋巴结间质细胞(LNSCs)的衰老可能加速病情的发展,LNSCs是外周耐受性的重要调节因子,与淋巴细胞的接触密切,因此,功能失调的衰老LNSCs会潜在地导致外周耐受性缺陷病和全身性自身免疫病的发病[24]。由趋化因子及其受体所介导的白细胞迁移在类风湿滑膜类炎症的迁延过程中发挥了重要的作用,该途径可致RA滑膜细胞和破骨细胞对软骨和骨的破坏[25]。
本研究通过分子对接,发现PTGS2 与黄芩中黄连碱、表小檗碱、刺槐素、5,7,2’,6’-泰特拉羟基黄酮、5,7,4’-三羟基-6-甲氧基黄酮、黄芩甙元和千层纸素等13种化学成分均与具有较好的结合性,对13种化学成分与PTGS2的结合模式进行分析,发现多个化合物与结合区域内的氨基酸残基Arg44、氨基酸残基Cys36形成了较强的分子间氢键。同时,图表显示ESR1、RELA 与多个黄芩活性成分具有较好的结合性,提示黄芩可通过PTGS2、ESR1、RELA 途径干预RA的活动。
4 结论
本文采用网络药理学为研究方法,构建“黄芩有效成分-靶点-RA”网络,同时从整体上分析了黄芩成分-靶点-信号通路之间的相互作用关系,推测中药黄芩可通过豆甾醇、β-谷甾醇、黄芩甙元、汉黄芩素等潜在药效成分协同作用于NOS2、PTGS1、AR、PTGS2、ADRB2、RELA、BCL2、CDKN1A、BAX、CASP3 等多个靶点,通过细胞凋亡、PI3K-AKT 信号通路、MAPK信号通路、HIF-1信号通路、破骨细胞分化、细胞衰老、趋化因子信号通路等多个信号通路协同作用,共同发挥治疗类风湿关节炎的作用,初步揭示了黄芩治疗RA的作用机制。但由于数据库中纳入的数据来源于不同的试验条件以及研究领域的局限性,且中药在煎煮提取过程中可能产成新成分的或破坏原有成分,故纳入数据分析的成分不能完整全面反映其实际作用于人体的成分。因此,本文对于未来更深入的机制研究具有一定的参考价值,但黄芩治疗RA的具体机制有待更进一步的实验验证。

