O.oeni糖苷酶活性对干白葡萄酒萜烯类香气的影响
祝 霞 赵丹丹 李俊娥 毛亚玲 韩舜愈 杨学山
(1.甘肃农业大学食品科学与工程学院, 兰州 730070; 2.甘肃省葡萄与葡萄酒工程学重点实验室, 兰州 730070)
0 引言
萜烯类化合物能够赋予葡萄及葡萄酒典型的品种特征[1],它们在葡萄成熟过程中逐渐积累,并且以糖苷配基的形式直接连接在β-D-葡萄糖上形成单糖苷,连接有单糖苷配基的葡萄糖可进一步与α-L-呋喃阿拉伯糖、α-L-吡喃鼠李糖、β-D-呋喃芹菜糖等键合生成双糖苷或三糖苷[2]。糖苷测定分析表明,葡萄中的双糖苷键合态香气前体物含量最高,单糖苷次之,三糖苷最低[3],且键合态的糖苷类化合物只有转化为游离态的香气成分才会被消费者感知。单糖苷类香气前体物质可由β-葡萄糖苷酶直接酶解;双糖苷化合物首先在α-L-鼠李糖苷酶、α-L-阿拉伯糖苷酶等外切酶的作用下生成β-D-葡萄糖单糖苷,然后在β-D-葡萄糖苷酶作用下释放出具有挥发性的糖苷配基[4-5]。因此,特异性的单糖苷酶和双糖苷酶被认为是释放萜烯类化合物的有效工具。
酿酒酵母可以分泌糖苷酶,但在高糖、高酒精、高多酚以及低pH值的酿酒工艺条件下无法保持其高效的催化活性[6-7]。此外,一些非酿酒酵母也可以合成活力较高的β-葡萄糖苷酶,但其生长仅局限于酒精发酵开始阶段,随着酒精含量的增加,非酿酒酵母数量会急剧下降[8]。苹果酸-乳酸发酵(Malolactic fermentation,MLF)是酿造优质干红和部分干白葡萄酒所必需的生产工艺[9],O.oeni菌株在生物降酸的同时还可以合成释放糖苷酶,从而丰富和提升酒体的香气品质[9-13]。文献[12]提出,评价优良O.oeni菌株发酵特性时,不能只局限于β-D-葡萄糖苷酶,还应考虑α-L-阿拉伯糖苷酶和α-L-鼠李糖苷酶的活性。文献[14]研究表明,O.oeni糖苷酶具有较强的菌株依赖性,供试菌株中90%的菌株具有活性较高的α-L-鼠李糖苷酶,50%左右的菌株α-L-阿拉伯糖苷酶活性较高。因此,有必要对菌株合成糖苷酶特性进行系统分析,以便在用于发酵剂之前进行合理选择。
为了在日益全球化的葡萄酒市场中寻求独特之处,分离筛选优良本土O.oeni、酿造代表产区风格的葡萄酒已成为研究者关注的焦点[15-21]。本文以分离筛选的本土O.oeni菌株为试验对象,以商业菌株VP41为对照,探讨各酿造因子对供试菌株糖苷酶活性的影响,动态监测发酵过程中菌株糖苷酶活性的变化,并在优化后的酿造条件下进行霞多丽干白葡萄酒MLF,分析比较MLF前后酒样中萜烯类物质的变化,以期为挖掘本土菌株酿造特性、生产代表河西走廊产区的葡萄酒提供技术支持。
1 材料与方法
1.1 试验材料
本土酒酒球菌菌株:GF-2、ZX-1、QL-11、MG-1菌株分离自甘肃省河西走廊产区葡萄酒生产企业自然启动MLF酒样,由北京六合华大基因科技有限公司进行种属鉴定。16S rDNA测序结果显示,GF-2、ZX-1、QL-11、MG-1与模式菌株OenococcusoeniDSM 20252(T)相似度分别达到99.84%、99.34%、99.78%、99.58%。
商业酒酒球菌:VP41,购自上海杰兔责任有限公司。
商业酿酒酵母:ES488,购自意大利Enartis公司。
酿酒葡萄:选用2019年产自甘肃省莫高葡萄种植基地的霞多丽葡萄,含糖量约为21.3°Brix,总酸质量浓度6.87 g/L(以酒石酸计),pH值3.36。
1.2 培养基与试剂
酸性番茄培养基(ATB)配制参照文献[16]的方法。
参照文献[18]的方法进行模拟汁培养基的配制:葡萄糖1 g/L、果糖1 g/L、L-苹果酸2 g/L、海藻糖1 g/L、酒石酸1 g/L、柠檬酸1 g/L、乙酸钠0.14 g/L、酵母浸粉4.0 g/L、水解酪蛋白2.5 g/L、KH2PO40.3 g/L、KCl 0.22 g/L、L-型半胱氨酸盐酸0.5 g/L、MgSO4·7H2O 0.065 g/L、MnSO4·4H2O 0.015 g/L、CaCl20.065 g/L、甘油3 mL/L。
香气标准品:香茅醇、橙花醇、芳樟醇、α-松油醇、β-紫罗兰酮、反式橙花叔醇等香气化合物和内标物2-辛醇标准品(美国Sigma公司)。
其他试剂:L-苹果酸检测试剂盒(爱尔兰Megazyme公司);对硝基苯酚(p-NP)、对硝基苯酚-β-D-葡萄糖苷(p-NPG)、4-硝基苯基-α-L-吡喃鼠李糖苷、4-硝基苯基-α-L-吡喃阿拉伯糖苷(上海源叶有限责任公司);氢氧化钠、柠檬酸、磷酸二氢钾、碳酸钠,均为分析纯试剂(天津光复精细化工研究所)。
1.3 仪器与设备
SPX-150-Ⅱ型生化培养箱(上海跃进医疗器械有限公司);pHS-3C型pH计(上海雷磁责任有限公司);TU-1810型可见分光光度计(上海元析仪器有限公司); SW-CJ-2FD型超净工作台(苏州安泰空气技术有限公司);LDZX-50KBS型高压蒸汽灭菌锅(上海申安医疗器械厂);GZX-GF101-Ⅱ型恒温干燥箱(上海跃进医疗器械有限公司);H2050R型高速冷冻离心机(长沙湘仪仪器有限公司)。
1.4 试验方法
1.4.1标准曲线制备
参照文献[22]的方法并略作修改。当p-NP浓度在10~80 μmol/L范围时,400 nm处OD值与浓度回归方程为:y=0.007 6x+0.019 9,R2=0.997 4,线性关系良好,可用作后续试验中糖苷酶活性的计算。
1.4.2菌种活化
参照文献[20]的方法挑取斜面上保存的菌种置于灭菌后的ATB培养基内,在28℃下培养,待生长至对数期时(600 nm处OD值约1.1),进行后续试验接种。
1.4.3糖苷酶活性测定方法
(1)β-D-葡萄糖苷酶活力
参照文献[14]的方法并略作修改。以对硝基苯基-β-D-吡喃葡萄糖苷为底物,反应体系(2.5 mL)为:从模拟汁培养基中取1 mL的培养液,加1 mL柠檬酸-磷酸缓冲溶液(pH值5.0)和0.5 mLp-NPG溶液,混合后于50℃条件反应30 min,然后8 000 r/min离心15 min,取上清液,加入2 mL的1 mol/L Na2CO3终止反应。在400 nm波长处测定吸光度。
酶活力单位(U)定义为:每1 min每1 mL菌体细胞水解相应底物生成p-NP所需要的酶量(μmol)。
(2)α-L-鼠李糖苷酶活力
参照文献[23]的方法。以4-硝基苯基-α-L-吡喃鼠李糖苷为底物,反应体系(3.5 mL)为:取0.4 mL的培养液,加1 mL柠檬酸-磷酸缓冲溶液(pH值5.0)和0.1 mL底物(1.5 mmol/L)溶液,混合后于50℃条件下反应30 min后8 000 r/min离心15 min,取上清液,加入2 mL 0.5 mol/L Na2CO3终止反应。在400 nm波长处测定吸光度。
(3)α-L-阿拉伯糖苷酶活力
参照文献[24]的方法。以4-硝基苯基-α-L-吡喃阿拉伯糖苷为底物,反应体系(2.1 mL)为:取0.4 mL的培养液,加1 mL柠檬酸-磷酸缓冲溶液(pH值5.0)和0.1 mL底物(1.5 mmol/L)溶液,混合后于50℃条件下反应30 min,然后8 000 r/min离心15 min,取上清液,加入0.6 mL饱和硼砂溶液终止反应。在400 nm波长处测定吸光度。
1.4.4本土酒酒球菌菌株酶活力评价
利用模拟汁体系对4株本土O.oeni及1株商业O.oeni菌株的3种糖苷酶(β-D-葡萄糖苷酶、α-L-鼠李糖苷酶和α-L-阿拉伯糖苷酶)活力进行测定,分析比较供试菌株酶活性变化规律,筛选产酶活性较高的菌株。试验平行重复3次。
1.4.5各酿造因子对菌株糖苷酶活性的影响
(1)初始pH值
将鉴定所得O.oeni菌株经ATB斜面培养、ATB液体培养基活化后,取处于对数生长期的供试菌株以1×107CFU/mL的接种量,分别接种于pH值为3.0、3.2、3.4、3.6、3.8的模拟汁培养基中(HCl或NaOH调整pH值),28℃静置培养,每隔48 h测定发酵液中糖苷酶活性。试验重复3次,下同。
(2)乙醇体积分数
将培养至对数生长期的O.oeni菌株,以1×107CFU/mL的接种量分别接种于乙醇体积分数为6%、8%、10%、12%、14%的模拟汁培养基中,28℃静置培养,每隔48 h测定发酵液中糖苷酶的活性。
(3)发酵温度
待O.oeni菌株培养至对数生长期,以1×107CFU/mL的接种量接种于模拟汁培养基中,分别置于18、20、22、25、28℃培养箱静置培养,每隔48 h测定发酵液中糖苷酶的活性。
(4)SO2添加量
以1×107CFU/mL的接种量,将培养至对数生长期的O.oeni菌株,分别接种于SO2添加量(亚硫酸钠调节)为15、30、45、60、75 mg/L的模拟汁培养基中,28℃静置培养,每隔48 h测定发酵液中糖苷酶的活性。
1.4.6复合试验设计
根据单因素试验结果,对pH值、乙醇体积分数、发酵温度、SO2添加量4个因素进行L9(34)正交试验设计。
1.4.7微酿试验
菌株活化:参考厂家说明书推荐方法进行酿酒酵母菌株活化。按推荐用量(0.2 g/L)将ES488干酵母菌粉溶于10倍体积无菌水中,37℃静置溶解20 min,再加入等体积的葡萄汁于28℃活化25 min。酒酒球菌菌株活化参照1.4.2节的方法进行。
葡萄酒微酿试验:参照文献[25]完成霞多丽干白葡萄酒酒精发酵后,选择产酶性能优良的O.oeni菌株,按1×107CFU/mL的接种量进行接种,以商业菌VP41作为对照。自接入菌株开始,每隔48 h取样,测定L-苹果酸质量浓度,小于0.2 g/L时结束MLF。取样测定理化指标和萜烯类香气化合物。
理化指标测定:酒精度、残糖含量、pH值、总酸含量、挥发酸含量和总SO2含量检测均参照文献[26]中的试验方法进行。L-苹果酸含量测定参考L-苹果酸检测试剂盒说明书进行。
挥发性香气化合物含量的测定:参照文献[25]的香气物质萃取方法及气相色谱-质谱联用仪(Gas chromatography and mass spectrometry,GC-MS)条件,进行香气成分富集和定性定量分析。于15 mL的顶空瓶中加入2.5 g氯化钠、8 mL酒样、20 μL 2-辛醇(质量浓度81.06 mg/L),加磁力搅拌转子后封口,放入恒温加热磁力搅拌器中,40℃水浴平衡30 min,然后插入萃取针顶空萃取30 min。
(1)GC-MS条件
GC条件:色谱柱DB-WAX 60 m×2.5 mm×0.25 μm,不分流进样;载气(He)流速1 mL/min;进样口温度240℃,解析时间5 min;柱温升温程序:50℃保持5 min,以3.5℃/min升至180℃,保持15 min。
MS条件:电子轰击离子源(EI);电子能量70 eV;传输线温度180℃;离子源温度200℃;质谱扫描范围50~350(质荷比)。
(2)定性与定量分析
定性分析:采用与标准香气成分保留时间(RT)对比的方法结合NIST-11、Wiley及香精香料标准谱库检索比对结果进行挥发性香气化合物定性分析。
定量分析:对于已有标准品的香气化合物通过内标标准曲线法进行定量分析,其他香气化合物含量利用内标法进行相对定量分析,内标物为2-辛醇。
1.4.8试验数据处理
对试验所得数据采用Microsoft Office Excel 2010、Origin 2018进行基本处理和制图,IBM SPSS Statistics 19.0 软件进行多重比较(Duncan法,P<0.05)及差异显著性分析。
2 结果与分析
2.1 本土酒酒球菌菌株糖苷酶活性测定
分别将供试菌株接种于模拟汁培养基中进行发酵,每隔48 h取样,测定酶活力。由于MLF在14 d时基本结束,发酵过程中共需取样7次,且所测酶种类较多(3种),为便于直观比较各菌株的酶活性,参照文献[27]的方法,采用酶活力累积量(mU/mL),即同一菌株、同一种酶的7次测定结果逐次相加,表征分析不同菌株之间的差异(表1),下同。
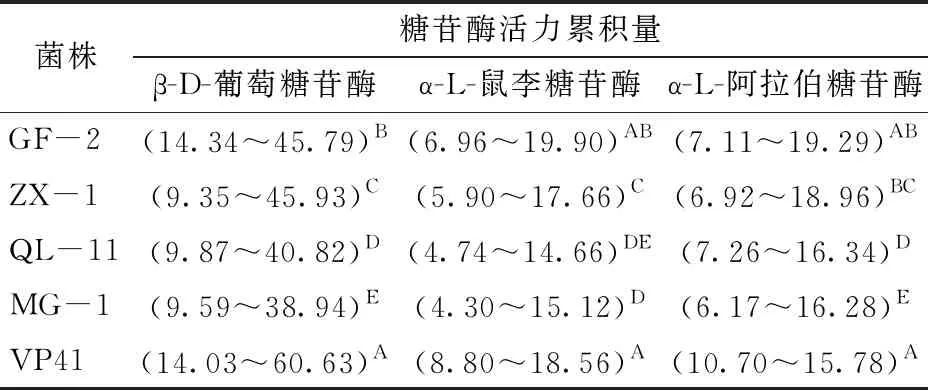
表1 5株O.oeni糖苷酶活性测定
由表1可知,对4株供试本土O.oeni的3种糖苷酶活性比较发现,菌株GF-2、ZX-1的β-D-葡萄糖苷酶、α-L-鼠李糖苷酶活性最高值都分别显著高于菌株QL-11、MG-1的最大酶活性(P<0.05)。QL-11、MG-1的3种酶活性测定值都低于菌株VP41的酶活性。因此,选择菌株GF-2、ZX-1为后续的测试菌株。
2.2 各发酵条件对本土酒酒球菌菌株糖苷酶活性的影响
结合态香气双糖苷酶解时,首先由双糖苷酶作用于相应的阿拉伯糖、鼠李糖基等糖基配体,使双糖苷变为单糖苷;然后再由β-D-葡萄糖苷酶断裂糖苷键,生成游离芳香苷元和葡萄糖[28]。因此采用双糖苷酶活力累积量(mU/mL)(α-L-鼠李糖苷酶和α-L-阿拉伯糖苷酶活力累积量之和)和β-D-葡萄糖苷酶活力累积量(mU/mL),分别直观表征在不同发酵条件下供试菌株之间的糖苷酶活性差异。
2.2.1初始pH值
由图1(图中不同小写字母表示在P<0.05水平下组内(相同横坐标、不同图例)差异显著,不同大写字母表示在P<0.05水平下组间(相同图例、不同横坐标)差异显著,下同)所示,随着pH值的增加,供试菌株的β-D-葡萄糖苷酶和双糖苷酶活力累积量都呈现增加趋势,且菌株VP41的2种酶活性低于菌株ZX-1、GF-2的酶活性。供试菌株在pH值为3.6或3.8时具有最大的β-D-葡萄糖苷酶活力累积量,且在不同的pH值梯度下,菌株GF-2的β-D-葡萄糖苷酶活力比ZX-1和VP41的酶活性显著较高。VP41的最大双糖苷酶活力累积量(19.440 mU/mL)出现在pH值为3.8,ZX-1、GF-2的最大双糖苷酶活力累积量则是在pH值为3.6时产生(32.964、22.718 mU/mL)。当初始pH值为3.0时,VP41比ZX-1表现出更强的酶活特性;除pH值3.0以外,菌株ZX-1的双糖苷酶活性在不同pH值下都显著高于其它供试菌株(P<0.05)。
2.2.2乙醇体积分数
由图2可知,不同菌株在不同乙醇体积分数影响下的β-D-葡萄糖苷酶活力累积量不同。本土O.oeni菌株ZX-1、GF-2在乙醇体积分数为8%时产生最大β-D-葡萄糖苷酶活力累积量(24.570、30.166 mU/mL),对照菌株VP41的最大β-D-葡萄糖苷酶活力累积量在乙醇体积分数为6%时产生(17.202 mU/mL),且在乙醇体积分数为6%~8%时,VP41的β-D-葡萄糖苷酶活力累积量显著低于本土O.oeni的酶活力累积量(P<0.05)。乙醇体积分数为6%~12%时,菌株GF-2的双糖苷酶活力累积量均高于菌株ZX-1和VP41的酶活力累积量,但当乙醇体积分数达到14%时,VP41的双糖苷酶活力累积量显著高于2株本土O.oeni,表明商业菌株VP41在较高乙醇体积分数的葡萄酒中更有利于品种香的释放。此时,GF-2的双糖苷酶活力累积量显著下降,与ZX-1无显著差异(P<0.05)。
2.2.3SO2添加量
图3为SO2添加量对供试菌株糖苷酶活力的影响。供试菌株在SO2添加量为30 mg/L时有最大β-D-葡萄糖苷酶活力累积量,且GF-2的β-D-葡萄糖苷酶活力累积量(30.933 mU/mL)显著高于ZX-1和VP41菌株;SO2添加量为45~75 mg/L时,ZX-1与VP41的β-D-葡萄糖苷酶活力累积量差异不显著(P<0.05)。在SO2添加量为15~45 mg/L时,ZX-1的双糖苷酶活力累积量显著高于GF-2和VP41,当SO2添加量为60~75 mg/L时,商业菌株VP41的双糖苷酶活力累积量显著高于本土O.oeni。
2.2.4发酵温度
发酵温度是葡萄酒酿造过程中最可控的因素之一,不适宜的发酵温度会导致杂菌的生长,从而破坏葡萄酒的感官质量[10]。O.oeni的最适生长温度是25~28℃,而葡萄酒的MLF温度为18~22℃,综合考虑,选择在18~28℃不同的温度下,对菌株酶活性变化情况进行测定分析。
由图4可知,在不同发酵温度下,本土O.oeni菌株与商业菌株的β-D-葡萄糖苷酶活力累积量不同。菌株VP41在22℃时有最大β-D-葡萄糖苷酶活力累积量(60.637 mU/mL),而本土O.oeni菌株的最大酶活性则是在20℃产生,且菌株ZX-1和GF-2的最大酶活性没有显著性差异(P<0.05)。虽有研究证明28℃为O.oeni菌株较适宜的生长温度,但28℃时本土O.oeni菌株与商业菌株的β-D-葡萄糖苷酶活性较低。菌株VP41的最大双糖苷酶活性在28℃产生(29.695 mU/mL)。本土O.oeni菌株在22℃时双糖苷酶活力累积量最小,最大酶活性在18℃时产生。
2.3 复合发酵条件下菌株酶活性的测定
葡萄酒酿造过程中,多个发酵参数会协同影响O.oeni的生长,O.oeni对葡萄酒生境的耐受能力决定着MLF的进展程度。因此,在复合发酵条件下测定供试菌株的酶活性,对依据酿造风格选择MLF菌株更具有参考价值[28]。根据单因素试验结果,pH值选取3.4、3.6、3.8共3个水平,虽然较高浓度的乙醇会抑制O.oeni的生长,但大部分干型葡萄酒的酒精度在10~15%vol之间,为了模拟真实的葡萄酒环境,结合单因素试验结果,选取乙醇体积分数10%、12%和14%共3个水平进行后续试验。结合干型葡萄酒酿造工艺的要求,选择SO2添加量为30、45、60 mg/L进行复合因子发酵试验。28℃是O.oeni菌株生长的较佳培养温度,但过高的发酵温度存在挥发酸过量的风险[15]。因此,结合葡萄酒MLF的实际情况,在复合发酵试验设计时选择发酵温度为18、20、22℃。
2.3.1β-D-葡萄糖苷酶活性
由表2可知,乙醇体积分数为12%时,供试菌株有最大的β-D-葡萄糖苷酶活力累积量,分别为22.716 mU/mL(ZX-1)、23.990 mU/mL(GF-2)、23.506 mU/mL(VP41);当SO2添加量为30 mg/L时,ZX-1的β-D-葡萄糖苷酶活力累积量为25.507 mU/mL,GF-2的β-D-葡萄糖苷酶活力累积量为27.914 mU/mL,VP41的β-D-葡萄糖苷酶活力累积量为29.529 mU/mL;与pH值3.4、3.8相比,pH值为3.6时,供试菌株的β-D-葡萄糖苷酶活力累积量达到最大值,且在发酵温度22℃时,菌株的酶活性也较好。
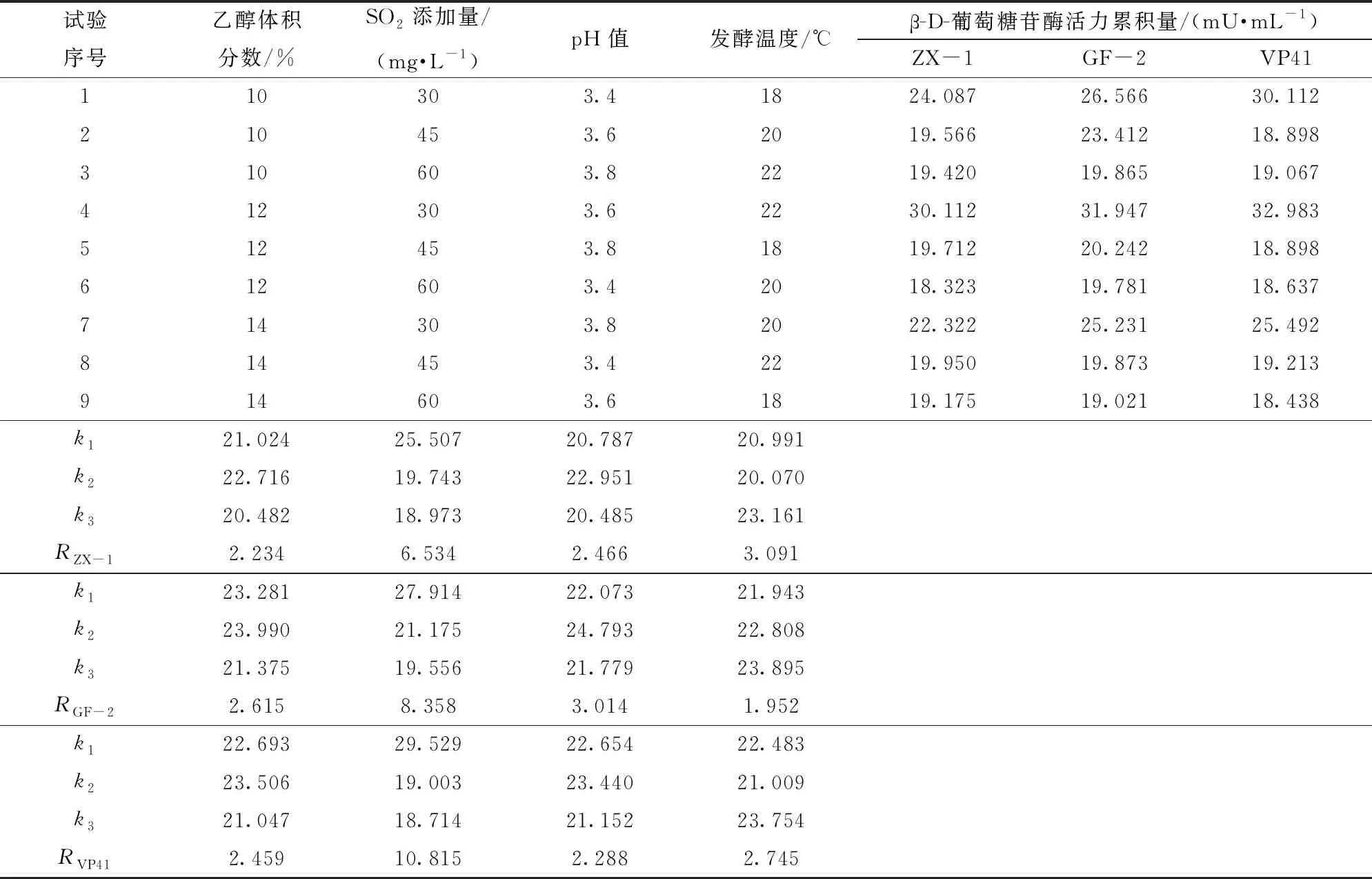
表2 β-D-葡萄糖苷酶活性测定正交试验结果与极差分析
从极差R可以看出,不同发酵因素对菌株ZX-1的β-D-葡萄糖苷酶活性影响从大到小依次为:SO2添加量、发酵温度、pH值、乙醇体积分数;对菌株GF-2的β-D-葡萄糖苷酶活性影响从大到小依次为:SO2添加量、pH值、乙醇体积分数、发酵温度;对VP41菌株β-D-葡萄糖苷酶活性影响从大到小依次为:SO2添加量、发酵温度、乙醇体积分数、pH值。
由表3可知,SO2添加量对供试菌株的β-D-葡萄糖苷酶活性有极显著影响(P<0.01)。pH值、发酵温度、乙醇体积分数对菌株ZX-1和VP41的β-D-葡萄糖苷酶活性有显著影响(P<0.05);pH值、乙醇体积分数对菌株GF-2的β-D-葡萄糖苷酶活性有显著影响(P<0.05)。
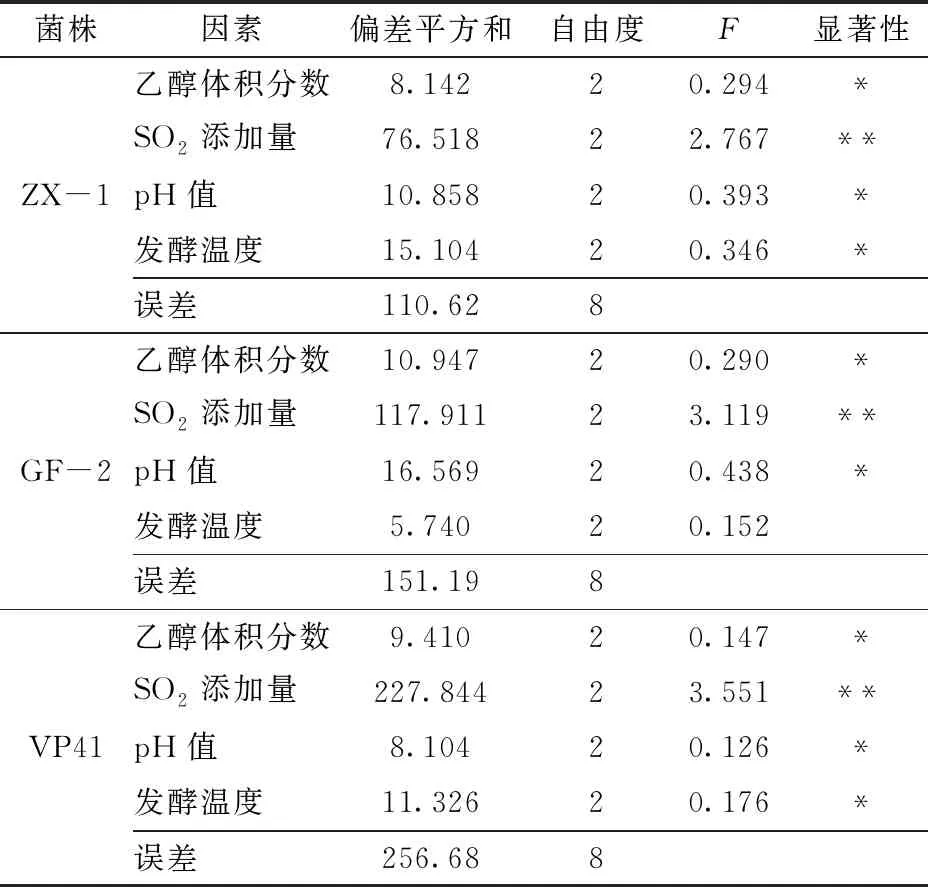
表3 β-D-葡萄糖苷酶活性测定正交试验方差分析
2.3.2双糖苷酶活性
在复合发酵条件下,菌株的双糖苷酶活性表现出相似性,即在乙醇体积分数为12%、SO2添加量为30 mg/L、pH值3.6、发酵温度22℃的条件下,具有最大的双糖苷酶活力累积量。由表4可知,供试菌株的双糖苷酶活力累积量有差异,从大到小依次为GF-2(46.576 mU/mL)、ZX-1(46.806 mU/mL)、VP41(36.774 mU/mL)。
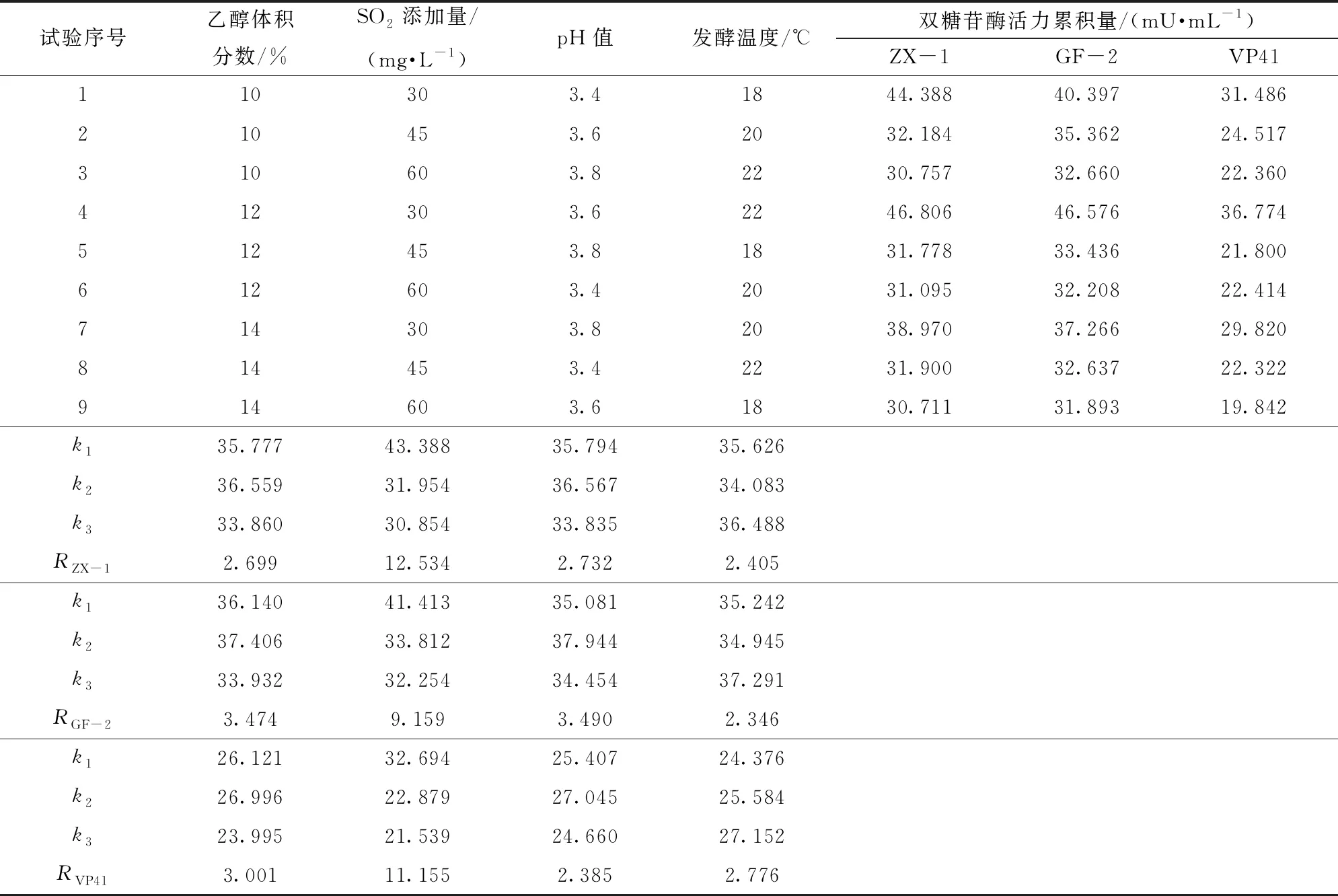
表4 双糖苷酶活性测定正交试验结果与极差分析
从极差R可以看出,不同发酵因素对菌株ZX-1双糖苷酶活性影响从大到小依次为:SO2添加量、pH值、乙醇体积分数、发酵温度;对菌株GF-2双糖苷酶活性影响从大到小依次为:SO2添加量、pH值、乙醇体积分数、发酵温度;对菌株VP41双糖苷酶活性影响从大到小依次为:SO2添加量、乙醇体积分数、发酵温度、pH值。
由表5可知,SO2添加量对供试菌株的双糖苷酶活性影响极显著(P<0.01)。pH值、乙醇体积分数对菌株ZX-1和GF-2的双糖苷酶活性有显著影响(P<0.05);发酵温度、乙醇体积分数对菌株VP41的双糖苷酶活性有显著影响(P<0.05)。
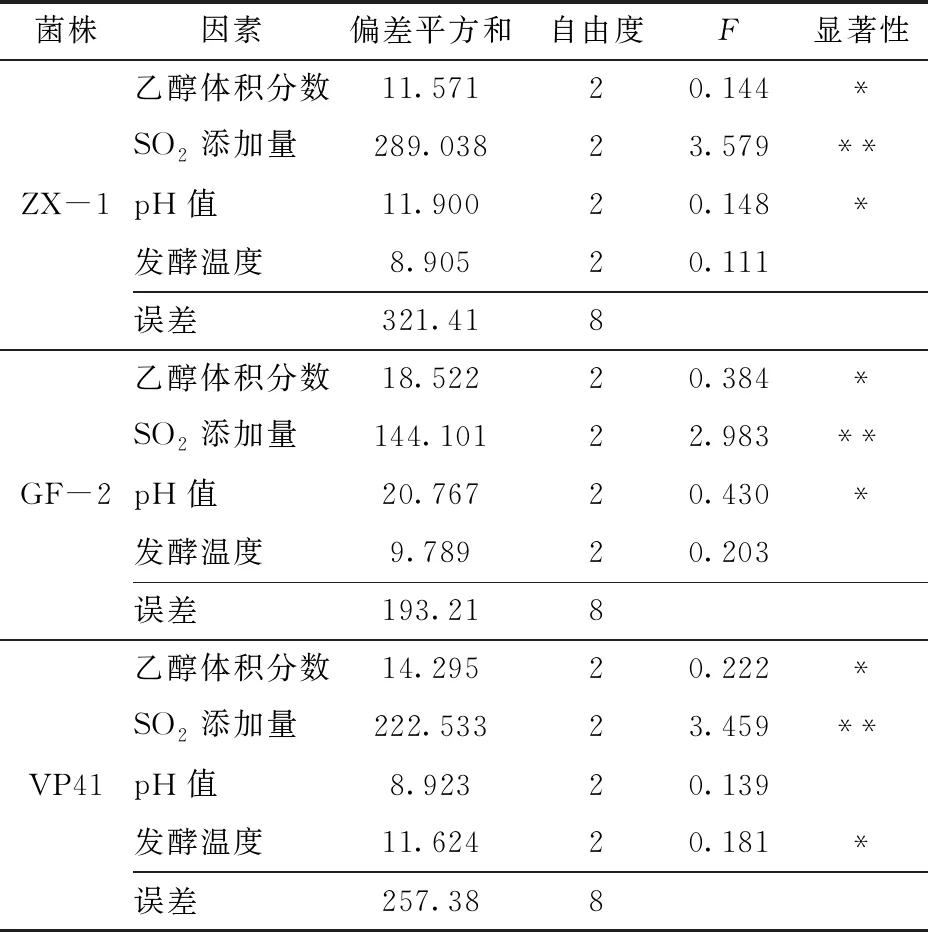
表5 双糖苷酶活性测定正交试验方差分析
2.4 验证试验
根据正交试验结果,选择受试组中β-D-葡萄糖苷酶活性和双糖苷酶活性最高的发酵条件,即乙醇体积分数为12%、pH值为3.6、SO2添加量为30 mg/L、发酵温度为22℃的复合条件下,将发酵菌株分别接种于模拟汁中,进行验证试验,平行重复3次。结果表明ZX-1、 GF-2和VP41的β-D-葡萄糖苷酶活力累积量平均值分别为30.020、29.884、33.032 mU/mL,双糖苷酶活力累积量平均值分别为45.932、46.137、37.011 mU/mL,均高于正交试验其他处理组。由此确定在该条件下进行霞多丽干白葡萄酒MLF,并进行萜烯类物质检测分析。
2.5 微酿试验
2.5.1MLF后葡萄酒理化指标
霞多丽干白葡萄酒的基本理化指标见表6。由表6可知,各酒样中L-苹果酸质量浓度均小于0.2 g/L,表明MLF成功完成。pH值升高0.11~0.16,总酸质量浓度降低2.48~2.62 g/L。挥发酸含量虽然有所升高,但质量浓度最大值为0.42 g/L(<1.2 g/L),均符合GB/T 15037—2006的要求。供试本土O.oeni菌株在第12天完成MLF,商业菌株VP41则在第14天完成MLF。

表6 苹果酸-乳酸发酵前后干白葡萄酒样理化指标
2.5.2萜烯类化合物GC-MS检测
不同处理条件下,各处理组中萜烯类化合物含量的变化情况见表7。ZX-1处理组中萜烯类物质的总含量最高,质量浓度为515.897 μg/L,而VP41处理组中的萜烯类物质种类最多(11种)。2.3节的研究表明,虽然在不同复合条件下,菌株VP41的双糖苷酶活力累积量显著低于本土O.oeni(P<0.05),但其β-D-葡萄糖苷酶在最优复合条件下显著高于本土O.oeni的酶活力累积量(P<0.05)。萜烯类物质在葡萄果实中主要以双糖苷的形式存在,在葡萄酒中双糖苷酶作用生成的单糖苷物质由β-D-葡萄糖苷酶进一步水解,生成游离态的萜烯类物质。本土O.oeni发酵后的酒样中虽然萜烯类物质种类仅次于VP41处理后的酒样,但酒样中的总含量却较高,α-松油醇、香茅醇、大马士酮、芳樟醇等萜烯类物质的质量浓度高于其阈值,具有潜在的花香味。
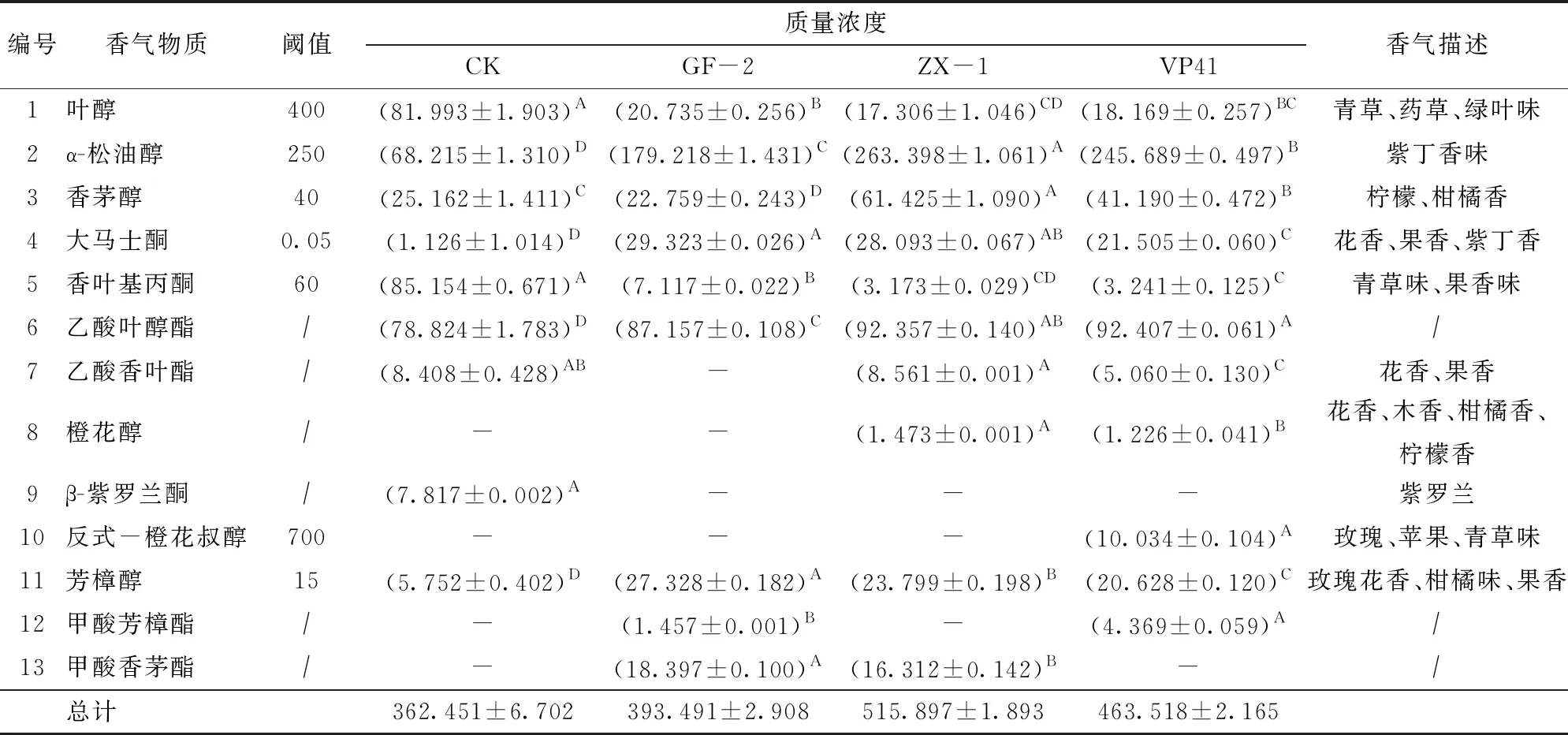
表7 各处理酒样中萜烯类物质含量的变化
3 讨论
3.1 酿造因子对O.oeni糖苷酶活性的影响
一些葡萄酒成分,如糖和乙醇,或酿酒过程中的温度和pH值等因素均会影响糖苷的活性[14]。本试验选择糖苷酶活性表现较好的2株本土O.oeni(GF-2、ZX-1)和商业菌株VP41,分析初始pH值、乙醇体积分数、SO2添加量、发酵温度等对菌株的糖苷酶活特性进行分析。结果发现不同酿造因子对同一菌株的糖苷酶活性影响不同,且存在着显著差异(P<0.05)。文献[2]研究表明,pH值是抑制O.oeni菌株酶活性的重要因子,与菌株酶活性呈正相关,这与本试验中供试菌株在pH值为3.6~3.8时,菌株的酶活力累积量最高的结果相一致。同时在本试验中当乙醇体积分数为6%~8%时,菌株糖苷酶活性最大;乙醇体积分数为10%~14%时,糖苷酶活性缓慢下降,与文献[29]中乙醇影响O.oeni菌株的生长参数,却不影响酶活性的研究结果存在差异。可能是因为乙醇改变了细胞膜的通透性,从而使胞内酶和底物之间更容易接触[14]。同时酶活性的降低可以解释为蛋白质变性的结果。文献[16]的研究强调了添加SO2可能有助于调节MLF期间O.oeni的糖苷酶活性,本研究发现菌株在30 mg/L时有最大酶活性,得到了类似的结果。发酵温度是葡萄酒酿造过程中最可控的因素之一,菌株VP41在22℃时有最大β-D-葡萄糖苷酶活性,而本土O.oeni菌株的最大酶活性则是在20℃产生,虽有研究证明28℃为O.oeni菌株较适宜的生长温度,但本土O.oeni菌株与商业菌株的β-D-葡萄糖苷酶活性较低;菌株VP41的最大双糖苷酶活性在28℃产生,本土O.oeni菌株最大双糖苷酶活性在18℃产生,这提示在葡萄酒实际生产中,应根据发酵菌株特点选择最适宜的发酵温度。
3.2 O.oeni对葡萄酒萜烯类物质的影响
萜烯类化合物气味阈值低、风味强烈、感官特征明显,主要以糖苷态的形式存在于葡萄果皮中。O.oeni在MLF过程中降低葡萄酒酸度的同时伴随着一系列的代谢活动,其中大量的酶代谢使得产生的挥发性化合物浓度远超过其阈值,致使葡萄酒香气浓郁度增加。本试验接种不同O.oeni菌株分别对霞多丽干白葡萄酒进行MLF,结果表明本土菌株处理的酒样虽然萜烯类物质种类仅次于VP41处理后的酒样,但酒样中的总含量却较高,α-松油醇、香茅醇、大马士酮、芳樟醇等萜烯类物质的含量高于其阈值,这与菌株具有的糖苷酶活性及类型有关。文献[30]发现,MLF后酒样中β-大马士酮的浓度明显增加,表明该化合物的形成可能与参与的菌株的水解活性有关。文献[15]发现接种O.oeniMS46的葡萄酒MLF后的酒样中形成了β-香茅醇(柑橘香味),可能是经菌株MS46的糖苷酶对底物释放后合成。本研究正如预期,MLF后萜烯类化合物质量浓度明显增加,与文献[11]的结果相一致。
4 结论
(1)在单因素条件下,供试菌株糖苷酶活性变化趋势具有菌株相似性,在不同梯度条件下产酶活性具有一定的菌株差异性。当pH值为3.6时本土O.oeni菌株的糖苷酶活性均具有最大酶活性,且菌株ZX-1、GF-2的两种酶活性高于商业菌株VP41的酶活性;乙醇体积分数在6%~8%时,供试菌株的糖苷酶都有最大酶活性;SO2添加量为30 mg/L时,供试菌株的β-D-葡萄糖苷酶和双糖苷酶的酶活性均达到峰值;本土O.oeni的β-D-葡萄糖苷酶在20℃时产生的酶活性最高,菌株VP41在22℃下酶活性有最大值。复合酿造因子试验结果表明,在pH值3.6、乙醇体积分数为12%、SO2添加量为30 mg/L、发酵温度为22℃的发酵条件下,供试菌株均有最大酶活力累积量,但本土O.oeni菌株的糖苷酶活力累积量高于商业菌株VP41。
(2)霞多丽干白葡萄酒微酿试验结果表明,供试本土菌株具有良好的L-苹果酸降解能力。萜烯类化合物GC-MS分析结果显示,本土O.oeniZX-1发酵后的酒样中虽然萜烯类物质种类仅次于VP41处理后的酒样,但酒样中的总含量却最高(质量浓度515.897 μg/L),α-松油醇、香茅醇、大马士酮、芳樟醇等萜烯类物质的质量浓度高于其阈值,具有潜在的花香味,这与供试菌株的风味酶活性累积量变化规律相一致。

