超声-微波协同优化花生红衣原花青素提取工艺及抗氧化研究
王娜,崔晨旭,郑玉茹,解书蕴,师飞,张晗玮,徐超*
(1.河南农业大学食品科学技术学院,河南 郑州 450002;2.郑州市营养与健康食品重点实验室,河南 郑州 450002)
花生红衣(peanut skin,PS),为豆科植物花生种皮,颜色通常为粉红或红色,味道苦涩[1]。花生红衣作为花生深加工副产物,全球产量约93万吨/年[2],大多作为废弃物,也有作为畜牧业的动物饲料,利用度和产品附加值低,造成资源的极大浪费和污染[3]。花生红衣中含有丰富的活性成分,如单宁酸、白藜芦醇,原花青素(procyanidins,PSPc)等[4],特别是 PSPc 含量高达128 g/kg[3],是一种普遍存在于植物中的多酚类物质。研究表明,PSPc 具有抗氧化[5]、抑菌[6]、抗癌[7-8]、降血脂、改善血糖水平[1]、抗过敏[9]以及抑制丙烯酰胺[10]产生的生物学功效,而且与葡萄籽原花青素相比,具有更高的生物利用度[11]。众多研究显示,PSPc可能成为未来膳食补充剂和功能成分的可持续来源[12]。
目前,花生红衣中PSPc的提取方法主要包括:溶剂提取法、微波辅助提取法、超声辅助提取法、超临界提取法[3]。溶剂提取法提取时间长,且提取率普遍不高[13];超临界提取法相比于传统辅助有机溶剂提取法得率更高、选择性好,但成本高;微波辅助提取法和超声辅助提取法具有缩短提取时间、降低提取剂用量、提高得率、绿色环保等优点[14-16],温志英[14]采用优化后的微波辅助提取法提取PSPc,PSPc提取率达到11.38%,王翠莲等[17]优化后的PSPc超声辅助提取法得率可达15.36%。但利用超声-微波互作协同提取PSPc的方法未见报道。超声-微波互作协同提取法,将超声波辅助提取法和微波辅助提取法结合,具有提高效率,大大缩短提取时间、降低能耗等优点[18],从而得到广泛应用。
本研究以花生红衣为原料,利用超声-微波协同辅助乙醇提取PSPc,在单因素(超声功率、超声时间、微波功率、微波时间、乙醇浓度、料液比、浸提温度)试验的基础上,利用Plackett-Burman(PB)试验设计筛选出影响PSPc提取量的显著因素,进一步采用响应面法对提取工艺进行优化;并且评价不同提取工艺对PSPc提取量和其抗氧化活性(DPPH自由基清除能力、羟自由基清除能力和铁离子还原/抗氧化能力),为花生红衣的开发和高值利用提供理论基础。
1 材料与方法
1.1 材料与仪器
花生红衣:河南农业大学食品科学技术学院郑州市营养与健康食品重点实验室提供;原花青素标准品(纯度:95%)、1,1-二苯基-2-三硝基苯肼、AB-8大孔树脂:美国Solarbio公司;甲醇、无水乙醇、石油醚(30℃~60℃)、水杨酸、过氧化氢、七水合硫酸亚铁(均为分析纯):国药集团化学试剂公司。
CW-2000型超声-微波协同提取仪:上海新拓分析仪器科技有限公司;UV-1100紫外分光光度计:尤尼柯上海仪器有限公司;RE-52AA旋转蒸发器、SHZ-Ⅲ型循环水真空泵、C-0506低温恒温槽:上海亚荣生化仪器厂;LGJ-10D真空冷冻干燥机:北京四环科学仪器厂有限公司;HC-200T高速多功能粉碎机:武义海纳电器有限公司。
1.2 试验方法
1.2.1 花生红衣干粉制备
将花生红衣干燥后粉碎过80目筛,用石油醚脱脂,然后抽滤、烘干,得到脱脂后的花生红衣粉末装自封袋备用。
1.2.2 PSPc制备工艺
工艺流程:花生红衣干粉→抽提去脂→超声-微波协同作用→水浴浸提→冷却并抽滤→原花青素提取液→大孔树脂净化→真空浓缩→冷冻干燥→研磨粉碎。
1.2.3 PSPc提取量的测定
1.2.3.1 标准曲线的绘制
参考周婷等[19]的研究中标准曲线制作方法,以吸光度对原花青素浓度做标准曲线。
1.2.3.2 试样测定
将样品用甲醇稀释后,吸取0.5mL试样并加入3mL香草醛-甲醇溶液、1.5 mL浓盐酸,然后迅速混匀(避光操作),30℃水浴20min,于500nm波长下测吸光度。
试样中PSPc提取量计算公式如下。

式中:X为试样中原花青素的提取量,mg/g;X1为通过标准曲线计算出的原花青素含量,mg/mL;V1为试样定容体积,mL;f为稀释倍数;m为样品质量,g。
1.2.4 单因素试验设计
准确称量0.5 g花生红衣干粉,提取工艺同1.2.2,研究超声功率、超声时间、微波功率、微波时间、料液比、浸提温度、乙醇体积分数7个因素对PSPc提取量的影响,单因素梯度如表1所示。每个试验重复3次,结果取平均值。

表1 单因素试验设计Table 1 Single factor experimental design
1.2.5 Plackett-Burman试验设计
Plackett-Burman试验设计可以筛选出对响应值影响较大的因素[20]。本试验以花生红衣原花青素提取量为响应值,在单因素的基础上,利用Plackett-Burman试验设计筛选超声功率(A)、超声时间(B)、微波功率(C)、微波时间(D)、乙醇体积分数(E)、浸提温度(F)、料液比(G)7个因素对PSPc提取量的影响,为进一步的Box-Behnken试验奠定基础。因素及水平见表2。

表2 Plackett-Burman试验设计因素及水平Table 2 Factors and levels of Plackett-Burman test design
1.2.6 响应面试验设计
根据Plackett-Burman试验的筛选结果,选择对PSPc提取量影响最大的乙醇体积分数、微波功率、料液比3个因素作为自变量,以PSPc提取量为响应值(Y),根据Box-Benhnken中心组合试验设计原理,采用三因素三水平的响应面分析试验,优化花生红衣原花青素的提取工艺,试验因素和水平设计见表3。

表3 试验设计因素和水平Table 3 Experimental factors level
1.2.7 不同提取方法对PSPc的提取量和抗氧化活性的影响
为比较不同提取方法对PSPc提取量和抗氧化活性的影响,准确称量0.5 g花生红衣干粉4份,分别用水提法、乙醇提取法、微波辅助提取法、超声辅助提取法提取,提取工艺按1.2.2,4种不同提取法的提取条件参考超声-微波协同提取的最优条件进行设定。水提法[4]:料液比 1∶75(g/mL)、提取时间 20 min、水浴温度50℃;乙醇提取法[6]:乙醇体积分数55%、料液比为1∶37.5(g/mL)、提取时间 30 min、水浴温度 60 ℃;微波辅助浸提法[14]:乙醇体积分数70%,料液比1∶40(g/mL),微波时间 120 s,微波功率 240 W;超声辅助浸提法[5]:乙醇体积分数 70%、料液比为 1∶50(g/mL)、超声功率153 W、超声时间8 min、水浴温度60℃、水浴时间50 min。
1.2.7.1 PSPc对DPPH自由基清除能力的影响
参考王翠莲等[17]对DPPH自由基清除率的测定方法。按以下公式计算样品对DPPH自由基的清除率。
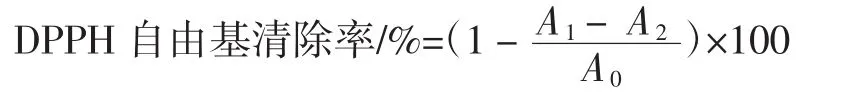
式中:A1为样品与DPPH混合液吸光度;A2为样品与无水乙醇混合液吸光度;A0为DPPH与无水乙醇混合液吸光度。
1.2.7.2 PSPc对羟自由基清除能力的影响
参考王翠莲等[17]对羟自由基清除能力的测定方法,按照以下公式计算样品对羟自由基的清除率。

式中:Ai为样品与FeSO4、水杨酸-乙醇溶液、过氧化氢溶液的混合液吸光度;Aj为样品与FeSO4、水杨酸-乙醇溶液混合液吸光度;A0为FeSO4溶液、水杨酸-乙醇溶液、过氧化氢溶液的吸光度。
1.2.7.3 PSPc对铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)值的影响
参考王翠莲等[17]对FRAP值的测定方法。精密吸取样品溶液 10 μL 和 200 μL 2,4,6-三吡啶基三嗪[2,4,6-tris(2-pyridyl)-s-triazine,TPTZ] 工作液到 96微孔板,充分混匀,37℃水浴锅加热反应40 min,于酶标仪测定吸光度,波长设置593 nm,根据标准曲线计算样品的FRAP值。
1.3 数据处理
采用Excel 2010对单因素试验数据进行处理并作图,使用SPSS单因素ANOVA检验中的最小显著差异(least significant difference,LSD)法和邓肯法进行显著性分析,显著性水平p<0.05。运用Design-Expert 8.0中的Plackett-Burman试验设计和Box-Behnken中心试验设计对试验结果进行分析并作图。
2 结果与分析
2.1 原花青素的标准曲线
原花青素提取量与吸光度之间的标准曲线如图1所示。原花青素浓度在0~20 μg/mL时,吸光度与原花青素浓度之间线性关系良好,线性方程为:y=16.65x+0.010 7(R2=0.999 1,n=3)。
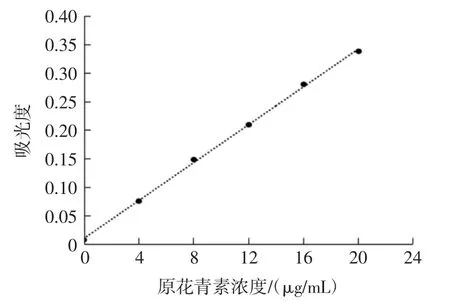
图1 原花青素的标准曲线Fig.1 Procyanidins standard curve
2.2 单因素试验
2.2.1 超声功率和超声时间对PSPc提取量的影响
超声功率和超声时间对PSPc提取量的影响见图2。
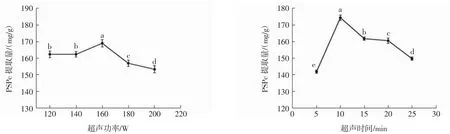
图2 超声功率和超声时间对PSPc提取量的影响Fig.2 Effect of ultrasonic power and ultrasonic time on the extraction content of PSPc
由图2可知,PSPc提取量随超声功率呈先增大后减少的趋势,在160 W时提取量最高为168.95 mg/g,并显著高于其它功率时的提取量。超声功率的增大可使花生红衣细胞破碎程度增加,有利于PSPc的溶出,使提取量逐渐增高;而随着功率继续增大,超声热效应积累的热量增多,使原花青素遇热氧化和降解,导致提取量降低[21]。由图2可知,随着超声时间延长,PSPc提取量显著增加,在10 min时为最高值174.95 mg/g,随后呈显著减少趋势。这是因为随超声时间继续延长,样品中原花青素已基本溶出,但过度超声处理会导致PSPc结构发生改变,并有其他干扰物质溶出,导致提取量降低。因此,本试验认为超声功率选择160 W,超声时间选择10 min,较为合适。
2.2.2 微波功率和微波时间对PSPc提取量的影响
微波功率和微波时间对PSPc提取量的影响见图3。

图3 微波功率和微波时间对PSPc提取量的影响Fig.3 Effect of microwave power and microwave time on the extraction content of PSPc
微波具有破坏细胞组织,加速组织内物质溶出的作用[14]。由图3可知微波功率为240 W时,提取量达最大为157.54 mg/g,之后随着功率的增大,PSPc提取量快速下降。这是因为微波功率过大,会破坏原花青素的稳定性,导致提取量的降低。在微波处理90 s时,提取液中原花青素含量最大为164.75 mg/g,随后呈下降趋势,当微波时间超过120 s后,呈显著下降趋势。这是由于一定体积溶液中PSPc的溶解度是一定的,伴随微波作用对花生红衣组织的不断破坏,使得PSPc溶解加快,开始PSPc溶解含量逐渐增加,当原花青素的溶解量已经达到最大后,继续延长时间,反而会引起溶液局部温度升高,破坏了PSPc的结构,使提取量下降[22-23]。因此,本试验中微波功率选择240 W,微波时间选择90 s,较为合适。
2.2.3 浸提温度、乙醇体积分数和料液比对PSPc提取量的影响
浸提温度、乙醇体积分数和料液比对PSPc提取量的影响如图4所示。


图4 浸提温度、乙醇体积分数和料液比对PSPc提取量的影响Fig.4 Effect of extraction temperature,ethanol volume fraction and material/liquid ratio on the extraction content of PSPc
由图4可知,当浸提温度为50℃时,PSPc提取量达到最大201.06 mg/g,然后随温度的升高,PSPc的提取量逐渐下降。温度的升高可增大溶剂分子的布朗运动,使得溶剂与PSPc相互接触更快更充分,所以浸提温度达到50℃后继续升高浸提温度,高温会破坏PSPc结构,导致PSPc提取量下降[18]。PSPc的提取量随着乙醇体积分数的增加而增加,当乙醇体积分数为70%时,PSPc提取量最高达201.32 mg/g,之后继续增大乙醇体积分数,PSPc提取量反而下降。因为不同体积分数的乙醇溶液极性不同,而PSPc具有一定极性,所以导致PSPc对不同体积分数的乙醇溶液有不同的选择性与溶解性。当料液比为1∶40(g/mL),PSPc的提取量最大。这是由于提取溶剂的增加可以溶解更多的PSPc,被提取的量也就越多;当PSPc的溶解速率达到平衡点之后,继续增加提取溶剂反而降低了提取效率,还增加提取成本,给后续的纯化工作造成不必要的麻烦。因此,本试验选择浸提温度50℃、乙醇体积分数 70%、料液比 1∶40(g/mL)。
2.3 Plackett-Burman试验结果
通过Plackett-Burman试验设计对影响PSPc提取效果的因素进行显著性分析,试验设计及结果见表4,试验结果方差分析见表5。

表4 Plackett-Burman试验方案和结果Table 4 Experimental design and results of Plackett-Burman design
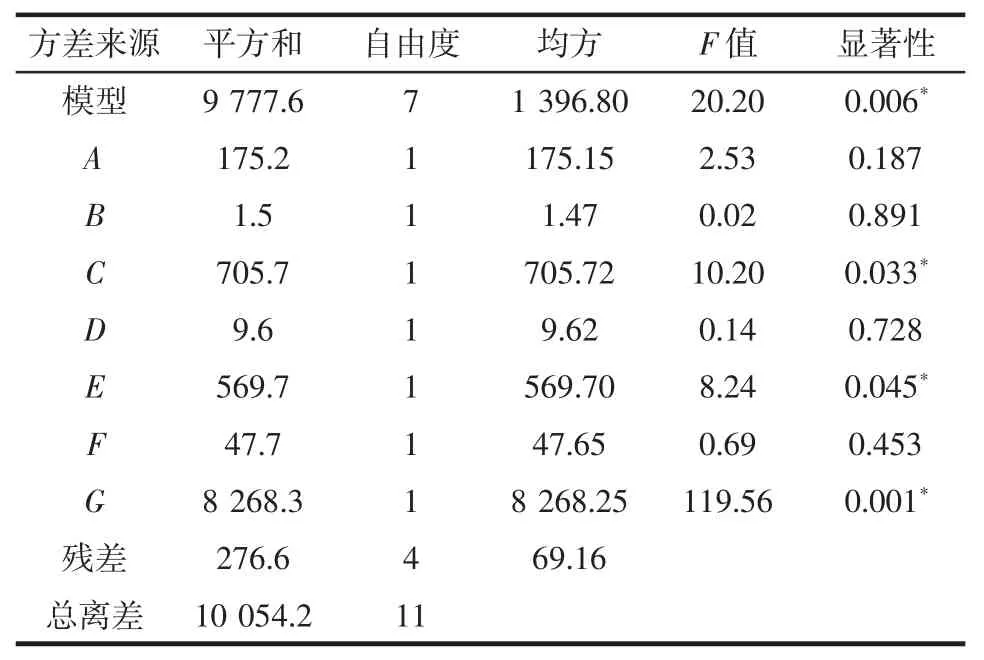
表5 Plackett-Burman模型方差分析Table 5 Analysis of variance of Plackett-Burman design
由表5 PB试验结果方差分析可知,该试验模型极显著(p<0.01)。结合单因素试验与PB试验结果可知,微波功率(C)、乙醇体积分数(E)、料液比(G)对PSPc提取量影响显著 (p<0.05),显著性大小排序为料液比(G)>微波功率(C)>乙醇体积分数(E),所以选择微波功率(C)、乙醇体积分数(E)和料液比(G)进行响应面的优化设计试验;而超声功率(A)、超声时间(B)、微波时间(D)、浸提温度(F)4个因素对原花青素提取量影响不显著(p>0.05),所以在后续试验中将其固定为160 W、10 min、90 s、50℃。
2.4 响应面试验设计及结果
响应面试验设计及结果见表6。

表6 响应面试验设计及结果Table 6 Response surface test design and results
利用Design-Expert 8.0对表6中的数据进行方差分析和回归分析,对试验结果进行拟合。以乙醇体积分数(E)、微波功率(C)和料液比(G)为自变量,拟合得到回归方程:PSPc提取量=184.20-7.67E+0.883 8C+7.47G-1.33EC+4.41EG-1.41CG-5.85E2-12.62C2+2.35G2。
回归方程的方差分析见表7。

表7 回归方程的方差分析Table 7 Analysis of variance of regression model
由表7可看出,整个回归模型极显著(p<0.000 1),相关决定系数R2=0.976 5,校正系数R2Adj=0.946 4,失拟项检验不显著(p=0.603 4>0.05),说明该模型的拟合性较好,且真实有效,能够较好地反映3个变量之间的关系。乙醇体积分数和料液比对提取量有极显著影响(p<0.01)。乙醇体积分数(E)与料液比(G)有显著交互作用(p<0.05)。
2.4.1 响应面交互作用分析
交互作用对PSPc提取量影响的响应面图见图5。
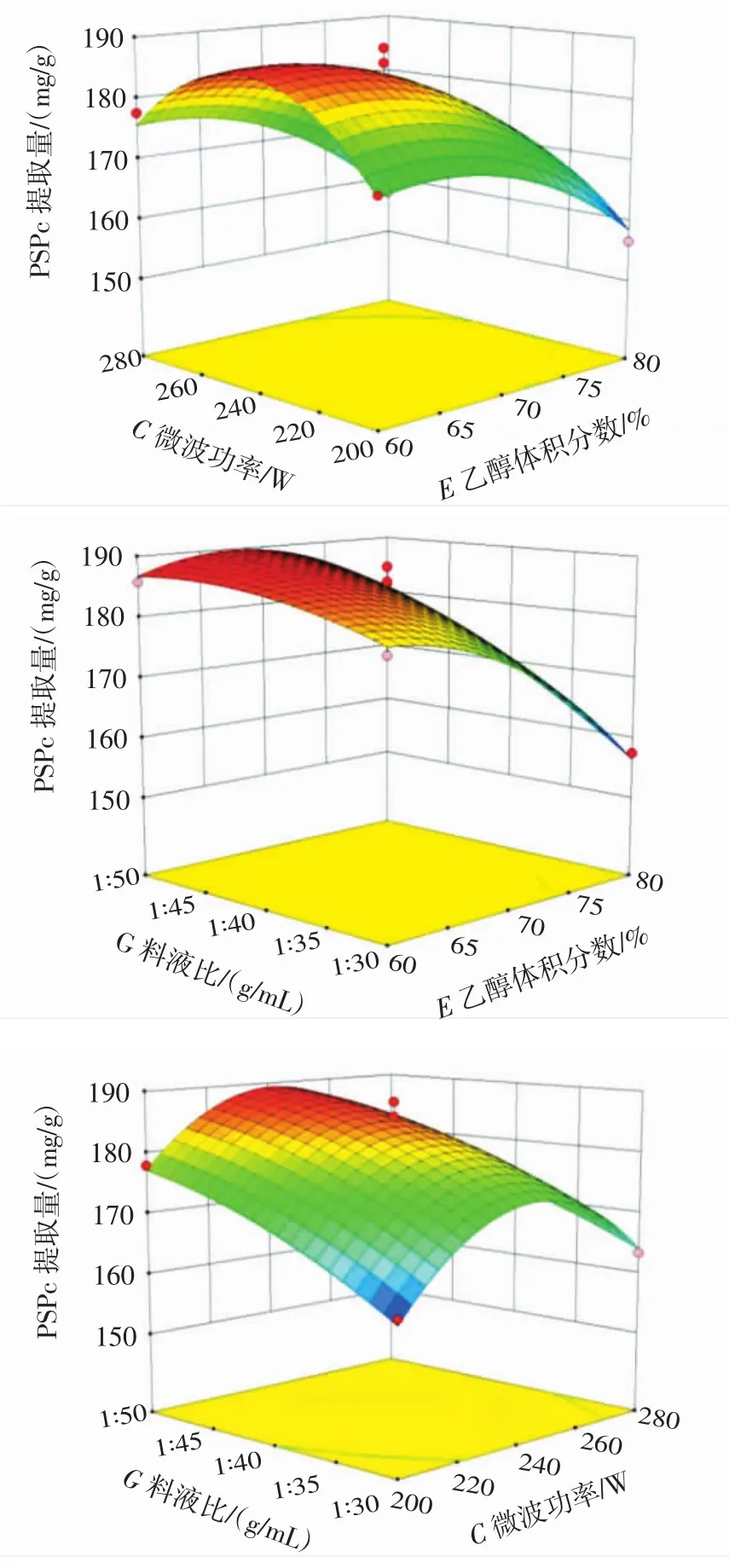
图5 交互作用对PSPc提取量影响的响应面图Fig.5 Response surface of the effect of interaction terms on extraction amount of PSPc
响应面3D曲面图反映两两因素之间对响应值的影响作用,其中3D曲面图越陡峭,说明两因素之间交互作用越明显[24]。从图5可以看出乙醇体积分数和料液比之间交互作用显著(p<0.05),其余两两因素之间交互作用不显著(p>0.05)。该结果与方差分析结果一致。
2.4.2 最优提取工艺参数及验证
通过利用Design-Expert 8.0设计分析得到的超声-微波协同提取原花青素最佳工艺为提取方案为乙醇体积分数68.75%、微波功率241.17 W、料液比1∶39(g/mL),预测 PSPc提取量为 189.59 mg/g。结合实际操作,修正为:乙醇体积分数70%、微波功率240 W、料液比 1∶40(g/mL)。此时 PSPc提取量为 186.38 mg/g,相对标准偏差为1.7%,说明模型有效。
2.5 不同提取方法对PSPc提取量及其抗氧化性的影响
不同提取方法对PSPc的提取效率和生物活性会产生不同的影响[25],对提取产物中PSPc的提取量和抗氧化性进行了分析,结果如表8所示。

表8 提取方式对PSPc提取量和抗氧化性影响Table 8 The effect of extraction method on PSPc content and oxidation resistance
从表8可以看出,超声波辅助提取法的PSPc提取量最低为90.46 mg/g,超声-微波协同提取的效率最高,PSPc提取量高达186.38 mg/g,显著高于微波辅助提取法、超声波辅助提取法和溶剂提取法(p<0.05)。
水浴提取的PSPc羟自由基清除率、DPPH自由基清除率和FRAP值,均显著低于其它几种提取方式(p<0.05);微波辅助提取PSPc的DPPH自由基清除率和FRAP值,均显著高于其它几种提取方式(p<0.05);超声-微波协同提取PSPc的DPPH自由基清除率显著高于超声波水浴法,FRAP值显著高于超声波法、水浴法、超声波水浴法和乙醇法。综上表明,超声-微波协同提取法在获得PSPc最大提取量的同时,还具有较好的抗氧化活性。因此,超声-微波协同提取PSPc是一种较好的提取方法,可以为PSPc的工业化应用提供一种新的提取思路。
3 结论
本研究综合单因素试验、Plackett-Burman试验设计,筛选出对PSPc提取具有显著影响的因素,在此基础上用Box-Behnken试验设计对超声-微波协同提取PSPc的工艺进行优化研究,得出超声-微波协同辅助乙醇提取PSPc的最佳工艺为:超声功率160 W、超声时间10 min、微波功率240 W、微波时间90 s、乙醇体积分数70%、浸提温度50℃、浸提时间20 min、料液比1∶40(g/mL)。在此条件下,原花青素的提取量可达到186.38 mg/g,同时,优化后的超声-微波协同提取量显著高于其他方法(p<0.05),且有较好的抗氧化活性。该研究可以为花生红衣中提取原花青素提供一定的理论参考。

