黄土高原土壤中细菌在侵蚀和沉积干扰下的群落分布特征
钟仁华, 黄彩虹, 彭诗阳, 蔡红春, 朱 娟, 张燕茹
(1.湖南鑫恒环境科技有限公司, 湖南 长沙 410000; 2.湖南鑫恒生态研究院有限公司, 湖南 益阳 413002;3.湖南省林业科学院, 湖南 长沙 410004)
由于长期耕作和低植被覆盖,中国黄土丘陵沟壑区成为世界上最脆弱的地区之一,土壤抗侵蚀能力较差[1]。该地区的加速侵蚀不仅对粮食安全和生态系统构成持续威胁[2],而且还影响陆地生态系统的碳循环[3]。随着对土壤侵蚀与碳动态关系的研究不断深入[3-5],土壤侵蚀是碳汇还是碳源的争议越来越大。一些研究认为,由于侵蚀土壤净初级生产力的减少和重新分配的有机碳的高矿化率,侵蚀是碳源[6]。相反,其他研究认为,有机质在沉积地点被深埋,因此,侵蚀可以防止有机质加速矿化,降低有机质的周转率[7]。
土壤中微生物的呼吸和分解过程作为有机碳返还大气碳库最主要的生物过程,每年产生的碳排放量为27~45 PgC,占陆地生态系统向大气返还碳量的一半以上[8]。因此,要科学的评价并预测侵蚀扰动对土壤碳库源汇效应的影响,需要探明土壤微生物与有机碳循环之间的相互作用机制。除此之外,土壤微生物多样性作为土壤生态系统稳定性的关键生物学指标,可以对土壤环境的细微变化做出反应[9]。土壤的侵蚀—沉积扰动对土壤微生物群落结构有显著的影响,尤其是土壤中养分的流失会对微生物生命活动产生负面影响,且有研究证明有机质矿化主要受微生物群落控制[10]。侵蚀可以显著改变土壤理化性质,尤其是坡面有机碳含量[11],进而微生物群落可能会对这种干扰作出反应[12]。有研究表明,侵蚀使坡面表层土壤的细菌和真菌数量发生显著改变[13];还有研究发现雨水侵蚀过程中,坡面土壤细菌丰度和真菌丰度显著下降,尽管不同微生物群落对土壤理化性质(如pH 值和水分含量)的变化反应存在差异,但其变化特征与土壤理化性质的变化之间存在密切关系[14]。
现有研究大都集中在土壤侵蚀造成的养分损失、径流损失、泥沙损失和土壤碳循环之间的关系上[15-16],对于侵蚀扰动如何对微生物群落的分布特征造成影响,在多大程度上改变了微生物的群落构成以及微生物如何响应侵蚀扰动进而影响有机碳循环等问题尚不明晰[10],土壤环境因子与微生物之间的联系也不明确。为了解释土壤微生物在侵蚀扰动下全球碳循环中的作用,现阶段的研究多采用生态地貌学和地貌学相结合的方法。这种方法涉及生物圈、地貌和陆地表面或附近的地貌过程之间的相互作用。
综上,为探究侵蚀扰动对土壤中细菌群落特征的影响,本研究以黄土高原典型侵蚀坡面为研究对象,在不同类型的侵蚀坡面上设置了侵蚀—沉积点,通过Illumina-MiSeq测序平台分析了不同侵蚀—沉积坡面中土壤细菌的群落构成,并且对土壤理化参数与细菌群落之间的关系加以分析,以期为土壤侵蚀扰动导致碳循环的微生物机制提供科学参考。
1 研究区概况
甘肃省天水市水土保持局桥子沟流域(105°30′—105°45′E,105°30′—105°45′N)位于黄土高原中部,属于典型的丘陵沟壑区,季风和半干旱气候是其主要的气候类型,海拔1438m,年平均气温10.7℃,降水量548.9mm,雨季为7—9月。降雨是该地区土壤侵蚀的主要自然驱动力[17],也是侵蚀场地与沉积场地差异的主要原因。年平均侵蚀率范围为1599.50~2877.76 t·km-2[18],年产沙量为2026Mg· km-2[19]。主要土壤类型为黄土、红土和河湖冲积土。
2 材料和方法
2.1 试验设计与样品采集
试验地点选择了两种土地利用方式下的侵蚀坡地,分别是由刺槐覆盖的林地坡地和由小冠花覆盖未开垦坡地。研究区面积分别为0.23km2和0.21km2。两个研究地斜坡相隔1.65km。本研究将研究区划分为4个采样点:未开垦的斜坡侵蚀点(uncultivated erosional site, UE)、未开垦的斜坡沉积点(uncultivated depositional site, UD),刺槐侵蚀点(Robiniapseudoacaciaerosional site, RE)和刺槐沉积点(Robiniapseudoacaciadepositional site, RD)。两个坡面均呈“S”型,平均坡度为 12°。
在采集土壤样本之前,清除了石块、生物结皮和表层土壤的可见植物残留物(约1cm)。用内径为5cm 的土壤螺旋钻在4个采样点(40m×40m)的顶部10cm范围内采集土壤样本,每个重复为 5 个钻随机土样的混合样,每个处理下取3个平行样。采集后的土壤样本存于自封袋中低温运输。在进行分子生物学分析之前,将一部分样品冷冻干燥并保存在50ml无菌离心管中,温度为-80℃。剩余的土壤样品自然风干并通过0.25mm的筛子以测量理化性质。
2.2 土壤理化性质测定
用超纯锂漂移锗探测器和DSPEC多通道γ射线分光光度计(GMX50,PerkinElmer,USA)测量137Cs活性。用661.6 kev的峰面积计算137Cs含量。使用激光粒度仪测定土壤颗粒组成[20]。采用1∶2.5(w/v)的土水比提取液测定土壤pH值。根据样品体积和烘干重量计算土壤容重。采用重铬酸盐氧化法测定土壤有机碳含量(Soil Organic Carbon, SOD)。使用总有机碳分析仪(TOC-VCPH,日本岛津)测定土壤溶解有机碳(Dissolved Organic Carbon, DOC)。分别采用凯氏定氮法、NaOH熔融比色法和NaOH熔融火焰光度法测定总氮(total nitrogen, TN)、总磷(total phosphorus, TP)和总钾(total potassium, TK)。用碱水解扩散法测定土壤有效氮(available nitrogen, AN)。用Mo-Sb比色法定量速效磷(olsen phosphorus, OP)。用火焰光度法测量有效钾(available potassium, AK)。
2.3 微生物总 DNA 的提取、PCR扩增和 Illumina 测序
土壤样品DNA采用E.Z.N.A.土壤DNA试剂盒(Omega Bio-tek,Norcross,GA,USA)提取,具体提取方法参照该试剂盒说明书。对 16S rDNA 基因的 V3-V4 区进行PCR扩增,每个样品3个重复,细菌扩增引物采用338 F 5′-条形码-ACTCCTACGGGGAGGAGCAG-3′和806R 5′-GGACTACHVGGWTCTAAT-3′[21]。20 μL的PCR反应体系包括有4 μL 5×快速Pfu缓冲液、2 μL 2.5 mM脱氧核苷酸三磷酸(dNTPs)、0.8 μL每个引物(5 μM)、0.4 μL快速Pfu DNA聚合酶和10 ng模板DNA,最后用ddH2O补足20 μL。PCR扩增产物一式三份。使用ABI GeneAmp®9700(美国)进行PCR扩增。对PCR的产物进行纯化回收,使用QuantiFluor DNA 检测试剂盒对回收的 DNA进行精确定量。最后根据测序平台要求,对 DNA 进行相应比例的混合后上机测序( Illumina Miseq TM)。
2.4 数据处理与分析
高通量测序数据预处理: 首先去除引物接头序列,使用QIIME(版本1.91)对原始的FASTQ文件进行解复用和质量过滤,得到有效序列。利用UPARSE(版本9.2)去除非特异性扩增序列及嵌合体后,97% 相似度水平筛选操作分类单元(OTU)[22]。经过Silva 数据库比对,获取OTU 聚类中丰度最高的作为代表性序列。采用Mother软件进行Chao1、ACE、香农指数(Shannon)和辛普森指数(Simpson)等计算分析。利用UniFrac计算微生物β多样性数据并通过群落生态学软件包R-forge进行主坐标分析(PCoA)[23]。使用SPSS (版本19.0)对数据进行单因素方差分析,并对OTU丰度及土壤主要理化因子进行Pearson相关性分析,其显著性水平均设为P<0.05。土壤理化性质参数作图和微生物群落结构组分图采用Origin (版本8.5)软件绘制。所有原始序列都保存在GenBank中,数据编号为PRJNA350577。
3 结果与分析
3.1 侵蚀—沉积作用对4个实验样点土壤理化性质的影响
表1总结了所研究土壤样品的基本物理化学性质。137Cs作为一种成熟的土壤侵蚀示踪剂,通过比较试验地点和参考样地的137Cs含量,来确定侵蚀和沉积作用的发生。结果显示,137Cs在侵蚀—沉积坡面不同位点上存在显著的分异特征。将4个实验样点土壤中的137Cs浓度与背景值(1400.682 ± 449.498 1 Bq·m-2)进行比较,UE和RE的137Cs浓度分别为711.48 Bq·m-2和84.24 Bq·m-2,均显著低于参考值,有明显被侵蚀现象。以沉积为主的UD和RD样地137Cs浓度分别为1502.82 Bq·m-2和1545.34 Bq·m-2,均显著低于参考值,发生明显沉积作用。在水力侵蚀作用下,降雨径流可将侵蚀区的土壤颗粒及其吸附的137Cs搬运至沉积区,从而导致了137Cs在坡面上的再分布。137Cs在侵蚀区中的浓度低,证明侵蚀区土壤损失严重;而沉积区137Cs的浓度相对较高,土壤发生了相对堆积或净堆积。刺槐坡面的pH值整体低于未开垦坡面(P< 0.05),然而侵蚀扰动没有对未开垦坡面侵蚀和沉积区的pH值造成影响,UE和UD点土壤pH值无显著差异。4个实验样点的土壤含水率和容重数值相近,均无显著差异。

表1 4个实验样点土壤样品的背景值Tab.1 Background values of soil samples at four experimental sites采样点137Cs/(Bq·m-2)含水率 /%容重/g·cm-3pH值UE711.4813.20(0.20) a1.17(0.07) a8.69(0.03) aUD1 502.8213.17(0.48) a1.28(0.03) a8.71(0.02) aRE841.2413.04(1.39) a1.26(0.04) a8.44(0.02) bRD1 545.3412.07(0.67) a1.22(0.16) a8.35(0.04) c 注: 同列不同小写字母表示在P<0.05水平差异显著。
在养分含量方面,UE的有机碳含量(7.29 g·kg-1)显著低于UD的有机碳含量(7.91 g·kg-1),同时RE的有机碳含量(8.10 g·kg-1)也显著低于RD土壤有机碳含量(8.94 g·kg-1)。类似的,侵蚀扰动对可溶性有机碳浓度也造成了影响。沉积区的可溶性有机碳浓度(UD 38.62 g·kg-1;RD 37.15 g·kg-1)均显著高于侵蚀区(UE 36.38 g·kg-1;RD 36.35 g·kg-1)。侵蚀对于土壤中碳含量的影响较为明显。同一坡面的侵蚀区和沉积区的TN、TK或AN含量均未发现显著差异(图1)。在刺槐坡面上,RE的TP浓度(0.82 g·kg-1)显著低于RD的TP浓度(0.84 g·kg-1),而在未开垦的坡面,侵蚀区(UE)和沉积区(UD)的TP含量无明显差异。UD的 OP含量(3.77 mg·kg-1)显著低于UE(4.80 mg·kg-1),而UD的AK含量(259.41 mg·kg-1)高于UE(211.35 mg·kg-1)。在刺槐坡面上,TP和OP的浓度在RE和RD部位无明显差异。
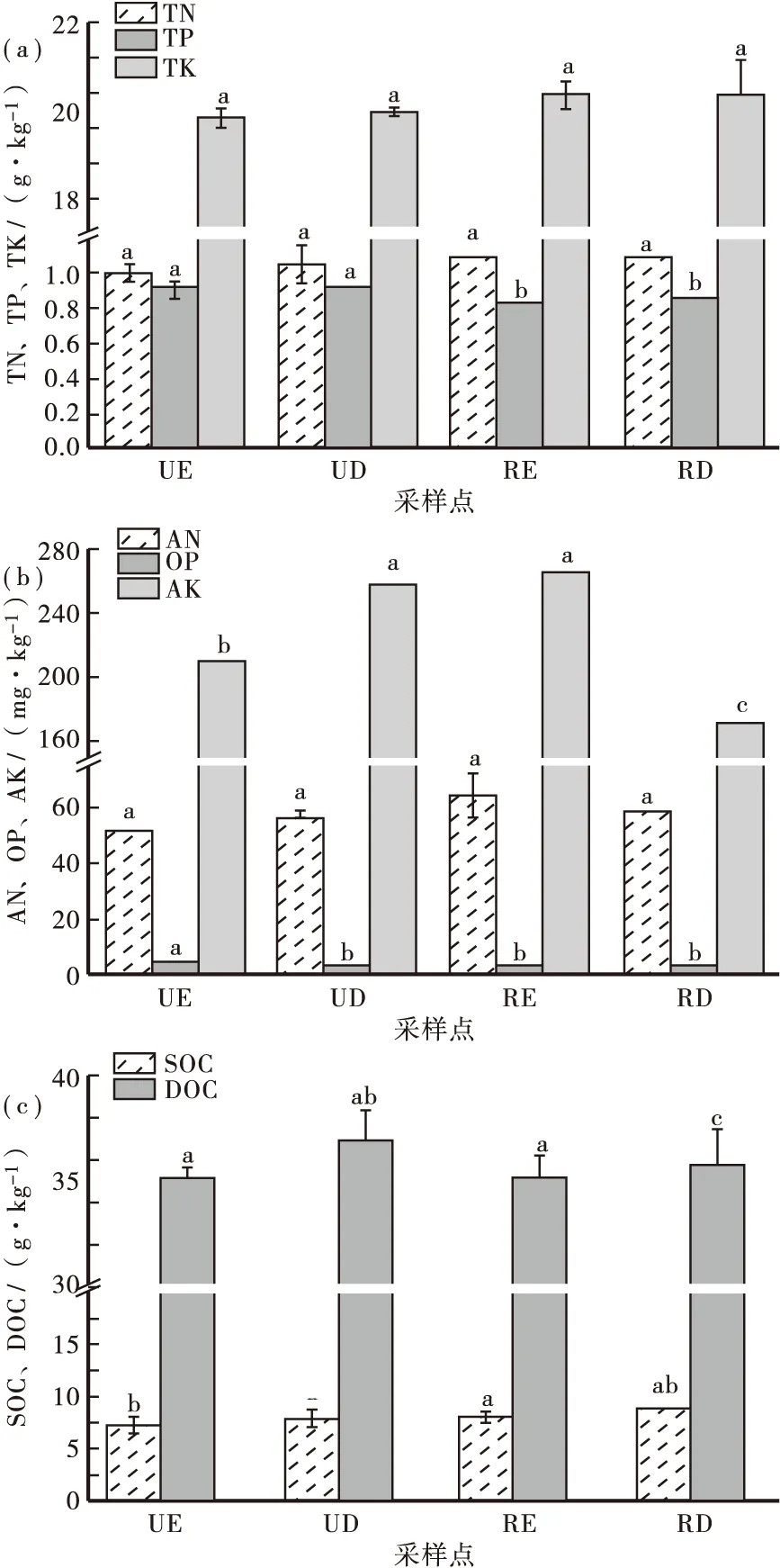
图1 4个实验样点土壤的养分含量Fig.1 Nutrient content of soil samples at four experimental sites
3.2 土壤细菌的测序结果、多样性和丰度
表2给出了测序信息,包括样本覆盖率和α多样性指数。所有样品的覆盖率均达到98%以上,表明该序列的结果准确地描述了样品中微生物的情况。共从4个样品中提取了426370个16S rRNA基因的有效序列。在UE、UD、RE和RD 4个实验样点分别检测到2105、2174、1526和1582个细菌的OTU。覆盖率是指对各类文本库的覆盖率。覆盖率的值越大,在样本中测量序列的概率就越大。通过计算α多样性指数,可以探究土壤样品的细菌物种丰富度和多样性(表2)。总的来说,同一坡面的侵蚀区和沉积区土壤细菌Shannon指数、Simpson指数、均匀度指数(ACE)和物种丰富度指数(Chao1)在3%的临界值下存在着显著差异(P< 0.05)。此外,刺槐坡面细菌多样性和丰富度明显低于未开垦坡面(P<0.01)。

表2 4个实验样点的MiSeq测序结果和α多样性指数Tab.2 MiSeq sequencing results and α diversity index of four experimental samples样点有效序列读长OTU物种丰富度物种多样性ACEChao1ShannonSimpson覆盖率/%UE174 064115 1062 1052 143 a2 158 a6.43 a0.004 4 a99.91UD179 429129 7162 1742 207 ab2 214 ab6.41 b0.004 4 b99.93RE139 35611 2261 5261 727 b1 737 b5.73 ab0.014 8 ab99.05RD133 52110 9781 5821 773 c1 786 c6.01 c0.010 4 c98.97
3.3 不同分类水平土壤细菌的组成
将得到的16S rRNA基因序列分进行不同水平分类学注释,以探讨微生物群落构成在侵蚀—沉积扰动下的动态变化。在门水平上的细菌群落相对丰度如图2a所示。结果显示,4个实验样地土壤中共鉴定出11个已知菌门。其中变形杆菌门、放线杆菌门和嗜酸杆菌为优势门,其相对丰度范围分别为24.45%~31.06%、19.61%~30.06%以及8.71%~15.14%。厚壁菌门为次要门,其相对丰度分为6.12% ~10.76%。为了更深入探究不同样地土壤的细菌构成,分析了细菌在属水平上的群落构成。在所有土壤样品中,16S rRNA基因序列鉴定出463个属。在不同坡面上,细菌的优势属发生了变化。在刺槐坡面上,Bacillus占优势,相对丰度范围在2.91%~7.70%,其次为Gemmatimonadaceae_uncultured,相对丰度占总属数的3.27%~5.17%。在未开垦的坡面上,Subgroup_6_norank为优势属,占2.05%~7.81%,其次为Bacillus和Gemmatimonadaceae_uncultured。侵蚀区的优势细菌属相对丰度均高于沉积区。
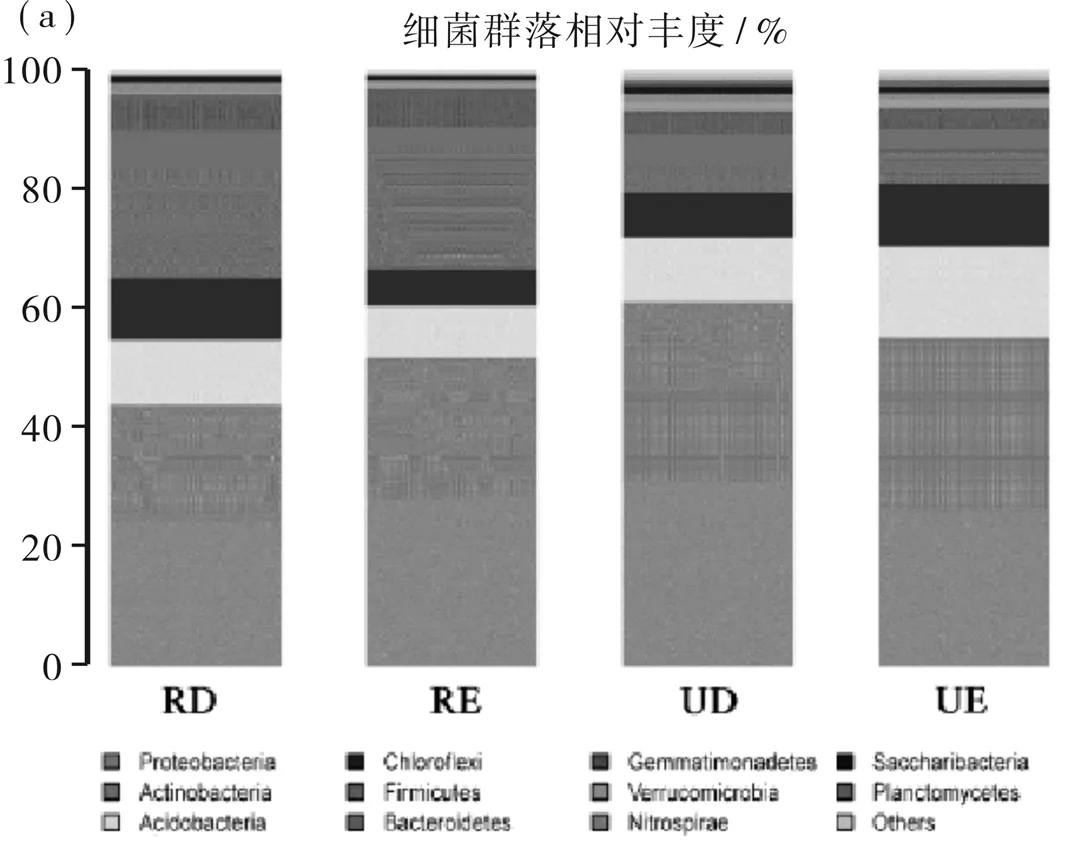
图2 4个实验样点细菌在门和属分类学水平上的物种相对丰度
3.4 土壤全菌和自养菌群落比较
基于定量非加权UniFrac度量的主成分分析(Principal Co-ordinates Analysis,PCoA)揭示了4个实验样点土壤细菌群落结构的差异。如图3所示,第一轴显示细菌群落构成的累积变化量为70.09%,第二轴显示为24.49%。总的来说,横纵坐标共解释了细菌群落组成变化的94.28%。PCoA结果表明,UE和UD的细菌群落构成较为相似,而RE和RD的细菌总数不同。

图3 基于Unifrac距离对4个实验样点土壤细菌群落结构的主坐标分析(PCoA)Fig.3 Principal Coordinate Analysis (PCoA) of soil bacterial community structure at four experimental sites based on unifrac distance
此外,基于属水平的聚类热图(图4a)和多样本相似性发育树分析(图4b)结果显示,4个实验样地中的细菌菌群可分为两类:一类是未开垦坡面菌群;另一类是刺槐菌群。这两类菌群的系统发育树之间有明显的分离,这表明两个坡面的细菌群落结构存在明显的差异。同一坡面上的细菌群落结构也存在差异性。

图4 4个实验样点中细菌群落的层次聚类分析Fig.4 Hierarchical cluster analysis of bacterial communities in four experimental sites
3.5 细菌群落与土壤理化性质的关系
本研究计算了14个环境因子与前50个细菌OTU之间的相关性,热图(图5)直观的显示出了数据之间的相关性。根据正相关和负相关,环境因子的聚类分析可分为两类:第一类为土壤有机碳、粉土和粘粒含量、TK、TN和AN;第二类为土壤pH值、含砂量、TP、OP、AK、DOC、含水量和容重。两个环境因子集群对同一细菌OTU表现出相反的相关性。例如,OTU2157和OTU1414是所有土壤样品中细菌总数的主要OTU。第一类环境因子与这两个显性OTU呈正相关,第二类环境因子则与这两个OTU呈负相关。第一类因子与其余48个OTU呈负相关,第二类因子与之呈正相关。其中,土壤pH值、TP和OP与细菌大部分OTU呈正相关。同时,在这种动态环境中,土壤总养分(TK和TN)可能对细菌总数的OTU产生负面影响。此外,含砂量、土壤含水量、容重、DOC和AK呈不显著正相关。土壤有机碳、AN和粘粒含量与细菌OTU呈负相关,但不显著。

图5 细菌前50位OTU与土壤理化性质的相关性热图Fig.5 The correlation heat map between the top-fifty OTUs of bacteria and the physical and chemical properties of soil
4 结论与讨论
(1)137Cs浓度在侵蚀区土壤中较低,反映出土壤发生流失现象。侵蚀区土壤颗粒及其吸附的137Cs在水力侵蚀的作用下,随雨水径流向沉积区迁移,导致137Cs在坡面上重新分布[24-25]。侵蚀点和沉积点的大部分养分含量(如TN、TK、TP和AN)在同一坡面中没有显著差异。这些结果可能是因为横截面结构是以粉土为主,养分含量普遍较少,并且土壤侵蚀不会引起土壤质地显著变化。此外,侵蚀区植被恢复减少了养分的流失,这可能解释了同一坡面上部分养分含量差异不显著的原因。
(2)土壤侵蚀过程是一个选择性搬运过程,会影响土壤理化特性和生物属性。有研究发现,在内蒙古皇甫川流域不同侵蚀—沉积扰动下,原生环境中的总土壤微生物丰度是水力侵蚀环境的 5.08 倍,其中细菌、放线菌和真菌的丰度在未侵蚀区分别是侵蚀区的 4.9 倍、8.1 倍和 2.5 倍[26],由此证明侵蚀扰动会削减土壤微生物丰度和多样性。在本研究中,在两个研究坡面中,侵蚀区的多样性指数相比沉积区均有所下降,侵蚀过程对微生物多样性的影响是不利的。此外,在本研究中,未开垦坡地细菌群落的丰富度和多样性均高于开垦坡地。这有可能是由于两坡面覆盖有不同的植被造成的。大多数土壤微生物是异养微生物,利用植物分泌物或分解植物材料作为能源[27]。植物凋落物落到土壤表面,经自然因素(如降水)淋滤后,简单组分发生分解和转化。这一过程影响土壤温度、含水量、光照和营养特性,从而改变微环境,进而改变了微生物的群落和功能[28]。
(3)为了确定4个实验地点自养和总细菌群落结构的相似性和差异性,本研究采用了PCoA、微生物群落热图和多样本相似树分析。结果表明,在同一坡面上,侵蚀区和沉积区的微生物群落构成较为相似,即侵蚀—沉积作用并没有或不足以导致微生物群落组成和功能多样性的改变,这可能是由微生物对侵蚀环境敏感的响应和反馈机制决定的。一方面,同一坡面土壤理化性质变化不明显,同一坡面对于土壤微生物是一个相对稳定的环境;另一方面,侵蚀和沉积场地在同一斜坡上有相同类型的土壤。这意味着土壤微生物群落结构受土壤类型的影响很大,但土壤类型在侵蚀扰动下变化不明显。
(4)土壤微生物群落与土壤理化特性密切相关[29-30]。在坡面侵蚀扰动下,土壤微生物分布特征的变化受到土壤 pH 值、含水率、有机碳组成及含量等多种环境因子的影响,这些影响因素在不同的季节和气候类型下可能对微生物群落构成产生不同的主导作用。本研究中,部分土壤理化性质(包括pH值、全氮和粘粒含量)与细菌呈显著正相关。总氮通过影响有机碳和pH值的有效性在一定程度上影响微生物群落,进而影响生物量[31]。土壤微生物随着有机碳水平的变化表现出不同的代谢活性和碳源利用能力[32]。

