基于高通量测序的雪茄烟微生物群落结构和多样性分析
叶长文,李 璐,贺 琛,李 栋,陈连芳,范 黎,陈 宸,魏雪团*
1.中国烟草总公司郑州烟草研究院,郑州高新技术开发区枫杨街2号 450001
2.华中农业大学食品科学技术学院,武汉市洪山区狮子山街1号 430070
雪茄烟是一种传统的烟草制品,通常以晾晒烟叶为原料,经多次发酵达到雪茄烟特殊的吸食品质。在发酵过程中微生物起着至关重要的作用[1-2]。李宁等[3]、杜佳等[4]采用传统的分离培养鉴别法,分别对雪茄烟叶叶面和茄衣发酵过程中微生物区系的变化进行了研究,发现在发酵过程中细菌为主要微生物,真菌含量较少,其中芽胞杆菌属为优势菌群。由于传统分离培养技术本身的局限,即使选择多种培养基和分离条件,也仅能从样品中分离出少量优势菌群,不能全面反映其微生物群落的真实组成[5-8]。近年来,基于细菌16SrRNA基因及真菌rRNA基因间隔区(Internal transcribed spacer,ITS)区域的高通量测序技术已广泛用于微生物多样性分析。该方法不仅省去了传统分离培养法的繁琐过程,并且为大量未培养微生物的研究提供了有效手段,促使烟草微生物多样性和优势菌群研究取得了新进展[5-11]。张鸽等[8]采用高通量测序和传统分离2种方法对比分析雪茄烟茄衣原料表面细菌的多样性及不同发酵时期的演替,证实了高通量测序法可更全面揭示微生物的多样性和演替规律。
由于雪茄烟叶原料、发酵工艺和生产环境等因素不同,各地区生产的雪茄烟中微生物种类组成可能存在较大差异。微生物群落的差异可能影响雪茄烟的发酵过程,进而影响雪茄烟产品品质。目前,基于高通量测序技术对比分析不同雪茄烟成品微生物群落结构和多样性的研究尚未见报道。因此,通过高通量测序分析技术对细菌16S rRNA和真菌ITS基因进行扩增及测序,对比分析国内外雪茄烟的微生物群落多样性,旨在更加准确、全面地掌握其菌群结构,明确优势菌群,为提高雪茄烟产品质量和吸食品质,并为后续雪茄烟生产工艺的改良提供参考。
1 材料与方法
1.1 实验材料
10个雪茄烟样品均从市场直接购买,其中1#~7#样品为国产雪茄烟,8#~10#样品为进口雪茄烟,样品编号、产地国、烟支规格、茄芯形态和卷制工艺等具体信息见表1,涵盖了国内4个雪茄烟厂及国外主流品牌的产品,卷制工艺包括手工卷制、半机制和机制等3种方式。

表1 10个雪茄烟样品信息表Tab.1 Information of 10 cigar samples
1.2 实验方法
1.2.1 基因组DNA的提取和PCR扩增
使用无菌剪刀将雪茄烟样品剪碎,根据E.Z.N.A.®soil DNA kit(美国Omega Bio-tek公司)说明书对样品中微生物总DNA进行抽提,并利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的DNA提取液于离心管中,使用无菌水稀释至1 ng/μL,各样品做3个生物学重复。
选用Phusion®High-Fidelity PCR Master Mix with GC Buffer(美国New England Biolabs公司)和高效高保真酶进行PCR扩增,PCR扩增区域、所用引物及序列信息见表2。

表2 PCR扩增区域、所用引物及其序列信息表Tab.2 Information of PCR amplification regions,primers and sequences
1.2.2 PCR产物的混样和纯化
使用2%浓度(质量分数)的琼脂糖凝胶对PCR扩增产物进行电泳检测,根据电泳检测结果将PCR产物调节为相同浓度,充分混匀后使用2%的琼脂糖凝胶电泳分离PCR产物,再用GeneJET胶(美国Thermofisher Scientific公司)剪切回收目标条带。
1.2.3 文库构建和上机测序
使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒(美国Thermofisher Scientific公司)进行文库构建,构建好的文库经过Qubit定量和文库检测合格后,使用Ion S5TMXL测序平台(美国Thermofisher Scientific公司)进行上机测序。测序工作委托北京诺禾致源科技股份有限公司进行。
1.2.4 测序数据处理
使用Cutadapt软件(V1.9.1,http://cutadapt.readthedocs.io/en/stable/)先对原始序列(Reads)进行低质量部分剪切,再根据Barcode从得到的Reads中拆分出各样品数据,截去Barcode和引物序列初步质控得到原始数据(Raw reads)。经过以上处理后得到的Reads需要进行去除嵌合体序列的处理,Reads序列通过UCHIME Algorithm与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据(Clean reads)。
1.2.5 数据分析
对有效数据在97%水平上进行操作分类单元(Operational taxonomic unit,OTU)聚类,并利用Greengene数据库进行物种注释。通过对OTU进行丰度、α多样性以及物种在各个分类水平上的群落结果统计分析,得到微生物群落结构组成,并分别利用Shannon指数、Chao1指数、ACE指数和Coverage指数公式计算细菌生态多样性指数;利用Excel 2013做柱形图;利用HemI(Heatmap Illustrator,version 1.0)做热图;利用SPSS 17.0做统计分析。
2 结果与分析
2.1 16S r RNA和ITS序列丰度分析
对10个雪茄烟样品中的微生物进行Illumina MiSeq高通量测序,分别得到2 085 050条和2 354 038条高质量的16S rRNA序列和ITS序列(Clean Reads),平均每个样品分别高达69 502条和78 468条,所得的ITS序列数目稍高于16S rRNA。通过绘制稀释曲线发现,10个样品的稀释曲线在97%相似性水平下已趋于平坦,虽未达到完全饱和,但可涵盖样品中绝大多数微生物物种,基本能反映所测雪茄烟样品的细菌和真菌微生物群落组成。
2.2 α多样性分析
在97%分类水平上,雪茄烟样品微生物的α多样性指数如表3所示。所有样品微生物Coverage指数均大于0.99,说明样品文库中序列基本上都被测出,即样品测序结果可反映样品的真实情况。
从表3中10个样品的细菌和真菌多样性分析结果可见,不同样品细菌和真菌的多样性存在较大差异。对于细菌的α多样性,CCSS样品中的微生物Shannon指数、Chao1指数和ACE指数在所有的雪茄烟样品的微生物中均为最低,且OTU数量也最少,表明CCSS样品中的细菌物种最少,物种丰富度最低。而HNL9样品中的微生物Chao1指数、ACE指数与OTU数量均是最高的,Shannon指数也较高,说明HNL9样品中的细菌群落多样性最为丰富。
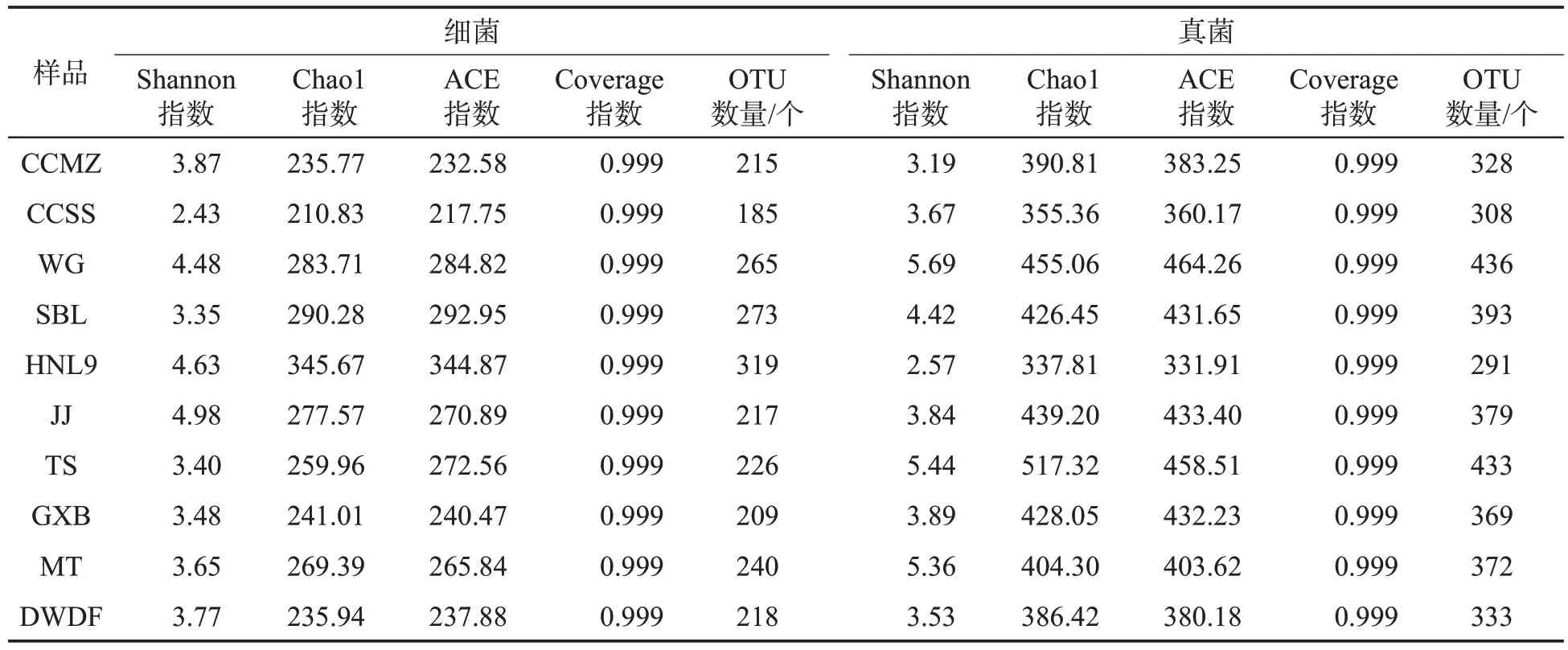
表3 雪茄烟样品中细菌和真菌多样性指数及检测的OTU数量Tab.3 Index of bacterial and fungal diversities in cigar samples and number of OTUs detected
对于真菌的α多样性,由表3可知,HNL9样品的Shannon指数、Chao1指数、ACE指数和OTU数量在所有雪茄烟样品的微生物中均为最低,说明HNL9样品中真菌群落多样性和丰富度是最低的,而细菌群落多样性结果在10个样品中则是最高的。此外,在10个雪茄烟样品的微生物中,WG样品中的微生物Shannon指数和ACE指数均为最高,表明WG样品的真菌群落多样性和丰富度最高,其OTU数量也印证了该结论。TS样品的Chao1指数为517.32,在所有的雪茄烟样品的微生物中是最高的,其OTU数量达到433个,仅次于WG样品,说明TS样品的真菌群落多样性也较为丰富。
2.3 细菌群落结构分析
对10个雪茄烟样品中微生物的细菌群落组成进行了分析,共检出36个细菌门和360个细菌属。表4列举了10个雪茄烟样品中的细菌在各分类水平的种类数目,其中HNL9样品中的细菌在各分类水平的种类数量均为最高,这也印证了16SrRNA序列丰度分析和α多样性分析结果。

表4 雪茄烟样品中细菌在各分类水平的种类数量Tab.4 Number of species of each bacterial classification in cigar samples (个)
10个样品细菌群落在门分类水平上的分布见图1。10个样品中平均相对丰度大于1%的细菌门有4个,分别为厚壁菌门(Firmicutes,6.86%~67.42%),变 形 菌 门(Proteobacteria,3.39%~61.25%),放 线 菌 门(Actinobacteria,2.52%~34.20%)和 拟 杆 菌 门(Bacteroidetes,0.17%~4.04%)。其中,厚壁菌门在TS,GXB,MT和DWDF样品中的相对丰度均大于50%,变形菌门在JJ样品中的相对丰度也超过了50%。在门水平上将各样品的微生物组成进行对比分析,平均相对丰度大于1%的细菌门类中各样品间的微生物组成相同,但各门类间的相对丰度具有一定的差异,其中3个国外雪茄烟中厚壁菌门细菌丰度明显高7个国产雪茄烟。
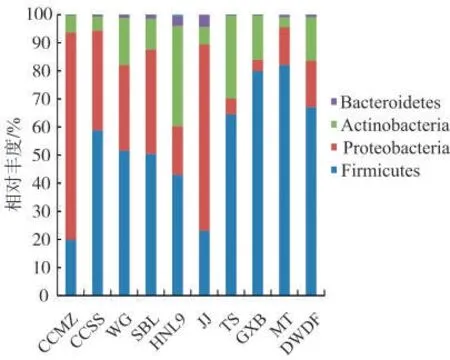
图1 雪茄烟样品中主要细菌门的相对丰度Fig.1 Relative abundances of major bacterial phyla in cigar samples
在属分类水平下,图2列举了10个样品平均相对丰度前20的细菌属,其中平均相对丰度大于1%的细菌属有7个,分别是葡萄球菌属(Staphylococcus,1.12%~57.68%),不动杆菌属(Acinetobacter,0.28%~39.32%),假 单 胞 菌 属(Pseudomonas,0.62%~18.20%),气 球 菌 属(Aerococcus,0.16%~19.57%),鞘氨醇单胞菌属(Sphingomonas,0.31%~12.19%),芽 胞 杆 菌 属(Bacillus,0.11%~6.07%)和 四 联 球 菌 属(Tetragenococcus,0.03%~4.63%)。由图2可知,不同样品细菌菌落结构存在较大差异。葡萄球菌属在TS、GXB、MT和DWDF样品中相对丰度均超过50%,而不动杆菌属在JJ样品中的相对丰度达到39.24%,假单胞菌属在CCMZ样品中相对丰度达到18.20%。可见葡萄球菌属广泛存在于10个雪茄烟样品中,并在大部分样品中占有较大的相对丰度比重,属于雪茄烟样品中主要优势细菌属。不动杆菌属和假单胞菌属也存在于各个样品中,且在个别样品中相对丰度占比较大,也属于雪茄烟样品中优势细菌属。在属水平上将各样品的细菌微生物组成进行对比分析,7个国产雪茄烟样品的相关优势细菌属的相对丰度差异较大,而3个进口雪茄烟样品的相关优势细菌属的相对丰度差异较小,其中3个国外雪茄烟中葡萄球菌属细菌丰度明显高于除TS外的6个国产雪茄烟。
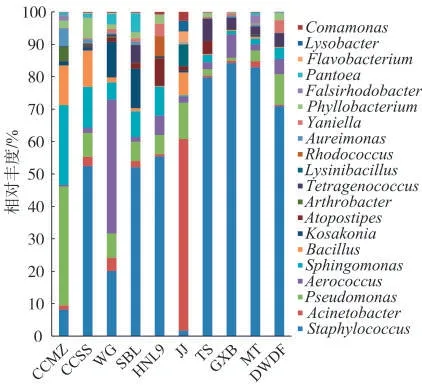
图2 雪茄烟样品中主要细菌属的相对丰度Fig.2 Relative abundances of major bacterial genera in cigar samples
2.4 真菌群落结构分析
对10个雪茄烟样品中微生物的真菌群落组成进行了鉴定,共检出7个真菌门和49个真菌属。表5列举了样品中真菌在各分类水平的种类。与雪茄烟样品中细菌在各分类水平上的种类相比,真菌的种类数量均显著低于细菌。
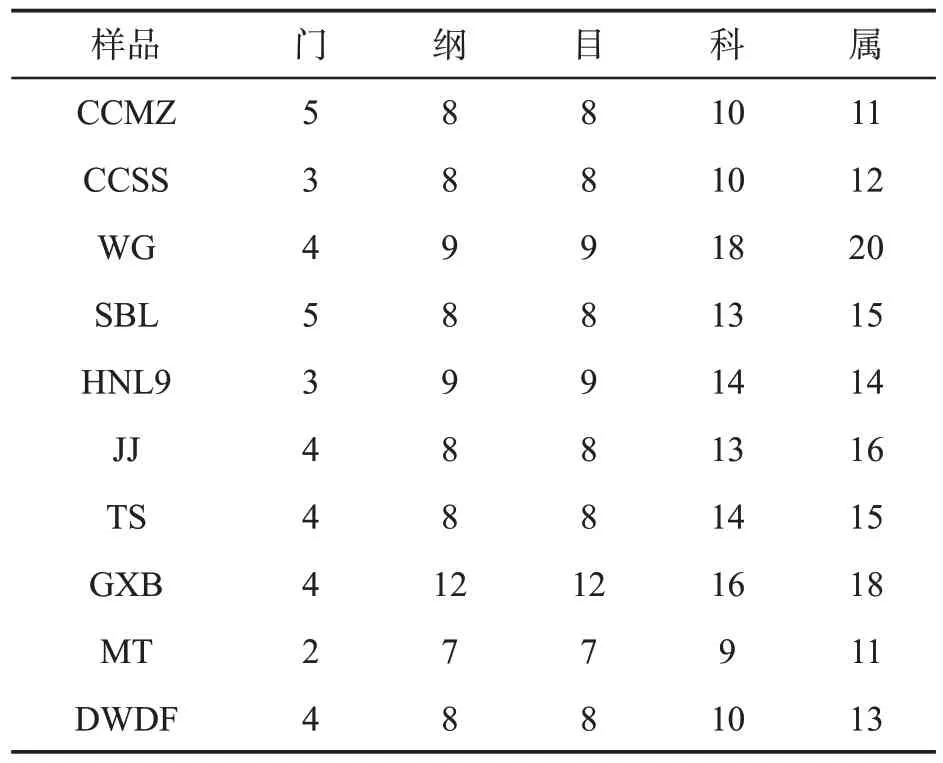
表5 雪茄烟样品中细菌在各分类水平的种类数量Tab.5 Number of species of each fungal classification in cigar samples (个)
10个样品中真菌群落在门分类水平上主要有子 囊 菌 门 (Ascomycota) 和 担 子 菌 门(Basidiomycota),平均相对丰度大于1%的真菌门仅有子囊菌门(1.6%~10.9%),图3表明该菌门在10个样品中均为优势菌门,这与调制期烟叶[10]和自然醇化片烟[11]中优势真菌门结果一致。担子菌门仅在WG样品中的相对丰度大于1%,而其他的真菌门相对丰度均不足1%。3种进口雪茄烟样品优势菌门的相对丰度差异较小,而7种国产雪茄烟样品的优势菌门相对丰度差异较大,其中WG,SBL和TS样品中担子菌门的相对丰度明显高于其他样品。
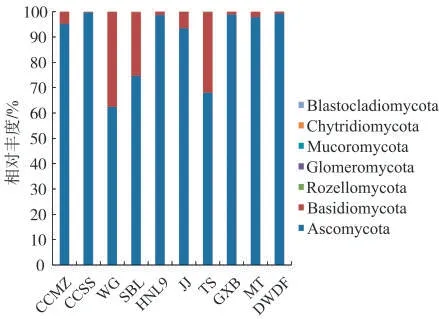
图3 雪茄烟样品中主要真菌门的相对丰度Fig.3 Relative abundances of major fungal phyla in cigar samples
在属分类水平,真菌属共检出49个,远低于检出的细菌属种类。图4列举了10个样品平均相对丰度前20的属,其中平均相对丰度大于1%的真菌属有2个,分别为曲霉属(Aspergillus,1.36%~10.49%)、节担菌属(Wallemia,0.1%~1.36%)。其中曲霉属在雪茄烟微生物中属于绝对优势菌属,这与陈善义等[11]采用高通量测序技术分析12份自然醇化片烟样品的真菌优势菌属结果、以及邱立友等[12]利用传统平板培养法研究自然醇化片烟微生物区系结果较为一致。

图4 雪茄烟样品中主要真菌属的相对丰度Fig.4 Relative abundances of major fungal genera in cigar samples
在属水平上将各样品中真菌组成进行分析,3个进口雪茄烟样品的曲霉属的相对丰度差异较小,而7个国产雪茄烟样品的曲霉属的相对丰度差异较大,其中CCMZ、CCSS、HNL9和JJ样品中曲霉属所占比例较高且与进口雪茄烟相对丰度相近。WG,SBL和TS样品中节担菌属的相对丰度明显高于其他样品,三者均为国产雪茄烟产品,其中WG和SBL样品为国内半机制雪茄烟。
2.5 样品间聚类分析
根据物种或样品间丰度的相似性进行聚类分析,并将细菌和真菌群落结果呈现在群落结构热图上(图5和图6),可使高丰度和低丰度的物种分块聚集,通过颜色变化与相似程度可反映不同样品在各分类水平上群落组成的相似性和差异性。颜色越红表示菌属在样品中的相对丰度越高,颜色越蓝表示菌属在样品中的相对丰度越低。从图5中细菌聚类分析结果可知,TS、DWDF、GXB和MT样品聚集在1个小的分支,说明这4个样品细菌属的群落结构比较相似,而JJ样品与其他样品未发生聚类,说明该样品与其余9个样品的细菌群落结构差异较大。从图6中真菌属聚类分析结果可知,SBL和MT样品聚集于1个小分支,JJ和GXB样品聚集在旁边的另1个小分支上,这2个小分支又聚集在一起,说明这4个样品真菌属的群落结构相似度较高。综合细菌属和真菌属聚类分析结果,可得出GXB和MT样品中细菌属和真菌属的群落结构最为相似,这可能是因为两者均来自同一产地国古巴。

图5 基于聚类分析的属水平细菌群落结构热图Fig.5 Heatmap of bacterial community structure at genus level based on cluster analysis
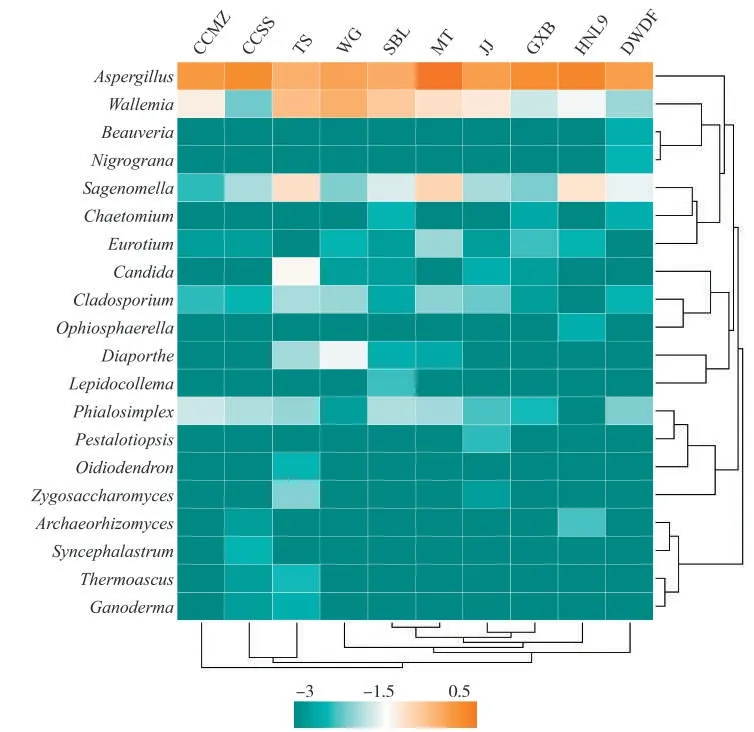
图6 基于聚类分析的属水平真菌群落结构热图Fig.6 Heatmap of fungal community structure at genus level based on cluster analysis
3 讨论
从门分类水平分析各样品中微生物多样性,发现厚壁菌门和子囊菌门分别是细菌和真菌的优势菌门。从属分类水平分析,发现葡萄球菌属、不动杆菌属、假单胞菌属和曲霉属是10个雪茄烟样品中微生物的优势菌属,这与张鸽等[8]采用高通量测序技术对墨西哥雪茄外包皮表面细菌主要种属分析结果(棒状杆菌属、葡萄球菌属、不动杆菌属、假单胞菌属和芽胞杆菌属等)较为一致,且该研究发现细菌群落结构随发酵进程而变化,优势微生物由发酵前期的假单胞菌属(40.88%)和棒状杆菌属(44.64%)演替为发酵后期的葡萄球菌属(72.78%)。然而相关文献[3-4]报道利用传统微生物分离方法分析雪茄烟叶和茄衣表面微生物区系,却发现芽胞杆菌属为优势菌株,与高通量测序结果不完全一致,这可能与传统微生物分离鉴定手段的局限性有关[8],因为不同种属的微生物具有不同的生理生化特征,对营养基质的需求不同,其分离纯化受分离培养基的影响较大,故用不同的分离培养基可能得到不同的结果。
雪茄烟微生物中葡萄球菌属、假单胞菌属和曲霉属等优势细菌属具有丰富的代谢功能,不仅可能改善雪茄烟感官品质,而且可分解代谢烟草本身的一些有害成分。国内外虽暂无葡萄球菌属在雪茄烟叶发酵过程作用机理的研究报道,但已有食品中代谢功能的相关研究,如葡萄球菌属在腊肉和香肠发酵过程中可代谢支链氨基酸和含硫基氨基酸形成培根风味[13]。而假单胞菌属细菌能够分解多种环境污染物,被认为是环境中主要的有机物分解者,产碱假单胞菌属(Pseudomonas alcaligenes)具有降解多环芳烃的能力[14],假单胞菌属中部分菌种能降解烟草中有害物质,如烟草特有亚硝胺[15-16]。雪茄烟优势真菌属中曲霉属的很多菌也具有改善烟叶品质的能力,如高文霞等[17]从烟叶中分离到一株曲霉属菌株SZ14,用该菌处理烟叶后,烟叶有机酸和石油醚提取物含量明显增加,感官评吸得分显著提高。然而,曲霉属也是片烟仓储和养护过程中导致霉变的主要菌属[11,18-19],可关注和警惕该类真菌,对于可能导致雪茄烟霉变的曲霉属的具体种类和含量可进行筛选和针对性控制,以便更有效地提升雪茄烟产品质量。
雪茄烟中的微生物具有丰富的群落多样性和特色的菌群组成结构,可将微生物高通量测序结果作为参考,按照所剖析的优势菌群,同时结合代谢组学、培养组学等技术手段和方法,从中筛选出更多有益的微生物菌株,对其在雪茄烟发酵过程中的功能进行准确的定位,以便深入研究其在雪茄烟发酵中的作用,探寻其作用机理,挖掘功能性菌株,进一步改变雪茄烟发酵工艺,从而提升雪茄烟品质。高通量测序技术在食品微生物生态学研究中已得到了应用,极大加深了对食品微生物多样性的认识,但该技术需要专业的分析测试平台,同时所产出的巨大测序数据需要熟练的生物信息学分析能力,限制了其在烟草微生物研究中的广泛应用和推广。此外,高通量测序结果的序列读长有限(1 000 bp以下),对序列进行分析时通常只能鉴定到属水平,很难在种水平上对微生物区系进行研究。
4 结论
本研究中发现10个雪茄烟样品的微生物群落组成丰富,共检出36个细菌门和360个细菌属,其中平均相对丰度大于1%的细菌门和细菌属分别为4个和7个;共检出7个真菌门和49个真菌属,其中平均相对丰度大于1%的真菌门和真菌属分别有1个和2个,其中优势菌门为厚壁菌门和子囊菌门,优势菌属为葡萄球菌属、不动杆菌属、假单胞菌属和曲霉属;细菌群落多样性水平最高和最低的样品分别为HNL9和CCSS样品,而真菌群落多样性水平最高和最低的样品分别是WG和HNL9样品。另外,不同样品中细菌和真菌群落多样性和结构存在显著差异,7个国产雪茄烟样品的相关优势菌属的相对丰度差异较大,而3个进口雪茄烟样品的相关优势菌属的相对丰度差异较小,聚类分析显示来自同一产地国的GXB和MT样品菌群分布比较相似。

