磷掺杂类石墨相氮化碳的制备及其在甲基汞检测中的应用
孙晓彤,刘 瑶,戴正亮,王 贝,黄剑豪,陈 星
(1. 合肥工业大学 资源与环境工程学院,安徽 合肥 23000;2.安庆市长虹化工有限公司,安徽 安庆246002)
水体汞污染来源多为汞的开采冶炼、氯碱、化工等工业企业排出的废水及含汞农药的使用。汞在水环境中主要以单质汞,无机汞,和有机汞的形态存在。水中胶体颗粒、悬浮物、泥土颗粒、浮游生物等都能吸附汞,而后通过重力作用沉降进入底泥,在微生物的作用下可转变为有机汞。有机汞的毒性远大于单质汞和无机汞,其中甲基汞形态更加危险[2, 3]。甲基汞是一种很强的神经毒素,由于其小分子量且具有强脂溶性,很容易穿过血脑屏障和生物膜,会给人类健康造成一定的危害[4]。因此,迫切需要发展一种快速、灵敏的分析方法用于检测水环境中的甲基汞。
目前,甲基汞的分析主要是元素分析仪器(如原子发射光谱[5]、原子荧光光谱[6]和电感耦合等离子体质谱[7])与高效液相色谱的结合使用。这些分析方法具有操作复杂,仪器昂贵,耗时等缺点。因此,电化学分析技术以其高的灵敏度和选择性、成本低、易操作等优点而得到了广泛关注。徐等采用金纳米颗粒/石墨烯复合材料(AuNPs-RGO)修饰玻碳电极,通过差分脉冲伏安法(DPSV)对鱼中的CH3Hg+进行了分析。CH3Hg+浓度在3-24 μg·L-1范围内线性关系良好,最低检测限为0.12 μg·L-1[8]。Afonso等在酸性介质中,采用快速扫描伏安法探究了CH3Hg+在碳纤维电极上的还原机理,并阐明甲基汞的伏安曲线与扫描速率的关系[9]。Abolllino等利用盐酸作为电解质,在方波模式下测量甲基汞的信号,其最低检测限为0.2 μg·L-1[10]。
众所周知,电化学传感器件的性能主要取决于电极材料。类石墨相氮化碳(Graphitic carbon nitride,g-C3N4)是一种具有独特能带结构、优异稳定性和良好生物相容性的纳米材料,可为生物小分子的电化学检测提供灵敏的传感界面[11]。同时,g-C3N4的层状结构可以进行灵活的修饰,进一步克服了其易团聚和导电性差的缺陷,一般可以通过元素掺杂或者表面修饰等方法。Wu通过水热反应制备了掺磷g-C3N4量子点,研究发现在P注入g-C3N4晶格的过程中,其带隙明显减小[12]。Hu等人制备了磷掺杂g-C3N4(PCN),并涂覆在Al2O3基底上制备了光催化膜反应器。在可见光照射下,10% PCN对亚甲基蓝的降解活性最高。这是因为磷的加入取代了C位并填补了C空位,在保留结构特征的同时修复了结构缺陷,从而减少了电荷重组,提高了导电率[13]。Zhou等以六氯环三磷腈为磷源,采用热聚合法成功地合成了磷掺杂的g-C3N4,在光催化制氢方面表现出出优异的光催化性能。磷原子的引入起到到头重要的作用,共改变了g-C3N4的电子结构性质并抑制光生电荷的复合载体,从而提高其光催化性能[14]。综上,在g-C3N4结构中引入P原子,进一步利用其催化作用,有望提升甲基汞的电化学分析性能。g-C3N4是一种3D层叠材料,经过剥离和HCl质子化后,变为超薄纳米片,为吸附CH3Hg+提供更多的活性位点[15],质子化还可以调节带隙,提高g-C3N4的催化作用和离子电导率[16],从而可以进一步提高CH3Hg+的灵敏度。
本文以脲素为前驱体,磷酸二氢铵为磷源,通过高温热聚合法制备磷掺杂g-C3N4。其中,磷元素的掺入改变了g-C3N4的电子性质和带隙宽度。进一步通过盐酸酸化处理得到质子化的磷掺杂g-C3N4(PCN),改性后PCN表现出良好的分散性和大的表面积,其有利于电荷的转移与分离。采用PCN构建电化学传感界面用于CH3Hg+的检测,同时考察了不同P掺入量对CH3Hg+检测的影响。此外,还探究了该电化学敏感界面的抗干扰性能和在实际水环境中CH3Hg+分析的应用。结果表明,PCN修饰电极具有很高的灵敏度、可靠性和稳定性,在解决实际水环境检测方面具有巨大的应用潜力。
1 实验部分
1.1 主要试剂
脲素(CH4N2O)、磷酸二氢铵(NH4H2PO4)和氯化甲基汞(CH3HgCl)均为分析纯,购自上海国药试剂有限公司,无需进一步纯化即可用于本研究。通过混合0.1 M乙酸和0.1 M乙酸钠溶液制备0.1 M乙酸-乙酸钠缓冲溶液,均为分析纯,购自天津市大茂化学试剂厂。通过稀释重金属离子的标准溶液来制备不同浓度的重金属离子溶液。其他试剂均为分析纯,购买自于中国国药集团化学试剂有限公司。
1.2 主要仪器
所有电化学实验都在CHI760E电化学工作站(中国上海化学仪器公司)上进行,使用配备有金电极、铂丝电极和氯化银电极的三电极系统。表征仪器有:场发射扫描电子显微镜(SEM,美国 FEI 公司)、场发射透射电子显微镜(TEM,日本Hitachi公司)、傅里叶变换红外光谱仪(FT-IR,美国Thermo Nicolet公司)、X射线光电子能谱仪(XPS,美国 Thermo公司)、X射线衍射仪(XRD,日本里加公司)、紫外-可见光谱仪(UV-vis,美国Agilent公司)。
1.3 磷掺杂g-C3N4纳米材料的制备
磷掺杂g-C3N4通过高温热聚合方法制备[17]。首先,取20 g脲素置于氧化铝(Al2O3)陶瓷坩埚中,放入马弗炉550 ℃加热2 h,以10 ℃每分钟的速度升温,反应结束后,将坩埚冷却至室温,将制备好的g-C3N4命名为CN。然后,将一定量的脲素(19、18、17 g)和磷酸二氢铵(1、2、3 g)溶于50 mL水中,并在60 ℃水浴中搅拌1 h,之后将混合溶液在60 ℃的烘箱中干燥12 h,然后将干燥后的复合物转移到Al2O3陶瓷坩埚中,并在马弗炉550 ℃加热2 h,以10 ℃每分钟的速度升温,反应结束后,将坩埚冷却至室温[17]。将材料进行剥离并用浓盐酸(37%)质子化处理。将2 g复合材料放入20 mL去离子水中,超声处理16 h,超声频率为90 Hz,每20 min换水一次,保持水温在25 ℃以下。然后在10000 r/min下离心5 min,然后在60 ℃下干燥12 h,得到剥离的复合材料。将剥离的材料放入HCl(37%)中,在室温下搅拌3 h,得到不透明的分散体。用去离子水洗涤三次,在60 ℃烘箱中干燥12 h,得到HCl质子化后的复合材料。根据前驱体(磷酸二氢铵和脲素混合物)中磷酸二氢铵所占的质量百分比(5%、10%、15%),制备出含不同磷掺杂量的g-C3N4,并将其命名为PCNx,分别为PCN5、PCN10、PCN15。
1.4 磷掺杂g-C3N4修饰金电极的制备
金电极的预处理:首先要对金电极的表面进行抛光处理,具体操作为用1.0、0.3、0.05 μm的氧化铝粉末对金电极的表面进行打磨,直至表面光滑呈现镜面为止,然后依次使用无水乙醇和去离子水超声2 min,电极在常温下晾干备用。在电极使用之前,将电极在0.5 mol/L硫酸中活化。
在金电极表面修饰PCNx纳米材料采用滴涂法,即取2 mg的PCNx纳米材料置于试管中,加入4 mL的去离子水,制得0.5 g/L的PCNx悬浮液,再用微量移液枪吸取5 μL的悬浮液于预处理后的金电极表面。修饰过后的电极在自然环境中放置待干。
1.5 电化学分析实验
采用差分脉冲伏安法(DPV)对缓冲溶液中甲基汞离子进行电化学检测,缓冲溶液中的甲基汞离子在富集电压为-0.9 V,富集时间为800 s的条件下沉积在修饰金电极的表面,离子还原为零价。然后在DPV下,电化学窗口0-1 V内出现电化学响应峰,共峰电流随着离子的浓度的增加而增加。随后,在电极表面施加+1.2 V,时间150 s用来去除电极表面被还原的金属,以便于接下来的实验。根据汞离子的电化学响应电流峰值与浓度之间的关系,利用相关软件进行拟合,对甲基汞离子进行定量分析。
2 结果与讨论
2.1 磷掺杂g-C3N4的扫描电子显微镜(SEM)表征
图1是CN和PCN10的扫描电镜图(SEM)、透射电镜图(TEM)和能量色散X射线光谱(EDS),从图1(a),(b)中可以观察到CN和PCN10纳米片的聚集体。在形态上,CN和PCN10的结构非常相似,说明磷掺杂并没有改变其形貌[18],观察其孔隙,发现CN的团聚现象得到抑制,PCN10纳米片更薄。图1(c)中显示PCN10纳米片由薄纳米片构成,具有层状结构和孔道,孔结构可以促进传质,为催化反应提供更多的活性位点。为了确定这些样品的氧化态和化学键,还进行了EDS分析以确认组成,并清楚地揭示了碳、氮和磷的存在。从图1(d-g)可以看出,C和N是g-C3N4的两种组成元素,均匀分布在PCN10样品中,掺杂元素P和O也均匀分布。

图1 (a)CN; (b)PCN10的扫描电镜图(SEM); (c)PCN10的透射电镜图(TEM)和(d)-(g)PCN10的能谱图
2.2 磷掺杂g-C3N4的X射线光电子能谱(XPS)表征
通过X射线光电子能谱(XPS)来研究样品内元素的化学状态,分析结果如图2所示。从图2(a)可以看出,所有样品都由C、N和O这三种元素所组成,在全谱中均可观察到P的特征峰,说明P成功掺杂进g-C3N4中,PCN5、PCN10及 PCN15中磷元素的占比分别为8.6%、12.09%和14.06%。图2(b)中的C1s光谱在结合能为284.8、286.3、288.1 eV时显示出三个特征峰。284.8 eV的特征峰归因于无定形碳原子,286.3 eV的峰对应C-NH2,288.1 eV的特征峰是g-C3N4晶格中的三氮基C-(N)3[20]。图2(c)中的N1s位于特征能区399.1 eV的特征峰,可归因于三嗪环的杂化氮原子(C=N-C),402.1 eV处的弱峰与带有氢原子和叔氮的氨基(C-N-H)有关,存在于N-(C)3基团的特征峰中。本实验中最重要的是,如图2(d)所示,在PCN10样品中可以观察到位于134 eV处的特征峰,归因于掺杂过程中形成的P-N键[13],表明P取代C位点与相邻位点的g-C3N4骨架的庚嗪环内的N形成共价键。元素分析如:C 26.12%、N 51.68%、O 8.14%、P 14.06%。

图2 (a) CN、PCN5、PCN10和PCN15; (b)、(c) PCN10复合材料的C1s、N1s和(d) CN、PCN5、PCN10和PCN15的P2p的XPS光谱
2.3 磷掺杂g-C3N4的X射线衍射(XRD)表征
本实验中CN、PCN5、PCN10和PCN15的XRD图谱如图3(a)所示,在g-C3N4的XRD图谱中可以观察到在13.1°和27.1°附近有两个基本衍射峰。13.1°处的衍射峰是三嗪环单元的平面封装结构,对应于g-C3N4的(100)晶面。27.1°附近的强衍射峰对应于CN的芳香单元的层间堆积,对应于g-C3N4的(002)晶面[14]。由图中看出PCNx(0.323 nm)的晶面间距较短。这可能是由于脲素中额外的残余氧促进了缩合过程,使g-C3N4的晶体结构更加稳定。这两个峰值不会随时间而移动或改变,增加磷含量,揭示了g-C3N4的晶体结构在磷掺杂后得到很好的保留。
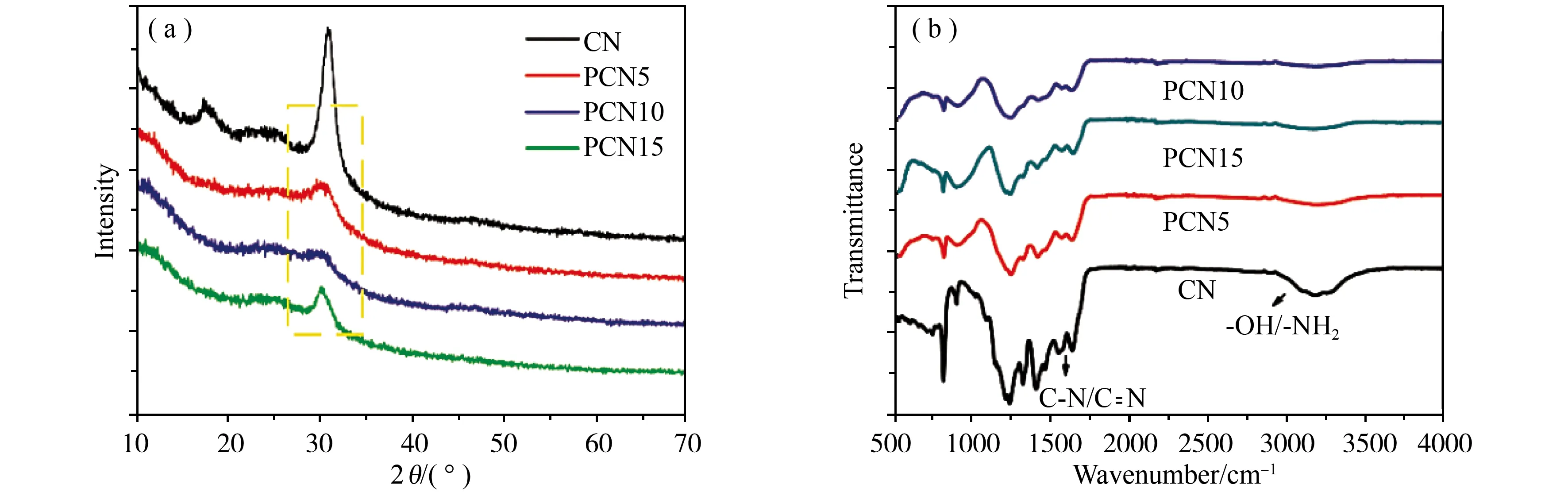
图3 CN、PCN5、PCN10和PCN15的(a)XRD图谱和(b) FTIR图谱
2.4 磷掺杂g-C3N4的傅里叶变换红外光谱(FTIR)表征
使用傅里叶变换红外光谱(图3(b))研究了PCNx样品的模式。在1200-1600 cm-1范围内的峰值代表碳氮杂环体系的伸缩振动,以及在804 cm-1处的峰代表着可以分配给七嗪环的伸缩振动。3000-4000 cm-1附近的宽带可归因于分别来自表面吸附的H2O和未凝聚胺基的羟基和氮氢振动。PCNx样品显示出石墨sp2键的三-s-三嗪环。随着过量的磷掺杂进g-C3N4中(PCN15),FTIR的强度略有下降,表明g-C3N4的结构被破坏,这可能导致磷掺杂的g-C3N4的光催化活性降低。
2.5 磷掺杂g-C3N4的紫外可见漫反射光谱(UV-Vis)表征
图4(a)为所有样品的紫外可见漫反射光谱,与CN的能带边缘相比,PCN10具有红移,这可能是因为P的掺杂导致捕获更多的光能以产生更多的光致电子空穴电荷[22]。磷原子在g-C3N4基体中的引入对与其密切相关的能带结构和电子性质有显著影响,这与半导体的光吸收有关。如图4(b)-(d)所示,根据Kubelka-Munk公式,吸附CH3Hg+前的CN和PCN10的带隙宽度分别计算为2.71、2.63 eV,吸附后的带隙宽度为2.68、2.57 eV,显示出PCN10的带隙要比CN窄,吸附CH3Hg+后CN、PCN10的带隙比吸附前窄。可以得出PCN10的带隙较窄,说明P掺杂确实可以调节带隙,提高电导率。磷掺杂的g-C3N4吸附CH3Hg+后也可以更好的调节带隙,提高电导率。
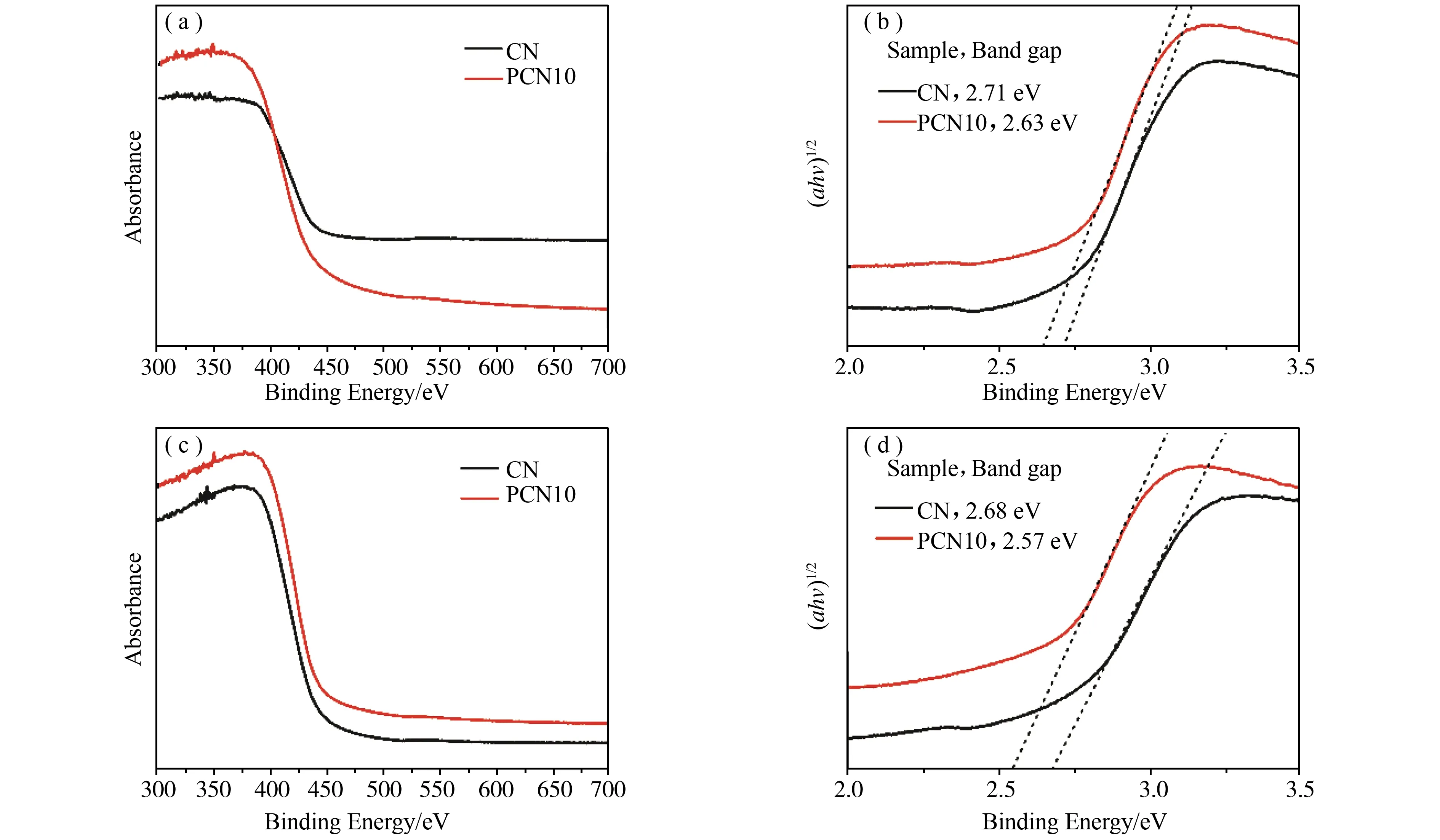
图4 与甲基汞吸附前所有样品的(a)紫外可见漫反射光谱以及(b) (αhν)1/2与光子能量关系图,与甲基汞吸附后所有样品的(c)紫外可见漫反射光谱以及(d) (αhν)1/2与光子能量关系图
2.6 不同修饰电极材料检测CH3Hg+的比较
图5中显示了不同比例的磷掺杂g-C3N4修饰电极对15 μg·L-1CH3Hg+的电化学检测性能。在沉积过程中,当CH3Hg+在金电极表面还原为单质汞时,可能会发生剥离过程。CH3Hg+还原在裸金电极、CN和PCNx修饰电极上产生的溶出电流几乎相似。因此,为了确定掺磷g-C3N4的最佳比例,采用PCN5、PCN10和PCN15复合材料对金电极进行改性。CH3Hg+的最大峰值电流是用PCN10修饰的金电极获得的。说明磷掺杂g-C3N4与裸金电极相比具有优异的检测性能,这可归因于掺杂磷复合材料的优越性。因此在本电化学实验中,我们使用PCN10材料修饰金电极构建敏感界面从而进行后面所有的研究。

图5 裸金电极和不同比例掺磷g-C3N4复合样品(CN、PCN5、PCN10和PCN15)修饰电极在 0.1 M HAc-NaAc(pH=5.0)中对标定15 μg·L-1 CH3Hg+的(a)微分脉冲伏安法响应图和(b)所有样品的柱状图比较
2.7 电化学实验条件的优化
为了使得PCN10修饰电极传感器检测CH3Hg+获得最佳的电化学检测结果,对本实验中主要影响因子如电解质类型、pH、预浓缩时间和富集电位进行条件优化。所有优化都是在CH3Hg+浓度为15 μg·L-1时进行。图6(a)所示,缓冲溶液分别是pH=5的柠檬酸-柠檬酸钠溶液、磷酸氢二钠-磷酸二氢钾(PBS)溶液、乙酸-乙酸钠溶液(HAc-NaAc),CH3Hg+还原在HAc-NaAc中的响应电流最高,所以选择HAc-NaAc做为缓冲溶液。图6(b)所示,使用pH=4、5、6的0.1M HAc-NaAc溶液,结果显示pH=5时响应电流最高,故缓冲溶液选择pH=5的HAc-NaAc溶液。图6(c)显示 CH3Hg+的响应电流值随着时间的增加而快速提升,当时间超过800 s后,溶出电流峰值开始增加的较为缓慢。考虑到节约实验所用的时间,选取800 s作为实验优化时间。如图6(d)所示,富集电压选择了-1.0、-0.9、-0.8、-0.7、-0.6 V共5个电压进行电化学检测,可以看出富集电压在-0.9 V时达到最高,所以选择-0.9 V的富集电压。因此在本实验中,电解质采用HAc-NaAc缓冲液,pH值为5,富集电压为-0.9 V,富集时间为800 s。
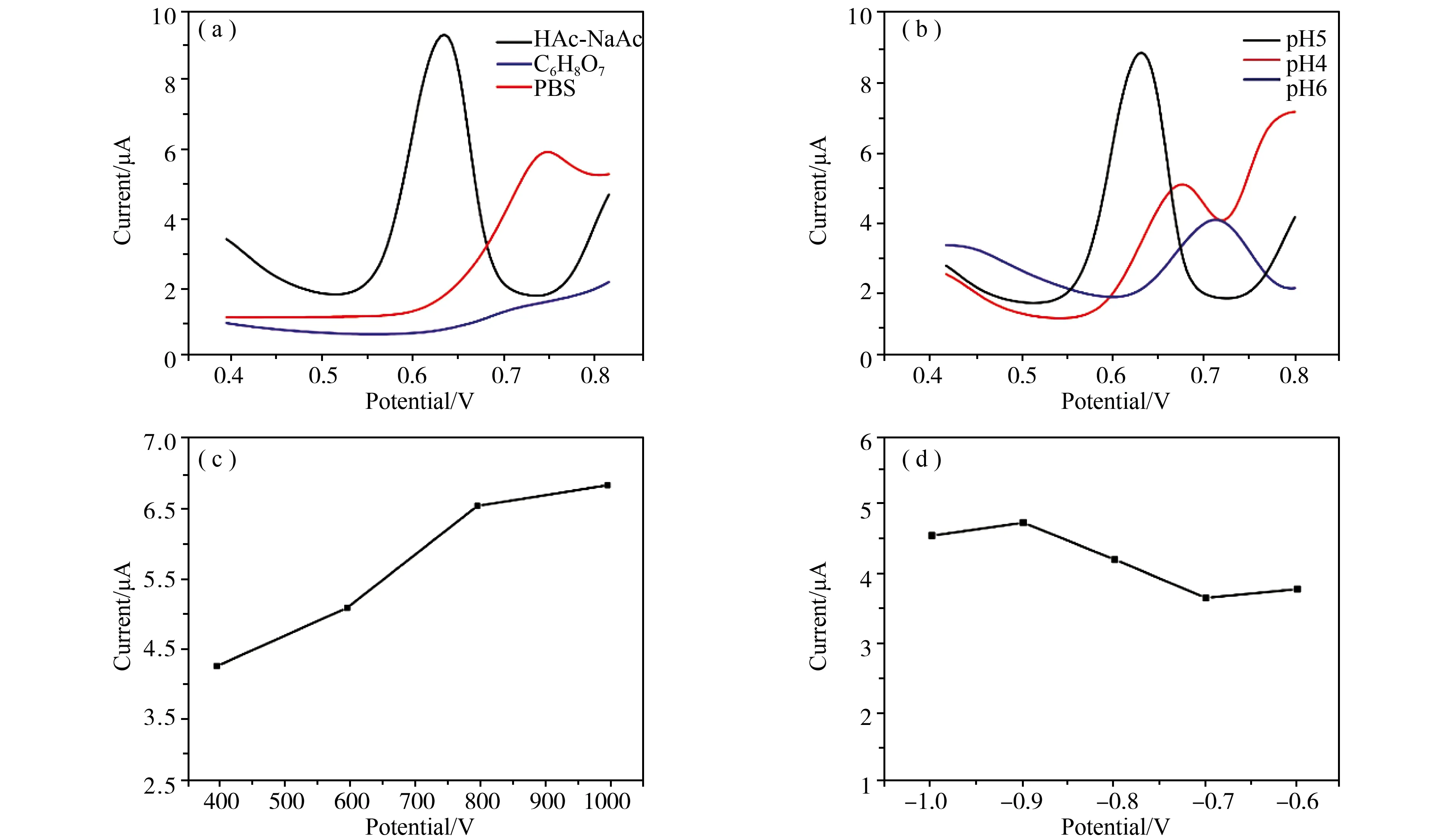
图6 PCN10修饰电极检测15 μg·L-1的CH3Hg+优化实验(a)缓冲溶液;(b)pH值;(c)预浓缩时间;(d)富集电压
2.8 电化学分析检测CH3Hg+
电极表面甲基化汞化合物的还原分两步进行。在恒电位下,CH3Hg+的电还原首先产生甲基汞自由基(CH3Hg·)。CH3Hg·要么被还原为Hg0(处于负电位),要么被歧化为(CH3)2Hg。在短时间内,不同有机汞化合物的二聚速率取决于R-Hg的氧化还原和络合反应[25]。根据电化学氧化还原机理,在CH3Hg·之后,Hg0沉积及溶出过程继续进行。
在最优的实验条件下,用PCN10纳米材料修饰金电极采用DPV对标定的CH3Hg+进行电化学检测分析,浓度范围为0-25 μg·L-1,裸金电极用作对照。图7中显示出电化学伏安溶出峰电流与CH3Hg+浓度之间的关系曲线。如图7.a所示为裸金电极线性回归模型,其线性方程为Ip(μA) = 0.231C(μg·L-1) +0.107 (n=9,R2=0.998)。图7(b)显示,Ip(μA)= 0.337C(μg·L-1)-0.099 (n=9,R2= 0.993),说明与裸金电极相比,未质子化的PCN10修饰的金电极对CH3Hg+检测的灵敏度明显提升。通过对材料进行盐酸质子化处理,以获得更好的灵敏度,如图7(c)所示,峰值电流与CH3Hg+之间的线性关系Ip(μA)=0.42C(μg·L-1)+0.066 (n=9,R2=0.986),灵敏度达到0.42 μA/(μg·L-1),检测限为0.182 μg·L-1。表1列出了之前通过不同电化学方法和材料检测CH3Hg+。可见,PCN10修饰金电极具有较高的灵敏度和较低的检测限。
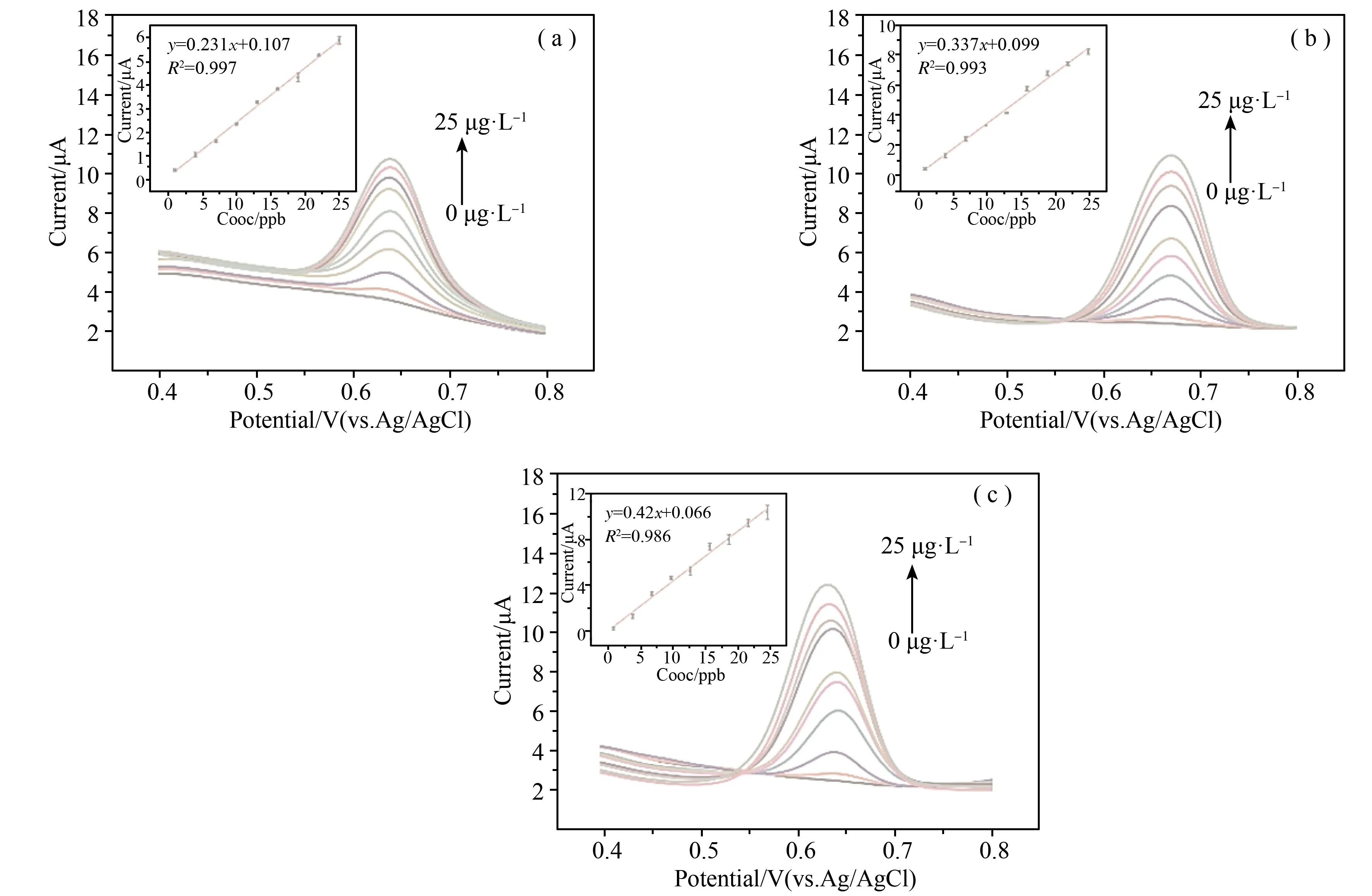
图7 在最优的实验条件下(a)裸金电极;(b)未质子化的PCN10纳米材料改性电极对CH3Hg+微分脉冲伏安法 (DPV)和(c)HCl质子化后的PCN10纳米材料改性电极对CH3Hg+微分脉冲伏安法(DPV)
2.9 其他阳离子的干扰实验
如图8所示,Hg2+、Cu2+、Cd2+、Pb2+、Bi3+和As3+等阳离子对CH3Hg+的干扰情况。根据CH3Hg+的电化学还原机理,无机Hg2+对CH3Hg+的测定有显著的影响,这是由于存在重叠的响应电位。图8(a)显示在0.1 M pH=5的HAc-NaAc溶液中添加15 μg·L-1CH3Hg+,加入SnCl2选择性还原Hg2+,SnCl2只还原Hg2+,不影响CH3Hg+,因此可以消除Hg2+对检测CH3Hg+的影响。实验中先在缓冲溶液中加入15 μg·L-1的CH3Hg+离子,然后按15 μg·L-1的5倍、10倍、15倍、20倍、25倍的比例分别加入待检测的干扰阳离子,在添加了其他重金属离子后,仍能灵敏地检测到CH3Hg+,峰值电流保持稳定。如图8(b)所示,Cu2+、Cd2+、Pb2+、Bi3+和As3+等阳离子不会使CH3Hg+的峰值电流变化超过5%[29]。因此,天然水样中常见的金属离子不会显著干扰该材料修饰电极检测CH3Hg+。
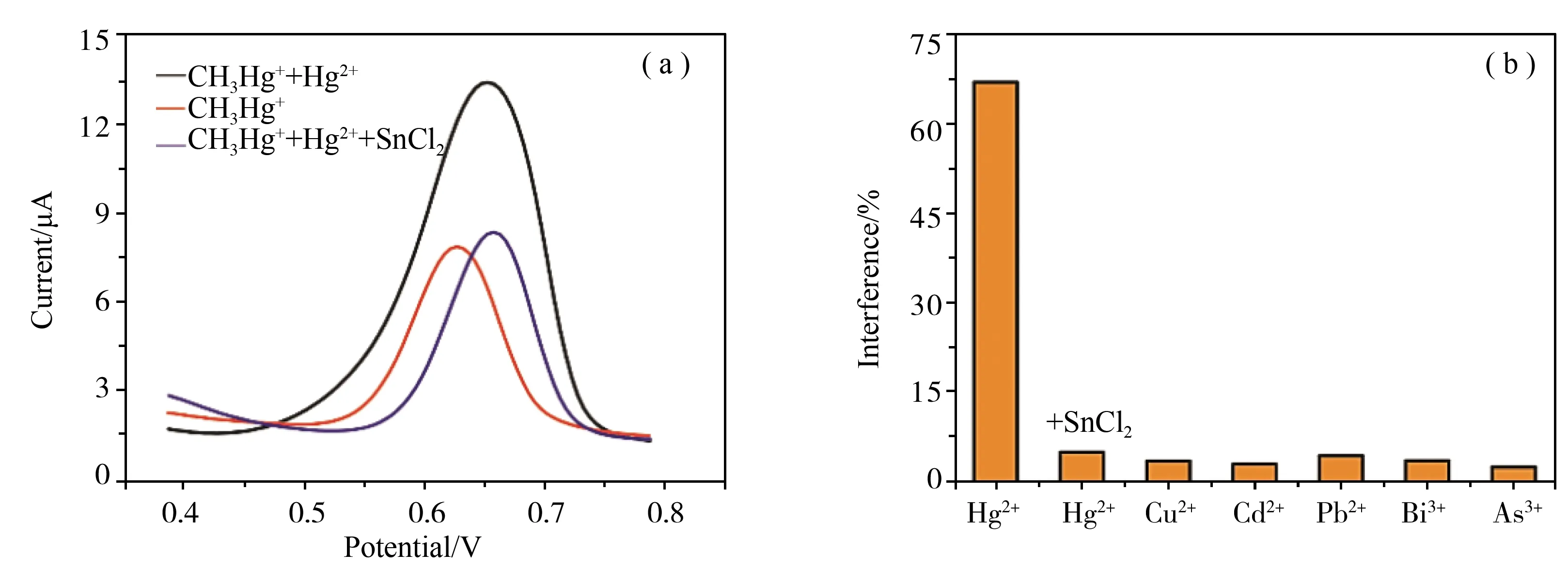
图8 不同金属离子对15 μg·L-1 CH3Hg+的峰值电流的影响
2.10 稳定性与重现性
PCN10修饰金电极作为一种电化学传感器,稳定性和重现性对于其性能来说十分重要。所以在本研究实验在最优条件下考察了PCN10修饰金电极传感器的稳定性和重现性。使用PCN10材料修饰5个金电极(编号为1-5)对CH3Hg+(15 μg·L-1)进行电化学检测,电化学响应如图9(a)所示,其RSD 计算为3.67%,低于5%。另一方面,用PCN10修饰电极对CH3Hg+(15 μg·L-1)进行循环5 D的重现性电化学检测,如图9(b)所示,在重复测量期间,CH3Hg+电化学剥离电流峰值并没有发生明显的波动,相对标准差(RSD)计算为2.49%。综上讨论,该PCN10修饰电极传感器界面具有良好的稳定性和重现性能,这为实际水样中甲基汞离子的电化学分析检测提供了可靠性支撑。
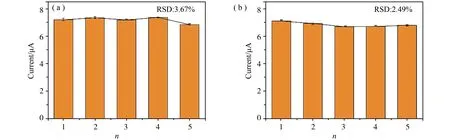
图9 PCN10纳米材料修饰电极对CH3Hg+的电化学检测(a)稳定性和(b)重现性研究
2.11 实际水样检测
用磷掺杂g-C3N4电化学传感器检测了安徽省合肥市合肥工业大学斛兵塘和安徽省合肥市南淝河实际水样中CH3Hg+的测定分析。电化学检测前,样品以1:19的比例混合在0.1 M HAc-NaAc缓冲液(pH=5)中,取混合溶液10 mL进行CH3Hg+的电化学检测,两个水样中均未检测到CH3Hg+污染。如表2所示,向水样中分别添加CH3Hg+溶液10和15 μg·L-1,CH3Hg+的加标回收率在94.7%-104.4%之间。数据表明,新方法不受天然水样中基质成分的影响。新的CH3Hg+检测方法可以有效地用于环境样品的甲基汞监测[30]。

表2 实际水样中甲基汞离子的检测分析结果
3 结论
综上,采用类石墨相氮化碳(g-C3N4)作为原材料,通过简单的化学合成方法制备出不同掺磷比例的g-C3N4,并将其作为电化学电极修饰材料。比较了不同掺磷比例的g-C3N4纳米结构材料修饰金电极对CH3Hg+的电化学检测性能。针对PCN10修饰电极体系进行相关实验条件的优化,该电极对重金属CH3Hg+具有较高的灵敏度和低的检测限,分别为0.42 μA/(μg·L-1),检测限为0.182 μg·L-1。采用PCN10修饰电极传感器对CH3Hg+的检测进行一系列的抗干扰实验,发现在金属离子干扰下,该电极体系对CH3Hg+检测的灵敏度具有一定程度上的降低,但是相对偏差都稳定在5%以内,可以说明其他重金属离子对该材料检测甲基汞无明显影响。该传感器具有良好的稳定性与重现性,有望在实际水样分析中进行应用。

