CuO x/CNTs催化剂上丙烯氧气环氧化反应
苏暐光孔 磊张 策宋旭东王焦飞于广锁姚 敏
(1.宁夏大学 省部共建煤炭高效利用与绿色化工国家重点实验室 化学化工学院,宁夏 银川 750021;2.国家能源集团宁夏煤业有限责任公司,宁夏 银川 750001)
环氧丙烷(PO)是一种十分重要的有机化工原料,广泛用于生产聚氨酯、聚丙烯、表面活性剂、不饱和树脂和其他化工产品[1-2]。丙烯氧气直接环氧化制环氧丙烷反应的原子经济性达到了100%,是最理想、最经济生产环氧丙烷的方法[3-7]。但是丙烯氧气直接环氧化目前还面临很大的挑战,即使在很低的丙烯转化率条件下,环氧丙烷的选择性也不超过60%,丙烯转化率一旦超过1%,环氧丙烷的选择性迅速下降到10%以下[8-10]。由于丙烯的烯丙基氢原子异常活泼,经常优先与亲核性氧物种发生反应生成丙烯醇和丙烯醛等副产物,使得环氧丙烷的选择性非常低[11]。Cu催化剂由于价格低廉、来源丰富、对环境友好,是一种潜在的丙烯环氧化催化剂,目前在Cu催化剂上进行丙烯氧气环氧化反应的研究并不多见,而且Cu物种的价态和丙烯环氧化反应活性之间的内在关系还存在较大的争议[12]。Vaughan等[13]采用微乳法制备了Cu/SiO2催化剂,在反应温度225℃下,环氧丙烷选择性和丙烯转化率分别为53%和0.25%,他们认为高分散的Cu0物种是丙烯环氧化反应的活性相。Zhu等[14-15]合成了K+修饰的Cu Ox/SiO2催化剂和Cs+修饰的Cu Ox/SiO2催化剂,他们认为反应过程中生成的Cu+物种是丙烯环氧化活性中心。Lai等[16]通过原位X射线吸收光谱和红外光谱表征发现,在丙烯氧气选择氧化过程中,还原态金属Cu0物种逐渐被氧化为Cu+物种,但反应结果表明选择氧化产物主要是丙烯醛而不是环氧丙烷。Onal等[17]则认为在较低的Cu负载量下,CuO/SiO2催化剂中隔离的Cu2+物种主要负责环氧丙烷的生成。因此,建立Cu物种的价态与丙烯氧气环氧化反应的活性中心之间的内在关系十分重要。
碳纳米管(CNTs)是一种新型的碳材料,具有独特的中空和一维片层介孔卷曲结构,同时兼具比表面积高、导电性优良、导热性能好、还原能力较强和化学稳定性良好等优点[18]。在CNTs的孔道内引入金属或金属氧化物纳米粒子,其物化性质会发生显著变化[19]。相比CNTs孔道外的Fe2O3,CNTs孔道内的Fe2O3纳米粒子更容易被还原,反之,CNTs孔道内的金属Fe粒子的氧化速率明显小于CNTs外表面的Fe粒子[20]。同时CNTs也是一个非常优秀的催化剂载体,被广泛应用于各类催化和电化学反应,例如芳香环加氢反应[21]、CO和CO2催化加氢[22-23]、电化学电容器[24-25]以及费-托合成[26]等。
笔者采用均相沉积-沉淀法合成了CuO/CNTs复合材料,利用XRD和TEM对预处理后的CuOx/CNTs催化剂的晶相组成和粒径大小进行了检测。CNTs的限域效应使得孔道内的Cu物种在高温下不易长大和聚集[27],可以有效控制Cu物种的粒径大小。通过改变CuO/CNTs的预处理气氛和温度,调控Cu物种的价态分布,而且还能够保持Cu物种的形貌和粒径大小不发生变化,排除Cu物种的粒径变化对丙烯环氧化反应的影响。运用具有在线色谱检测的固定床反应装置分析了Cu物种的价态在CuOx/CNTs催化剂上丙烯环氧化反应中的作用和地位。
1 实验部分
1.1 试剂与原料
Cu(NO3)2·3H2O,分析纯,徐州天鸿化工有限公司产品;多壁碳纳米管(CNTs,质量分数大于95%),中国科学院成都有机化学有限公司产品;尿素(CO(NH2)2)、环氧丙烷(C3H6O)、丙烯醛(C3H4O),分析纯,国药集团化学试剂有限公司产品;丙烯(C3H6),体积分数大于99.5%,西安玻化仪器有限公司产品;氧气(O2)、氮气(N2)、氢气(H2),体积分数均大于99.999%,银川秦虹气体有限公司产品;去离子水(自制)。
1.2 CuO x/CNTs催化剂的制备
以尿素为沉淀剂,采用均相沉积-沉淀法合成CuO/CNTs复合材料[28]。称取0.0227 g的Cu(NO3)2·3 H2O溶于30 m L去离子水中,将0.3 g的CNTs分散到其中,超声搅拌1 h,在剧烈搅拌下缓慢加入0.0567 g尿素,形成均匀的黑色悬浮液,其中尿素与Cu(NO3)2的摩尔比为10。将该混合物加热到90℃并保持18 h,沉淀反应结束后冷却至室温,用去离子水重复过滤洗涤直至p H=7,然后在60℃下真空干燥12 h,得到黑色固体,样品标记为CuO/CNTs,其中Cu的质量分数约为2%。在进行催化反应性能评价前,CuO/CNTs复合材料在不同的气氛和温度下进行预处理,预处理后Cu O/CNTs中的Cu2+物种会发生一定程度的还原反应,Cu物种的价态发生了变化,此时样品标记为Cu Ox/CNTs催化剂。
1.3 样品的表征和催化性能测试
采用德国Bruker D8 Advance X射线衍射仪XRD分析样品的晶相结构,Cu靶Kα为辐射光源,管电压40 k V,管电流40 m A,扫描范围10°~80°,扫描速率6°/min。采用美国FEI公司Tecnai G2 F30场发射透射电子显微镜(TEM)表征样品的微观形貌和粒径大小,加速电压为200 k V。
丙烯催化环氧化反应性能评价在固定床反应装置上进行,催化剂样品装填在内径6 mm、长450 mm的石英管中。称取0.15 g的CuO/CNTs样品置于直立石英管中,反应气组成为C3H6、O2和N2,相应的气体流速分别为5、5和75 m L/min,反应温度范围为150~300℃、常压,在每个反应温度下保持30 min。在催化反应前,CuO/CNTs样品在N2或H2气氛下不同温度原位预处理1.5 h,气体流速为30 mL/min,预处理温度范围为250~550℃。反应产物通过在线气相色谱进行检测,丙烯和有机产物通过KB-Wax(50 m×0.32 mm×0.30μm)毛细管色谱柱进行分离,用FID检测器检测;丙烯和CO2通过Porapak-Q填充型色谱柱进行分离,用TCD检测器检测。KB-Wax毛细管柱和Porapak-Q填充柱的柱温均设定为60℃,C3H6的转化率(X(C3H6),%)和环氧丙烷以及其他产物的选择性(Si,%)通过碳平衡方法进行计算,见式(1)和(2):

式中:A i为相应组分的峰面积;f i为相应组分的相对克分子校正因子。
2 结果与讨论
2.1 不同气氛和不同温度下预处理的CuO/CNTs的XRD和TEM分析
图1为CuO/CNTs样品分别在N2或H2气氛下350℃预处理前后的XRD谱图。为了方便比较,纯CNTs样品的XRD谱图也在图1中列出。从图1可以看出:对于未经预处理的CuO/CNTs样品,在2θ为25.8°和42.7°位置处出现了2个较强的衍射峰,分别对应于碳纳米管(002)和(100)晶面的特征衍射峰[29];除了CNTs的衍射峰外,位于35.4°和38.7°处也观测到了明显的衍射峰,它们可归属为CuO的(002)和(111)晶面的特征衍射峰(PDF#80-1917),表明Cu物种主要是CuO。当CuO/CNTs样品在N2气氛下350℃预处理后,CuO晶相的特征衍射峰几乎完全消失,在2θ=36.3°处出现了1个新的衍射峰,该峰归属为Cu2O的(111)晶面的特征衍射峰(PDF#05-0667),说明绝大部分CuO被CNTs还原为Cu2O。当Cu O/CNTs样品在H2气氛下350℃预处理后,在43.2°处出现了1个尖锐的衍射峰,同时在50.3°处还观测到了1个较弱的衍射峰,这2个衍射峰分别对应于金属Cu的(111)和(200)晶面的特征衍射峰(PDF#04-0836),而且图中并没有发现CuO和Cu2O的特征衍射峰,表明所有的Cu物种在H2的还原作用下全部转变为金属Cu0物种。XRD结果说明,通过简单调变预处理气氛,可以有效控制CuOx/CNTs催化剂中Cu物种的价态分布。担载Cu物种后,CNTs衍射峰的强度和纯CNTs相比明显减弱,表明Cu物种的引入使得CNTs的结晶度有所降低。
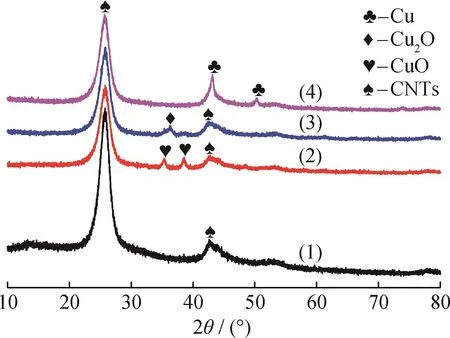
图1 CuO/CNTs在N2或H2气氛下350℃预处理前后的XRD谱图Fig.1 XRD patterns of CuO/CNTs samples before and after pretreated at 350℃under N2 or H2 atmosphere
为了进一步精确调控Cu物种价态的分布情况,对CuO/CNTs样品在N2气氛不同温度下进行预处理,所得XRD谱图如图2所示。由图2可知:当N2预处理温度为250℃时,Cu物种的衍射峰和未处理前相比没有发生变化,说明Cu物种几乎没有发生还原反应,仍然为CuO;当N2预处理温度增加到350℃时,Cu O物种的衍射峰几乎完全消失,只能观测到Cu2O的特征衍射峰,表明大部分CuO已经还原为Cu2O,此时Cu物种主要是Cu+,几乎没有Cu2+和Cu0物种;继续升高N2预处理温度到450℃,除了Cu2O的衍射峰外,在43.2°处出现了金属Cu0物种的特征衍射峰,说明一部分Cu2O被CNTs进一步还原为Cu0物种,Cu物种包含Cu+和Cu0;当N2预处理温度达到550℃时,以Cu2O衍射峰(36.3°)的强度为基准,Cu0物种衍射峰(43.2°)的相对强度进一步增强,说明有更多的Cu2O被还原为Cu0物种。图2结果显示,Cu O首先被CNTs还原为Cu2O,然后Cu2O被进一步深度还原为Cu0物种。随着N2预处理温度的升高,Cu Ox/CNTs催化剂中Cu2+物种的含量逐渐降低,Cu+物种的含量先升高后降低,Cu0物种的含量逐渐升高,N2预处理温度为350℃时,Cu+物种的含量达到最高。
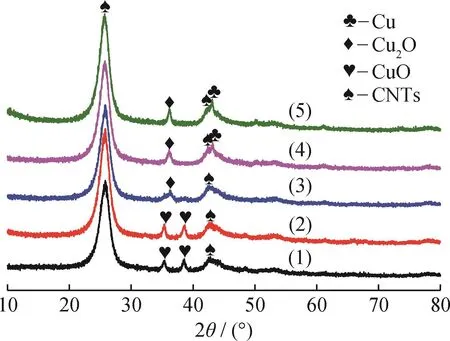
图2 CuO/CNTs在N2气氛下不同温度预处理后的XRD谱图Fig.2 XRD patterns of CuO/CNTs samples pretreated in N2 at different temperatures
图3为CuO/CNTs样品在不同温度和不同气氛下预处理后的TEM图片。从图3可以看出,CNTs的管内径和管外径分别为9~13 nm和17~35 nm,大部分CNTs的管长在微米量级,而且CNTs互相交织缠绕。由于CNTs的虹吸效应和较低的Cu担载量,大部分Cu物种选择性地进入了CNTs的孔道内部[18]。Cu物种的形貌主要包括纳米粒子和纳米线,在CNTs的限域效应下,部分Cu纳米粒子发生聚集形成了Cu纳米线。TEM图片清楚地显示,不管是预处理温度从250℃升高到550℃,还是预处理气氛为N2或H2,在CNTs孔道的限制作用下[27],Cu物种的形貌和粒径大小几乎没有发生变化。Cu纳米粒子的尺寸大小约为9~13 nm,与CNTs管内径的尺寸完全一致,Cu纳米线的长度约为17~50 nm。
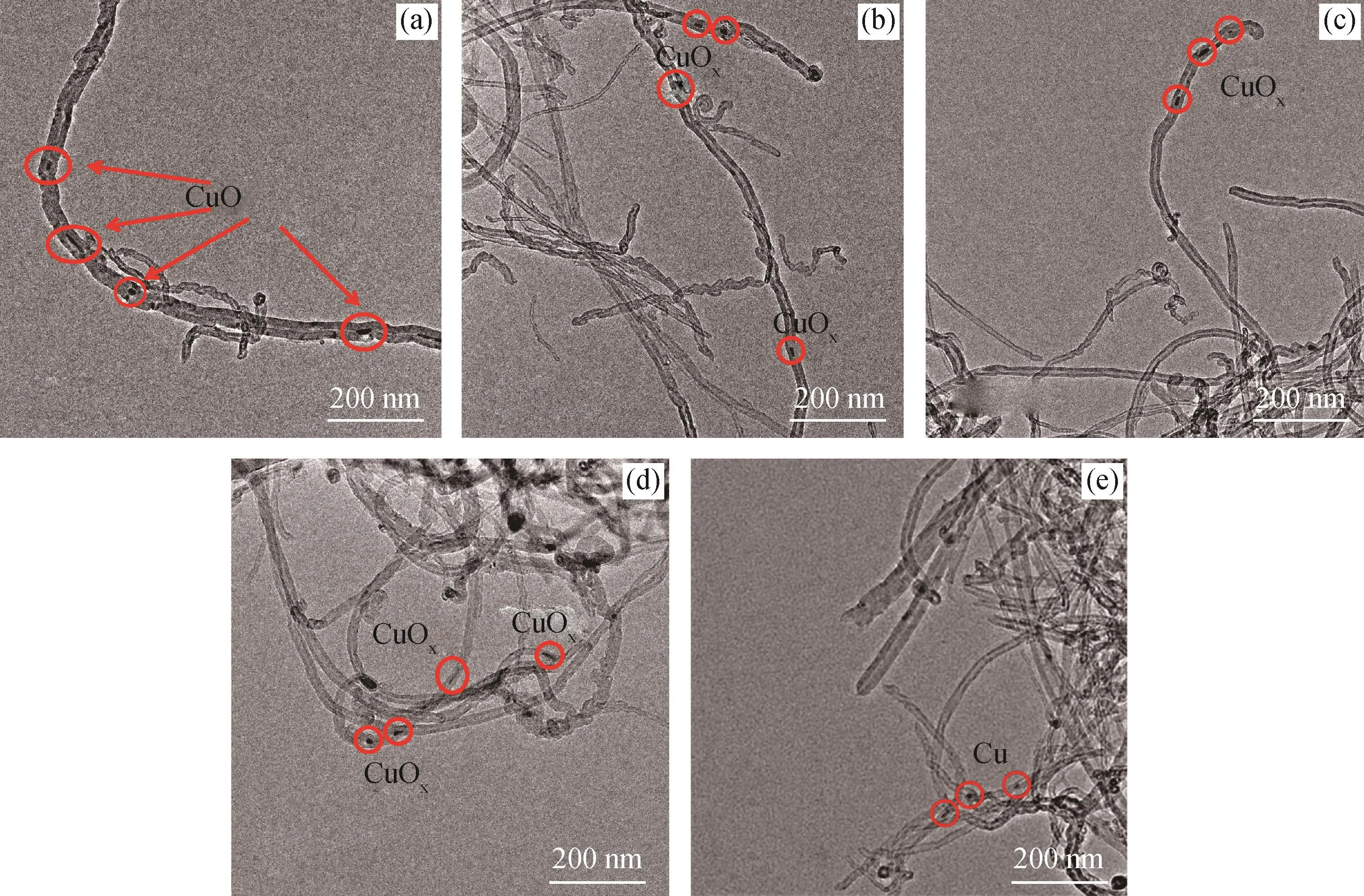
图3 CuO/CNTs样品在不同温度和不同气氛下预处理后的TEM照片Fig.3 TEM images of CuO/CNTs samples pretreated under different temperatures and atmospheres
结合XRD和TEM的结果,通过简单调变Cu O/CNTs样品的预处理气氛和温度,在不改变Cu物种形貌和粒径大小的情况下,可以有效控制Cu物种的价态分布。这样可排除Cu物种粒径大小的变化对CuO/CNTs催化丙烯环氧化反应性能的影响,以便重点研究Cu物种的价态在丙烯环氧化反应中的作用和地位。
2.2 预处理得到的CuO x/CNTs催化剂的丙烯环氧化反应性能
2.2.1 不同气氛预处理后CuOx/CNTs上丙烯环氧化反应性能
图4显示了N2或H2气氛预处理的CuOx/CNTs催化剂上环氧丙烷(PO)选择性随丙烯转化率的变化曲线,预处理温度为350℃。从图4可以看出,无论是N2预处理还是H2预处理,随着丙烯转化率的增加,Cu Ox/CNTs催化剂上环氧丙烷的选择性均单调下降。当预处理气氛为N2时,在较低的反应温度下,丙烯选择氧化反应刚刚开始,环氧丙烷的选择性最高可达55%,但是丙烯的转化率非常低,仅为0.04%。当H2预处理时,在相同的反应条件下,当丙烯转化率为0.05%时,环氧丙烷的选择性为24%,环氧丙烷的选择性大大降低。在整个反应温度范围内,当丙烯转化率相同时,N2预处理的CuOx/CNTs催化剂上环氧丙烷的选择性明显高于H2预处理的,当反应温度为250℃时,此时丙烯转化率为0.75%,环氧丙烷的选择性仍能维持在17%。图1中XRD结果表明,当N2预处理温度为350℃时,Cu Ox/CNTs催化剂中的绝大部分Cu物种是Cu2O,也就是Cu+物种;而在H2气氛下350℃预处理后,所有的Cu物种全部被还原为金属Cu0。结合图4的结果推断,与Cu0物种相比,Cu+物种具有更高的丙烯环氧化活性,更有利于环氧丙烷的生成。这可能是因为Cu+物种活化了分子氧,产生了能够生成环氧丙烷的活性氧物种。Zhu等[14]报道了碱金属修饰的Cu Ox/SiO2催化剂上丙烯氧气环氧化反应结果,他们推测Cu+物种可能是丙烯环氧化反应的活性中心,该假设与本实验结果十分一致。

图4 不同气氛下350℃预处理后CuO x/CNTs催化剂上环氧丙烷选择性(S(PO))随丙烯转化率(X(C3 H6))的变化Fig.4 PO selectivity(S(PO))as a function of C3 H6 conversion(X(C3 H6))over CuO x/CNTs catalysts pretreated at 350℃under different atmospheres
2.2.2 N2气氛下不同温度预处理后CuOx/CNTs上丙烯环氧化反应性能
为了进一步考察Cu物种价态的分布在丙烯氧气环氧化反应中的作用,不同温度N2预处理的CuOx/CNTs催化剂上环氧丙烷选择性随丙烯转化率的变化如图5所示。由图5可知,当Cu O/CNTs样品在N2气氛250℃下预处理时,其丙烯环氧化活性非常低,丙烯转化率为0.55%时,环氧丙烷的选择性仅为8%。随着N2预处理温度的升高,丙烯环氧化活性逐渐增加。当N2预处理温度为350℃时,在相近的丙烯转化率下,环氧丙烷的选择性最大,环氧丙烷的形成速率最高,当丙烯转化率为0.52%时,环氧丙烷的选择性可达23%。继续增加N2预处理温度,在维持丙烯转化率不变的条件下,环氧丙烷的选择性反而开始下降,当N2预处理温度升高到550℃时,在丙烯转化率为0.52%时,环氧丙烷的选择性迅速下降到12%。图2中XRD结果表明,随着N2预处理温度从250℃升高到550℃,Cu Ox/CNTs催化剂中Cu+物种(Cu2O)的含量先增加后下降,当N2预处理温度为350℃时,Cu+物种的含量达到最高。结合XRD结果和图5可以清楚地发现,CuOx/CNTs催化剂中Cu+物种的含量越高,丙烯环氧化活性越高,两者的变化趋势完全一致,说明在Cu2+、Cu+和Cu03个Cu物种中,Cu+物种具有最高的丙烯环氧化活性,最有利于环氧丙烷的生成,Cu+物种很可能是丙烯氧气环氧化反应的活性中心。He等[15]也提出了Cu+物种有利于丙烯氧气环氧化反应的观点,但是在他们的实验中,适量浓度的Cu+物种可以促进环氧丙烷的生成,过高浓度的Cu+物种反而会导致环氧丙烷选择性的下降。
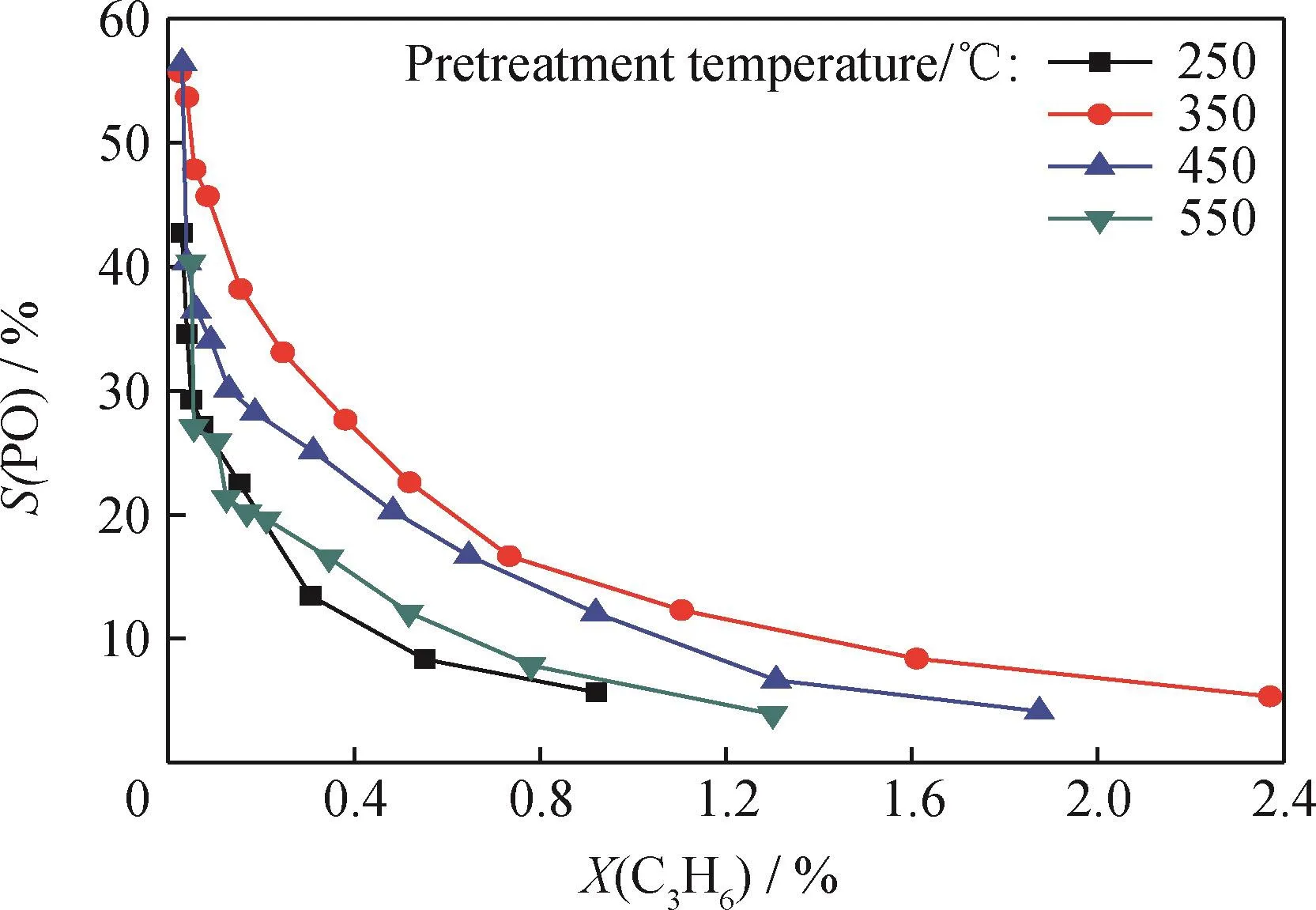
图5 不同温度N2预处理后CuO x/CNTs催化剂上环氧丙烷选择性(S(PO))随丙烯转化率(X(C3 H6))的变化Fig.5 PO selectivity(S(PO))as a function of C3 H6 conversion(X(C3 H6))over CuO x/CNTs catalysts pretreated in N2 at different temperatures
图6为在N2气氛350℃预处理后Cu Ox/CNTs催化剂上丙烯氧化产物随反应温度的分布。由图6可知,丙烯氧化产物包括环氧丙烷、丙烯醛、CO2以及少量的乙醛和丙酮,乙醛和丙酮的选择性均不超过5%。当反应温度较低为170℃时,环氧丙烷的选择性最高为55%,副产物是丙烯醛,选择性为45%,但是丙烯的转化率非常低,仅为0.04%。随着反应温度的升高,催化剂表面的Cu+物种逐渐被氧化为Cu2+物种[10],使得环氧丙烷的选择性迅速下降。随反应温度升高,丙烯醛的选择性先增加,在200℃时达到最大,为54%,然后开始下降。当反应温度超过200℃时,丙烯的转化率和CO2的选择性迅速增加,而环氧丙烷和丙烯醛的选择性持续下降,说明完全燃烧反应开始发生,而且逐渐占据主导地位。从图6还可以看出,环氧丙烷选择性的下降趋势要快于丙烯醛。当反应温度升高到280℃时,丙烯转化率快速增加到了2.4%,但是环氧丙烷的选择性只有5%,丙烯醛和CO2的选择性分别为22%和69%。图6结果说明,较低的反应温度有利于环氧丙烷的生成,但是丙烯的转化率却很低[10]。为了同时获得较好的丙烯转化率和环氧丙烷选择性,反应温度可控制在210~240℃之间。
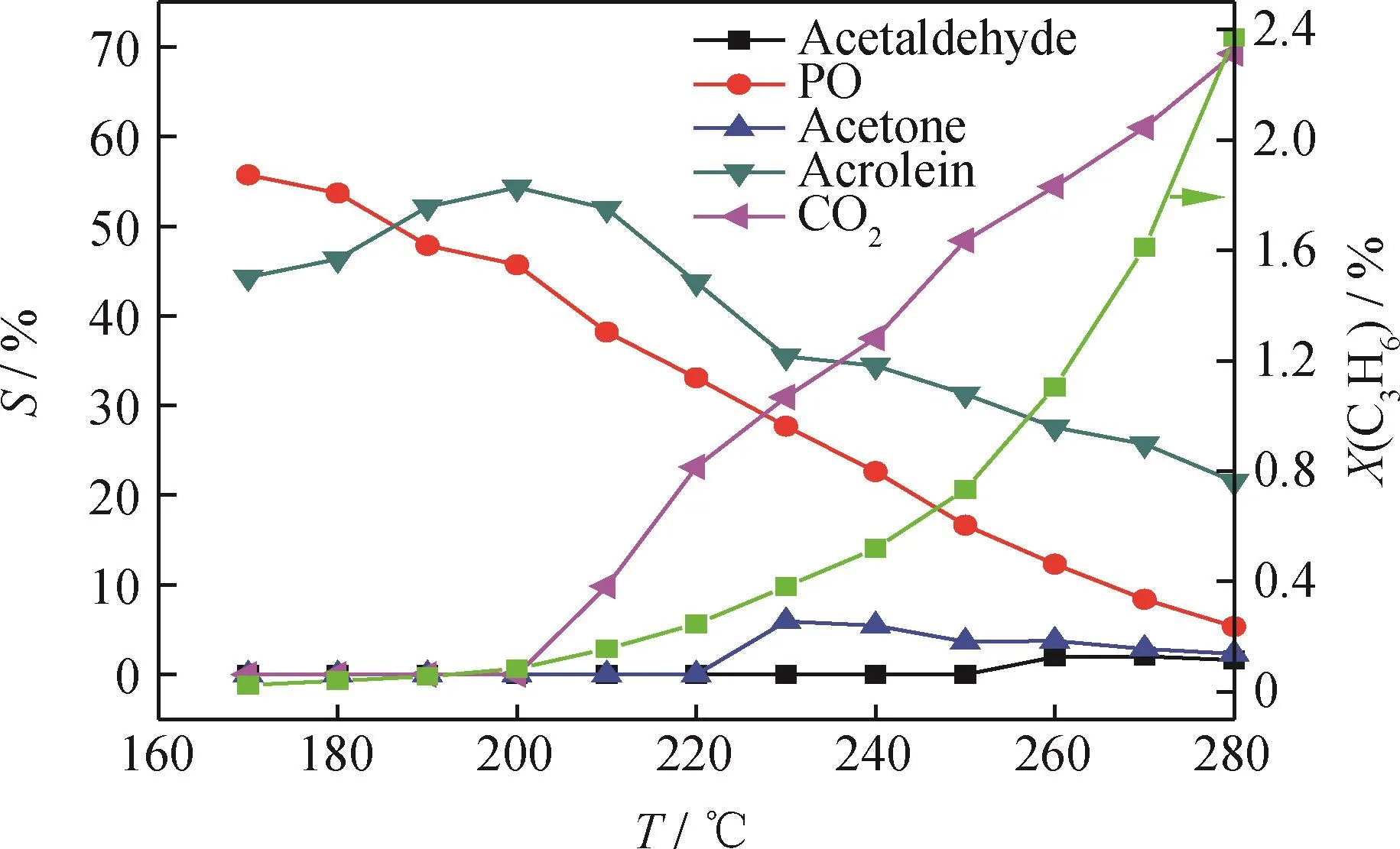
图6 N2气氛350℃预处理的CuO x/CNTs催化剂上丙烯环氧化反应的产物分布Fig.6 Production distribution in propylene epoxidation by O2 on CuO x/CNTs catalyst pretreated in N2 at 350℃
3 结 论
(1)以尿素为沉淀剂,利用均相沉积-沉淀法合成了丙烯氧气环氧化Cu Ox/CNTs催化剂。大部分Cu物种选择性地沉积在CNTs的孔道内部,主要是Cu纳米线和Cu纳米粒子。在CNTs的限域效应下,Cu物种的形貌和粒径大小几乎不随预处理气氛和温度的改变而发生变化。
(2)随着N2预处理温度的升高,在CNTs的还原作用下,Cu2+物种首先转变为Cu+物种,然后Cu+物种被深度还原为Cu0物种,Cu+物种的含量先上升后下降。N2预处理温度从250℃增加到550℃,CuOx/CNTs催化剂的丙烯环氧化活性先增加后降低,当N2预处理温度为350℃时,Cu+物种的含量和环氧丙烷的选择性均达到最大值,在240℃的反应温度下,丙烯的转化率为0.52%时,环氧丙烷的选择性为23%。Cu+物种含量越高,Cu Ox/CNTs的丙烯环氧化活性越高。
(3)Cu+物种比Cu2+和Cu0物种更加有利于环氧丙烷的生成,CuOx/CNTs中的Cu+物种很可能是丙烯氧气环氧化反应的活性中心。