脱细胞猪心包膜生物相容性及成骨性能的体内外评价
尤鹏越,刘玉华,王新知,王思雯,唐 琳
(北京大学口腔医学院·口腔医院,修复科 国家口腔医学中心 国家口腔疾病临床医学研究中心 口腔数字化医疗技术和材料国家工程实验室,北京 100081)
各种原因引起的牙齿缺失是口腔领域常见疾病之一,越来越多的患者首选种植治疗作为修复口内缺失牙的方式,而手术的可能性及长期预后往往取决于缺牙区域的骨质及骨量[1]。引导性骨再生技术(guided bone regeneration, GBR)是目前临床中促进牙槽骨再生的重要手段[2],它通过在骨缺损区域内填充骨替代材料,并覆盖屏障膜将快速生长的上皮细胞及结缔组织细胞隔离开来,使得具有骨再生潜能的细胞(如成骨细胞、牙周膜干细胞)更好地在缺损区域发挥成骨作用,以实现牙槽骨骨量及骨质的提升[3-4]。屏障膜的选择是影响GBR的重要因素之一,屏障膜应具备良好的生物相容性、屏障性、一定的机械强度、易操作性等[5]。可吸收的屏障膜因其可降解性、无需二次取出、感染及暴露风险低广受临床医生青睐[6]。来源广泛的天然胶原类可吸收膜因其是细胞外基质的重要有机成分,具有凝血、募集牙周膜干细胞及牙龈成纤维细胞等功能,同时具有半透性,能够维持营养物质交换的优势[7],成为应用最为广泛的屏障膜。但一些研究发现,这类纯胶原屏障膜在组织整合过程中,多核巨细胞及多形核白细胞等分泌的胶原酶加速胶原体内降解,使得再生过程具有不确定性[8],有研究表明它在体内4周内几乎完全降解[9-10],因此,寻找一种降解时间更适宜骨再生进程的胶原膜成为学者们研究的重点。细胞外基质膜(extracellular matrix, ECM)应运而生,成为组织再生领域重要的生物材料。ECM膜主要由猪、牛等动物的小肠黏膜下层、心包膜、真皮等组织通过脱细胞技术加工而成,保留了一定量的纤维、蛋白质、多糖等,更具备募集生长因子及组织修复相关细胞的潜力[11-12],其中脱细胞猪心包膜(acellular porcine pericardium,APP)在临床外科修复腹壁、疝、心瓣膜、硬脑膜等被证实具有良好的生物性能[13-14]。APP由Ⅰ型及Ⅲ型胶原构成,且富含弹性蛋白,使得其具备比纯胶原膜更好的机械强度[13-16];在与宿主组织作用过程中,炎症反应较轻,同时可实现良好的再细胞化及再血管化[17];有学者发现其体内降解速度更加匹配骨修复进程[18]。但对其相关性能的研究尚少见,本研究旨在评价一种新型脱细胞猪心包膜(博纳膜®,北京博纳格科技有限公司)的生物相容性,并探究其在犬拔牙窝实验模型中作为屏障膜应用时对成骨效果的影响。
1 资料与方法
1.1 主要材料与试剂
脱细胞猪心包膜(博纳膜®)由北京博纳格科技有限公司惠赠,Bio-Gide®可吸收生物膜购自瑞士Geistlich公司,Bio-Oss®去蛋白牛骨基质骨替代材料购自瑞士Geistlich公司,α-MEM培养基购自美国Hyclone公司,胎牛血清购自美国Gibco公司,青链霉素混悬液购自美国Sigma公司,0.25%(质量分数)胰蛋白酶购自美国Gibco公司,细胞增殖检测(cell counting kit-8, CCK-8)试剂盒购自日本同仁公司,FITC标记鬼笔环肽和DAPI即用型染液购自北京索莱宝公司。
1.2 主要仪器与设备
场发射扫描电镜购自德国Zeiss公司,细胞培养箱购自美国Thermo公司,酶标仪购自美国Biotek公司,激光共聚焦显微镜购自德国Leica公司,Micro-CT购自美国Siemense公司,轮式组织切片机购自德国Microm公司,光学显微镜购自日本Olympus公司。
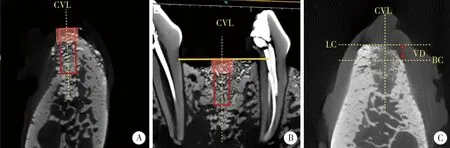
A, coronal view of region of interest (ROI); B, saggital view of ROI; C, central vertical line (CVL). BC, buccal crest; LC, lingual crest; VD, vertical distance.图1 ROI区域的选择及颊舌侧骨嵴顶高度的测量Figure 1 Choosing method of ROI and measurement of the vertical distance between the buccal and lingual(palatal) crest

A, smooth side of acellular porcine pericardium (APP); B, rough side of APP; C, cross section of APP.图2 APP微观形貌(×300)Figure 2 Microstructure of APP (×300)
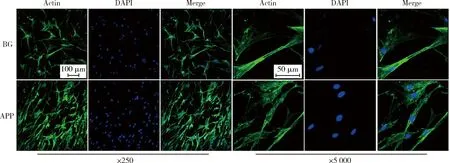
The left three rows were viewed at 250 magnification and the right three were at 5 000 magnification. Actins of cells were shown in green and nuclei were blue. APP, acellular porcine pericardium; BG, Bio-Gide.图3 hBMSCs不同膜上的增殖及黏附形貌Figure 3 CLSM view of the morphology of hBMSCs cultured on BG or APP membranes
1.3 APP膜微观形貌观察
将APP膜裁剪为0.5 cm×0.5 cm大小,经金属离子溅射仪对试样进行喷金处理后,场发射扫描电镜观察其微观结构。
1.4 APP膜体外生物相容性检测
1.4.1骨髓间充质干细胞增殖实验 将APP膜、Bio-Gide膜裁剪为5 mm直径圆形试样,置于96孔板,使用培养基预孵24 h。提取培养人骨髓间充质干细胞(human bone marrow mesenchymal stem cells, hBMSCs),将P4代hBMSCs以5×103个/孔接种于膜上,在培养第1、3、7天依照CCK-8试剂盒说明书测定细胞增殖情况。每组3个复孔,实验重复3次。
1.4.2骨髓间充质干细胞增殖形态观察 接种方法同1.4.1小节,在培养至第5天时,4%(体积分数)多聚甲醛固定细胞15 min,0.5%(质量分数)Triton-X100透化10 min,5%(质量分数)BSA封闭1 h,加入1 ∶200(体积比)稀释的鬼笔环肽工作液,室温避光孵育30 min,PBS充分清洗后,加入DAPI(4,6-diamidino-2-phenylindole)染液复染细胞核30 s,激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察。
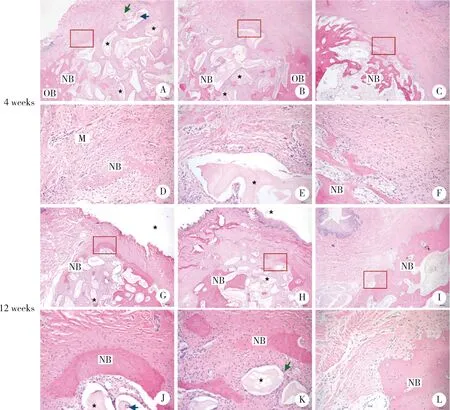
APP group after 4 weeks’ healing (A, ×40; D, ×200), after 12 weeks’ healing (G, ×40; J, ×200); BG group after 4 weeks’ healing (B, ×40; E, ×200), after 12 weeks’ healing (H, ×40; K, ×200); blank group after 4 weeks’ healing (C, ×40; F, ×200), after 12 weeks’ healing (I, ×40; L, ×200). Asterisk, graft particles; NB, new bone; OB, old bone; blue arrow, osteoblast grew into the graft particles; green arrow, osteoid; M, membrane.图5 各组冠方愈合4周及12周情况观察Figure 5 Histological observations of coronal part of extraction sockets after healing of 4 weeks or 12 weeks
1.5 犬牙槽嵴保存动物实验
1.5.1实验动物 选取3只雄性比格犬, 18~24月龄,12~14 kg(购自北京市昌扬西山养殖场,饲养于军事医学科学院),入住至少7 d后开始实验。动物全程饲以软食。本实验开始前已经北京大学生物医学伦理委员审查批准(LA2018293)。
1.5.2实验分组 拔除比格犬一侧上下颌第一前磨牙及第二前磨牙远中根(近中根完善根管治疗),作为术后12周组实验位点,选取其中9个位点,随机分入以下3组:(1)APP组:拔牙窝内植入Bio-Oss骨粉并覆盖APP膜,严密缝合;(2)BG组:拔牙窝内植入Bio-Oss骨粉并覆盖Bio-Gide膜,严密缝合;(3)空白组:自然愈合。8周后,拔除另一侧上下颌第一前磨牙及第二前磨牙远中根,选取其中9个位点,处理方法同1.5.1,作为术后4周组实验位点。
1.5.3实验方法 异氟烷吸入麻醉下,1%(质量分数)碘伏消毒动物口周,0.12%(质量分数)氯己定溶液消毒口内术区。使用涡轮手机水冷下沿第二前磨牙(P2)中央颊沟分冠达根分叉处,近中根开髓、根管治疗、树脂充填。使用牙龈分离器分离牙龈,微创拔除P1及P2远中根。翻开颊舌(腭)侧牙龈全厚瓣,将APP膜或BG膜修剪至合适大小,将膜一端插入舌(腭)侧牙龈与骨板间,填充无菌生理盐水适当润湿后的骨粉至平齐牙槽嵴顶,将膜另一端盖过拔牙窝插入颊侧牙龈与骨板间,严密缝合。术后8周另一侧进行相同手术。术后3 d予动物肌肉注射80万单位青霉素钠,每天进行口腔冲洗,饲软食,定期复查伤口愈合情况。术后12周空气栓塞法处死动物,截取上下颌骨P1、P2处标本,10%(体积分数)中性甲醛溶液固定24 h。
1.5.4Micro-CT检测 将所获取的标本进行Micro-CT扫描,扫描条件为电压80 kV,电流500 μA,曝光时间1 000 ms。使用分析软件Inveon Research Workplace 4.2在每个位点最中央选取感兴趣区域(region of interest, ROI,图1A、B),以经过近远中骨嵴顶连线并垂直于拔牙窝轴线的平面为ROI上界,圈选以拔牙窝轴线为中轴的直径为3 mm、高8 mm的圆柱形为ROI-1,圈选直径4.5 mm、高3 mm的圆柱形为ROI-2,计算各组ROI内软组织体积、新生骨体积、骨髓腔体积及剩余骨移植材料体积。同时,测量各位点颊舌(腭)侧骨嵴顶高度差(图1C),在拔牙窝冠状面上,校正拔牙窝中线垂直于水平面,过颊舌(腭)侧骨嵴顶做平行于水平面的直线,测量两条线之间的距离。
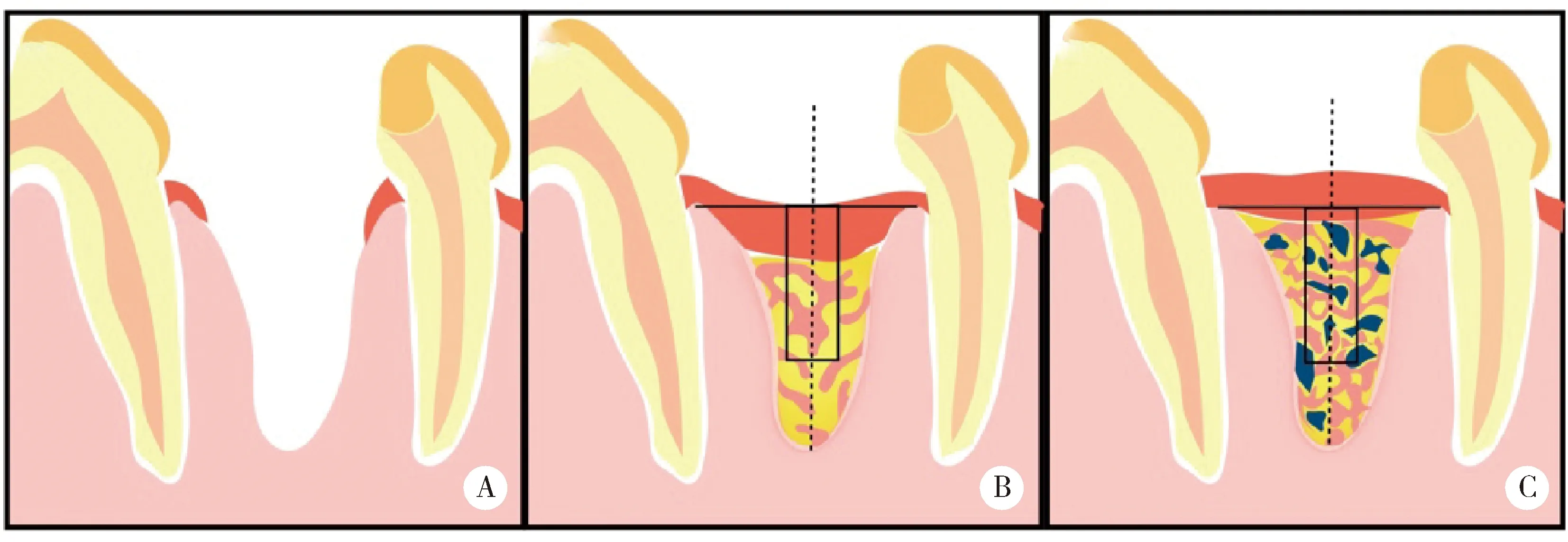
A, alveolar socket after tooth extraction; B, blank group after healing, soft tissue grew in and vertical bone lost; C, APP group or BG group after healing, less soft tissue grew in and less vertical bone lost.图6 ROI区域示意图Figure 6 Schematic diagram of ROI area
1.5.5组织学观察 CT扫描后将标本置于17%(质量分数)EDTA溶液中脱钙6个月,石蜡包埋,切取5 μm切片,进行HE染色。
1.6 统计学分析
采用SPSS 22.0软件,计量资料以均数±标准差表示,CCK-8数据选用独立样本t检验,CT数据采用单因素方差分析,组间比较采用 LSD 法,P<0.05认为差异具有统计学意义。
2 结果
2.1 APP膜微观形貌观察
APP膜具有天然的双面性,一面相对光滑(图2A),具有天然的微皱褶,一面相对粗糙(图2B),截面可见胶原束相互交错,形成天然多孔等级结构,粗糙面侧孔径较小,中央孔径最大,光滑面侧孔径居中,孔内可见纤维微丝(图2C)。
2.2 APP膜体外生物相容性检测
2.2.1骨髓间充质干细胞增殖实验 CCK-8实验显示,接种后第1天,APP组的光密度值为0.193,BG组为0.177,差异无统计学意义(P>0.05);接种后第3天,APP组光密度值增长至0.231,BG组为0.220,差异无统计学意义(P>0.05);第7天,APP组进入倍增期,光密度值为0.529,显著高于BG组(光密度值0.341,P<0.05)。
2.2.2骨髓间充质干细胞增殖形态观察 接种5 d后hBMSCs在两种膜上都呈现出较好的黏附状态,可见舒展的细胞结构、沿胶原束延伸的细胞骨架,并可观察到APP上的细胞增殖数量明显多于BG膜(图3)。
2.3 犬牙槽嵴保存动物实验
实验期间各组动物健康状态良好,手术伤口愈合正常,未出现伤口开裂、感染、骨粉暴露等。
2.3.1Micro-CT结果 ROI-1表征拔牙窝整体愈合情况,术后4周(表1),空白组新生骨比例略高于APP组及BG组,但差异无统计学意义(P>0.05),空白组骨髓腔所占比例显著低于APP组及BG组,冠方软组织体积显著高于APP组及BG组(P<0.05),APP组及BG组各类组织分布比例相近,差异无统计学意义(P>0.05)。术后12周(表1),APP组及BG组新生骨比例均明显高于术后4周空白组(P<0.05),组间差异无统计学意义,空白组新生骨比例低于术后4周,但结果差异无统计学意义(P>0.05),APP组及BG组骨髓腔比例较术后4周明显降低(P<0.05),并显著低于空白组(P<0.05), 空白组骨髓腔比例较术后4周略有升高,结果差异无统计学意义(P>0.05),APP组冠方软组织比例较术后4周明显减小(P<0.05),BG组略有减小,差异无统计学意义(P>0.05),两组软组织比例均显著低于空白组,两组剩余骨移植物比例随时间无显著变化(P>0.05)。ROI-2表征拔牙窝入口处(膜下方)愈合情况,分析发现(表2),术后4周,APP组及BG组冠方新生骨比例、骨髓腔比例显著高于空白组(P<0.05),冠方软组织比例显著低于空白组(P<0.05),组间各组织比例差异无统计学意义(P>0.05)。术后12周,APP组冠方新生骨比例显著高于BG组(P<0.05),两组均较空白组显著高(P<0.05),各组比例均较对应术后4周组明显上升(P<0.05),APP组及BG组骨髓腔体积均较对应术后4周降低,其中,APP组差异有统计学意义(P<0.05),空白组变化不明显(P>0.05)。各组软组织比例均较术后4周下降,APP组及BG组软组织比例显著低于空白组(P<0.05)。测量各组不同时间点颊舌侧骨嵴顶高度差发现(表3),术后4周及12周,APP组骨嵴顶高度差与BG组差异无统计学意义(P>0.05),但显著低于空白组(P<0.05)。各组术后12周骨嵴顶高度差均较4周增大,但差异无统计学意义(P>0.05)。
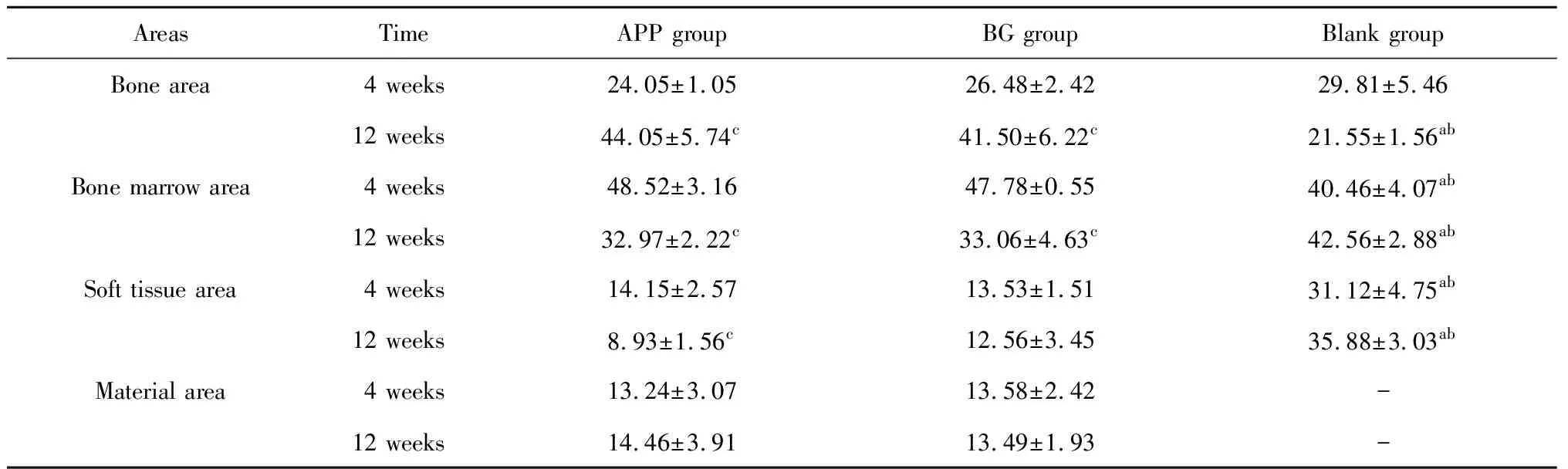
表1 术后4周、12周各组ROI-1区域不同组织所占比例Table 1 Percentage of different areas in ROI-1 at 4 weeks and 12 weeks /%
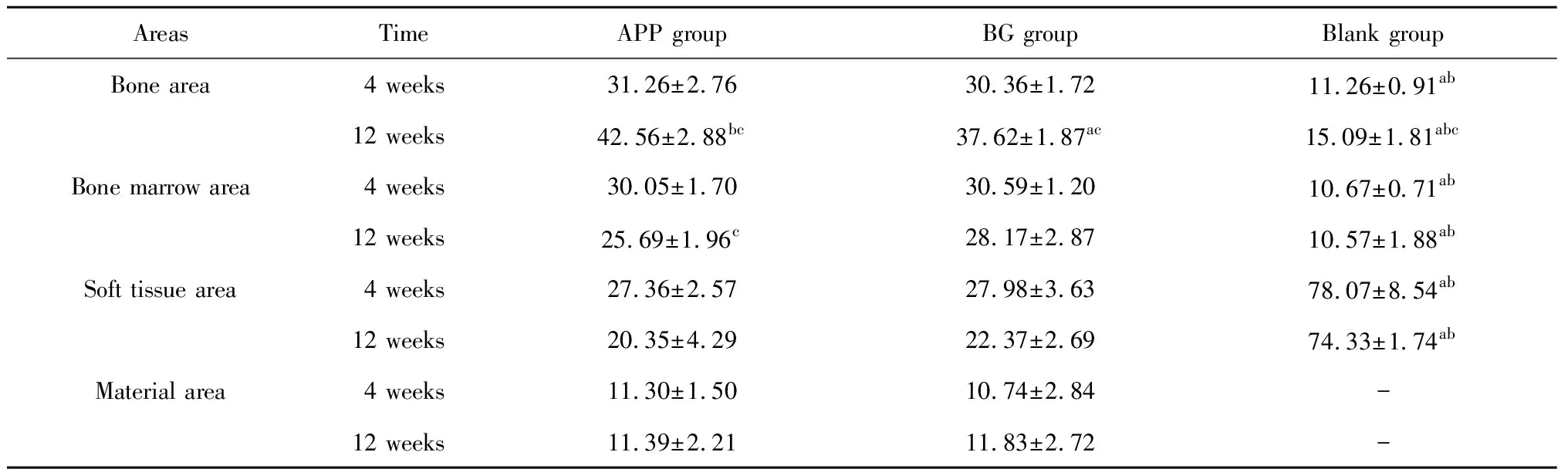
表2 术后4周、12周各组ROI-2区域不同组织所占比例Table 2 Percentage of different areas in ROI-2 at 4 and 12 weeks /%
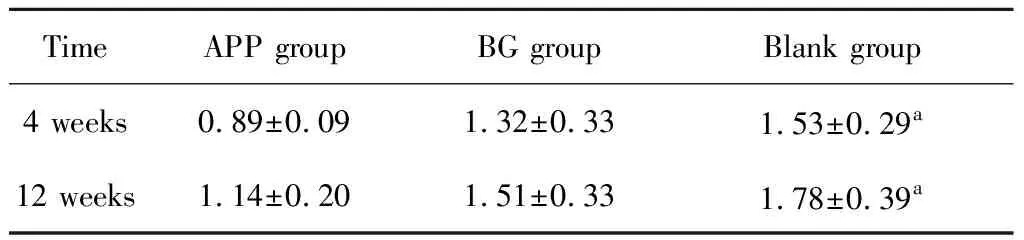
表3 术后4周、12周各组颊舌侧骨嵴顶高度差Table 3 Vertical distance of buccal and lingual crest /mm
2.3.2组织学观察 术后4周(图4A~F),各组均可见新生的未成熟编织骨结构,与旧骨界限清楚,新生骨小梁外周可见大量成骨细胞排列。APP组及BG组新骨主要由拔牙窝壁周围向中央生长,中央可见大量未矿化纤维骨基质组织及骨粉之间不同程度矿化的骨岛,一些骨粉颗粒内部可见成骨细胞长入,周围可见类骨质沉积。空白组内部可见均匀的新生编织骨,连通性较差,个别骨小梁表面可见多核破骨细胞,可及部分纤维骨基质组织,中部及根方可见大量脂肪空泡组织及小血管。观察冠方组织(图5A~F),APP组冠方可见部分膜残留及孤立骨岛,BG组膜几乎降解完全,新骨局限在骨嵴顶周围,两组冠方均未见新骨封闭入口,但骨基质具有凸起、丰满的形态。空白组冠方有较多编织骨形成,但丰满度较差。术后12周(图4G~L),APP组膜降解完全,APP组及BG组新生骨较术后4周明显成熟,与旧骨界限不清,新生骨外周成骨细胞较前减少,内部可见发育中的骨单位,中央仍可见不同程度矿化的骨岛。APP组及BG组依然维持着较好的冠方组织丰满度(图5G~L), APP组拔牙窝入口处观察到更多的凸形排列的新生骨,表面仍有成骨细胞,与上方结缔组织间有一层骨基质存在,BG组也可以见冠方部分成骨,少于APP组。空白组骨小梁改建吸收明显,冠方形成较成熟的皮质骨,形态凹陷,表面凹凸不平,有较为成熟的骨膜样组织形成。
3 讨论
本研究发现APP膜具有天然的双面性。天然心包膜由浆膜层、纤维层、脂肪层构成[19],浆膜层表面排布单层间皮细胞,脱细胞处理后,细胞及脂肪层被去除,浆膜层呈现出光滑的微皱褶形貌,纤维层与脂肪层交界处呈现粗糙的表面形貌。同时,本研究还发现APP膜具有三维多孔等级结构,有利于营养物质的交换,并且,其孔径相对较小的一侧可发挥体内屏障作用,阻挡软组织长入骨缺损,孔径较大一侧利于成骨相关细胞黏附及骨基质沉积,促进冠方成骨[20]。
本研究通过细胞增殖实验证实,APP膜和BG膜均能够促进人骨髓间充质干细胞在表面的增殖,APP膜在第7天表现出更强的促进能力,与Rothamel等[18]研究结论一致。另一项研究发现[21],人牙龈成纤维细胞在APP膜上也实现了良好的增殖及黏附。目前,关于膜在GBR中的分子学及细胞学机制尚不明确。本研究发现APP膜冠方成骨稍好于BG膜,PP膜是常见的ECM材料之一,主要成分为Ⅰ型及Ⅲ型胶原,脱细胞后仍较好地保持原有ECM结构,天然的ECM结构可能会引起体内细胞的行为响应,促进其增殖、分化等。此外,心包膜在脱细胞后残留的一定量糖胺聚糖、糖蛋白是介导细胞黏附、生长的重要因子[11,22]。既往多项研究发现了脱细胞心包膜在不同领域的再生潜质,Rajabi-Zeleti等[23]发现脱细胞心包膜可促进心肌祖细胞向心肌细胞分化;Megerle等[24]发现脱细胞心包膜可促进人腱鞘滑膜细胞及人脂肪干细胞分泌透明质酸,具备促进腱鞘滑膜再生的潜质;Pizzicannella 等[25]发现脱细胞心包膜可作为牙周膜干细胞及内皮细胞共培养的三维平台,促进体外成骨成血管进程。本研究发现APP膜表面更利于骨髓间充质干细胞增殖,体内实验可观察到APP膜较BG膜更多的膜下方成骨及更低的颊侧骨嵴顶改建程度。
本研究通过体内犬牙槽嵴保存动物实验探究了APP膜作为GBR屏障膜的作用效果,实验采用了Micro-CT和组织学评价的方法。APP组及BG组总体成骨效果差异无统计学意义,但通过对冠方组织的Micro-CT分析及组织学观察可发现两组冠方成骨的差异。术后4周,两组膜下方成骨量差异无统计学意义,但组织学观察发现,BG组冠方成骨多与骨嵴顶相连,而APP组冠方成骨除骨嵴顶长出外,可观察到膜下方的孤立骨岛;术后12周,APP组冠方成骨显著多于BG组。
有关Micro-CT新生骨测量方法是研究者需要考虑的问题,本研究方法基于Saulacic等[26]的ROI区域测量方法改进而来,一方面,该方法可避免由于术后12周新旧骨界限不清,难以圈选整个牙槽窝范围及圈选到旧骨造成结果偏高等问题;另一方面,由于牙槽窝壁周围接触成骨速度快于植骨材料周围成骨,圈选中央部分分析更能客观反映GBR的成骨情况;同时,牙槽窝近远中骨嵴顶因附着于邻牙,高度相对稳定,可作为参考线[26],ROI区域内冠方测量的软组织体积可作为衡量拔牙后牙槽嵴高度变化的参考,并辅助表征膜屏障效果。因此,本研究以经近远中骨嵴顶连线且垂直于牙槽窝长轴的平面作为参考平面,在圈选牙槽窝中央圈选圆柱形ROI(图6)。
本研究术后4周各组新生骨量差异无统计学意义,术后12周APP组及BG组新生骨量显著多于空白组,组织学观察到它们的编织骨小梁进一步矿化成更成熟的层板骨,冠方新生骨不连续,但形态饱满、凸起,骨小梁周围可观察到较多成骨细胞排布及矿化中的骨基质,表明屏障膜在体内较好地维持了成骨空间,与Saulacic等[26]、Kim等[27]研究发现的牙槽嵴保存体内愈合过程相似。而空白组冠方形成了较为成熟的皮质骨,但表面可见凹凸不平的骨陷窝,在成熟过程中骨小梁数目明显变少,牙槽窝内部主要为富含脂肪空泡的骨髓腔,有研究认为可能是软组织的长入引入破骨细胞所致[4]。通过使用屏障膜,在阻挡软组织长入的同时,也一定程度降低了破骨细胞对早期成骨过程的影响。
颊舌侧骨高度差是既往研究中多用的衡量牙槽嵴保存效果的另一指标[27-29]。本研究发现空白组颊侧骨嵴顶吸收多于APP组及BG组,表现出明显的骨改建吸收,测量出的数据结果与既往研究结果较为一致[27-29],其原因可能是在牙齿拔除后,束状骨迅速改建,一方面表现为拔牙窝内大量编织骨形成,另一方面主要由束状骨构成的颊侧骨板在前4周内厚度明显减小、高度明显降低,而舌(腭)侧骨板因还含有层板骨组成,在改建过程中骨嵴顶高度变化不显著[30]。通过进行牙槽嵴保存,使骨移植物周围及膜下方成骨在一定程度可以弥补束状骨改建过程中造成的骨吸收,同时促进拔牙窝内形成更好的骨质[3,31]。
综上所述,APP膜具有良好的三维结构及细胞相容性,在犬牙槽嵴保存动物实验中,与Bio-Gide膜屏障效果相似。此外,本研究证实其与Bio-Gide膜相比可更好地促进膜下方成骨及减少颊侧骨嵴顶吸收。据此可推测,APP膜不单在体内起到被动屏障的作用,还可能募集成骨相关细胞,促进其增殖分化,具有骨组织工程支架潜质。当然,关于APP膜确切的骨诱导潜质及在GBR中的细胞机制尚待进一步研究。
[志谢:感谢北京博纳格科技公司为本实验提供脱细胞心包膜(博纳膜®)材料。]

