韭菜缓慢生长法离体保存技术研究
肖婉露 马培芳 李延龙 张伟 王继芸 陈建华
摘 要:为探索缓慢生长法离体保存技术在韭菜中的应用,以航研998为试验材料,利用植物组织培养法,在MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1的基本培养基中添加不同浓度的山梨醇、琼脂、蔗糖、矮壮素(CCC)和脱落酸(ABA)对韭菜组培苗进行保存,每隔20 d调查1次组培苗的不定芽数、株高和存活率。结果表明,20 g·L-1的山梨醇、70 g·L-1的蔗糖、250 mg·L-1的CCC和1.0 mg·L-1的ABA均能有效抑制韭菜组培苗的生长,且在保存120 d后保持较高的成活率和良好的生长表现。研究结果为韭菜缓慢生长法离体保存体系的建立提供了理论依据。
关键词:韭菜;缓慢生长;离体保存;种质资源
中图分类号:S633.3 文献标志码:A 文章编号:1673-2871(2021)07-071-05
Study on slow growth conservation in vitro of Chinese chive
XIAO Wanlu1, MA Peifang1,2, LI Yanlong1,2, ZHANG Wei1,2, WANG Jiyun1,2, CHEN Jianhua1,2
(Pingdingshan Academy of Agricultural Sciences, Pingdingshan 467001, Henan, China; Henan Chinese Chive Engineering Technology Research Center, Pingdingshan 467001, Henan, China))
Abstract: In order to explore the application of slow growth conservation in vitro of Chinese Chive, Hangyan 998 was cultured on the base medium (MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1) containing with different concentractions of sorbitol, agar, sucrose, CCC and ABA, the shoot number, height and survival rate of regenerated plantlets were investigated every 20 days. The results showed thatsorbitol at 20 g·L-1, sucrose at 70 g·L-1, CCC at 250 mg·L-1 and ABA at 1.0 mg·L-1 were all found obvious inhibition effects on the growth of seedlings, with quiet high survival rate and good growth status after 120 days. It provides a theoretical foundation for the establishing of slow growth conservation in vitro system of Chinese chive.
Key words: Chinese chive;Slow growth;In vitro conversation;Germplasm resources
韭菜是石蒜科(Amaryllidaceae)蔥属(Allium)多年生草本植物,含有特殊的辛香味,叶和花茎均可食用;种子中含有大量的生物碱和皂苷,具有补肝肾、暖腰膝和壮阳固精的作用;根则含有丰富的硫化物、苷类,具有温中、行气、散淤和解毒的功效。因此,韭菜是一种食用和药用价值都很高的营养保健蔬菜[1]。目前韭菜种质资源的保存大多是采用传统的田间种植种质保存法,这种方法不仅容易受到病毒感染、病虫害侵袭或自然灾害等现象的限制,而且占用大量场地,浪费大量的人力、财力和物力[2]。另外,韭菜种子常温贮藏条件下,寿命较短,一般不超过1年,而在低温库,虽然贮藏时间较长,但是发芽率不高。通过组培苗进行种质保存可以克服传统方法的一些缺点,但是不断继代又会引起资源染色体和基因型变异,也可能导致培养细胞的全能性丧失,甚至丢失一些宝贵的特殊性状。所以,探索出一套符合韭菜特点的种质资源保存方法是非常必要的。
缓慢生长法离体保存技术是以植物组织培养技术为基础,通过改变培养条件,如调节渗透压、添加调节物质、降低培养温度等方式延缓或停止植株生长,需要时立即恢复生长并再生植株的方法[3]。通过该方法可以大大延长组培苗继代周期。常用的高渗物质有山梨醇、蔗糖、琼脂、甘露醇等,其作用在于提高培养基的渗透压,减弱细胞新陈代谢,同时抑制细胞壁酶活性,减少营养物质消耗从而使得组培苗生长缓慢[4]。此外,CCC(矮壮素)和ABA(脱落酸)、B9(丁酰肼)、PP333(多效唑)等植物生长延缓剂和抑制剂,也能够有效抑制植物生长[5]。缓慢生长法离体保存技术目前已经广泛应用于马铃薯、绣线菊、黄菠萝、黄精、蝴蝶兰等[5]植物,但是在韭菜上的应用还未见相关报道。笔者利用所在课题组已建立的韭菜组织培养技术,选取韭菜根尖作为外植体,通过调节山梨醇、蔗糖、琼脂、CCC和ABA的浓度来探索适用于韭菜缓慢生长的最适条件,旨在为韭菜缓慢生长法离体保存技术的建立奠定理论基础。
1 材料与方法
1.1 供试材料及处理
试验于2019年9月10日至2020年1月12日在河南省平顶山市农业科学院生物实验室进行,试验品种为航研998,是平顶山市农业科学院培育的抗寒性品种。
将盆栽韭菜新发的整齐一致的根尖作为外植体,MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1、pH值6为基本培养基,在温度(25±2)℃、光暗周期14 h/10 h、光照度2500 lx的条件下进行增殖扩繁30 d,所得无菌苗供试验所用。
1.2 试验设计及方法
挑选长势相近的韭菜组培苗根尖,剪取长0.5~1.0 cm作为外植体。以MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1分别添加不同浓度的山梨醇、琼脂、蔗糖、CCC和ABA保存组培苗作为不同处理,以MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1+蔗糖10 g·L-1+琼脂6 g·L-1,(适于韭菜正常生长的蔗糖和琼脂含量)保存组培苗作为对照。每个处理接4瓶,每瓶接4株,设5次重复。在保存20、40、60、80、100、120 d时分别测定其不定芽数、株高及存活率。
接种在超净工作台(苏净安泰SW-CJ-1CU)上进行,保存在平顶山市农业科学院组培室,株高的测量用直尺在培养瓶外操作,避免污染。
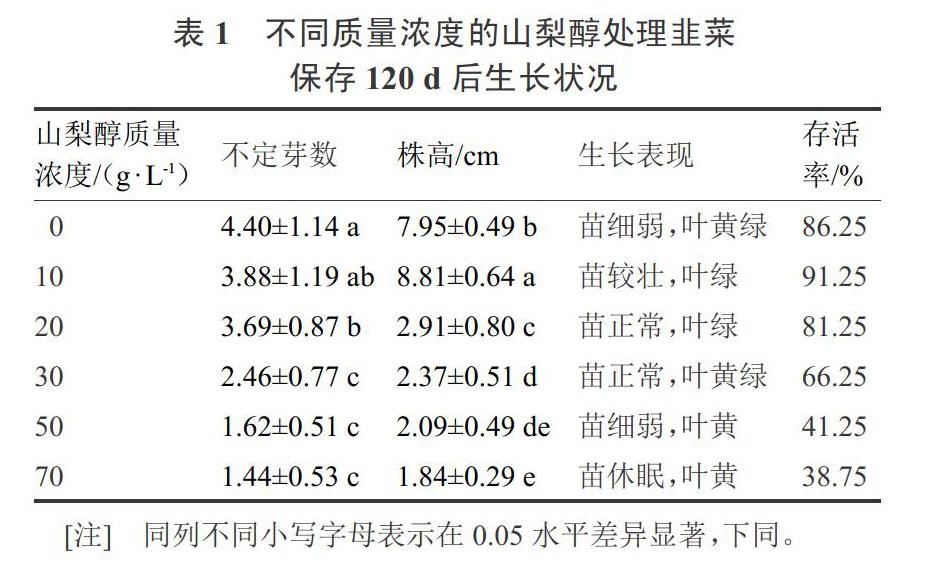
1.2.1 不同质量浓度山梨醇处理保存韭菜组培苗 以MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1、pH值6、琼脂质量浓度6 g·L-1、蔗糖质量浓度10 g·L-1为基本培养基,分别添加0、10、20、30、50、70 g·L-1山梨醇,对韭菜组培苗进行保存。
1.2.2 不同质量浓度琼脂处理保存韭菜组培苗
以MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1、pH值6、蔗糖质量浓度10 g·L-1为基本培养基,分别添加4、6、10、14 g·L-1琼脂,对韭菜组培苗进行保存。
1.2.3 不同质量浓度蔗糖处理保存韭菜组培苗
以MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1、pH值6、琼脂质量浓度6.0 g·L-1为基本培养基,分别添加10、30、50、70、90、120 g·L-1蔗糖,对韭菜组培苗进行保存。
1.2.4 不同质量浓度CCC处理保存韭菜组培苗 以MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1、pH值6、琼脂质量浓度6 g·L-1、蔗糖质量浓度10 g·L-1为基本培养基,分别添加0、50、100、150、200、250、300 mg·L-1CCC,对韭菜组培苗进行保存。
1.2.5 不同质量浓度ABA处理保存韭菜组培苗
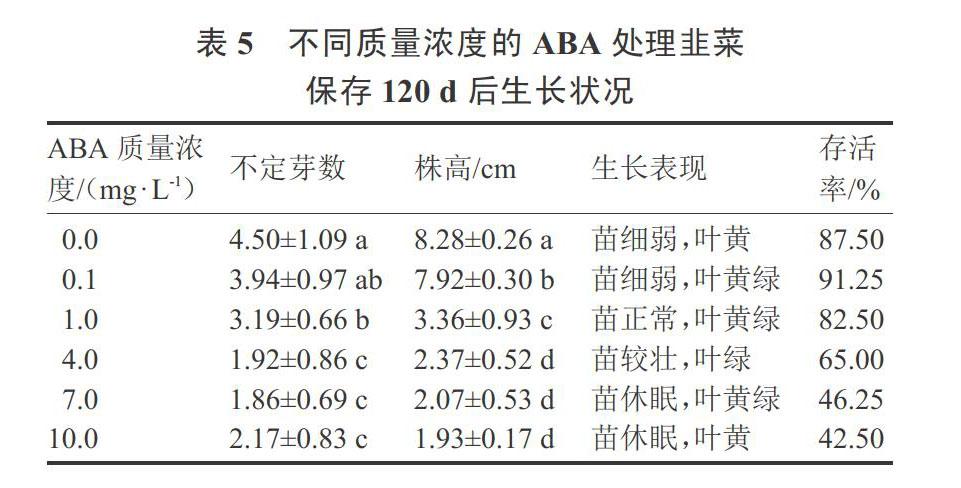
以MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1、pH值6、琼脂质量浓度6 g·L-1、蔗糖质量浓度10 g·L-1为基本培养基,分别添加0、0.1、1.0、4.0、7.0、10.0 mg·L-1ABA,对韭菜组培苗进行保存。
1.3 数据统计与分析
采用Excel 2007处理试验数据及作图,采用SPSS 19进行单因素显著性方法分析,用Duncan检验法对显著性进行多重比较。
2 结果与分析
2.1 不同质量浓度的山梨醇对韭菜保存的影响
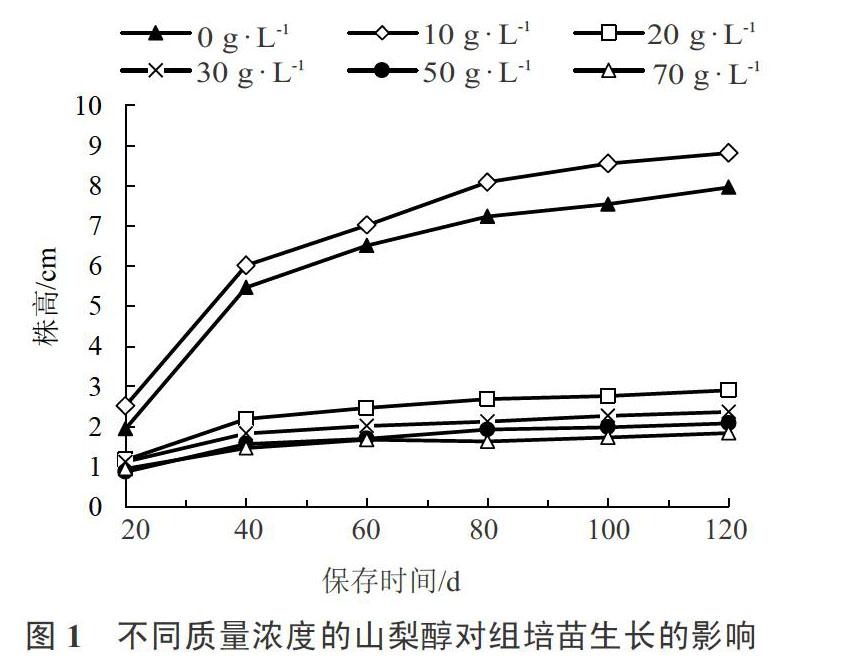
不同质量浓度的山梨醇影响下韭菜组培苗的生长趋势如图1所示。从中看出添加10 g·L-1的山梨醇的组培苗和对照组(0 g·L-1)相比较生长没有受到抑制,反而得到一定程度的促进。但是添加山梨醇质量浓度20~70 g·L-1的组别,组培苗的株高随着时间的增加增长非常缓慢,在同一保存时间株高远低于对照组,可见这几组韭菜组培苗的生长均受到了抑制。
在添加不同浓度山梨醇的培养基上保存120 d后的生长状况见表1。从中可以看出添加山梨醇质量浓度30~70 g·L-1的组别,随着质量浓度的增加,组培苗的存活率有逐步下降趋势,甚至添加山梨醇质量浓度70 g·L-1培养120 d后组培苗大部分死亡或者休眠。而添加20 g·L-1山梨醇保存的组培苗在120 d后存活率是81.25%,相对不添加山梨醇的组(存活率86.25%)并没有大幅度下降,而且此时组培苗的生长表现良好。且此浓度下,株高显著低于0 g·L-1和10 g·L-1组。所以本试验中最适宜韭菜保存的山梨醇质量浓度是20 g·L-1。
2.2 不同质量浓度的琼脂对韭菜保存的影响
由图2可知,随着保存时间的增加,4组处理的组培苗株高增长趋势没有很大的区别。在保存时间相同时,添加琼脂质量浓度10 g·L-1和14 g·L-1处理株高低于4 g·L-1和6 g·L-1处理,但是差别不大。
从表2可以看出,不同条件保存120 d后的组培苗株高没有明显差距,株高最低组(琼脂质量浓度14 g·L-1)、最高组(琼脂质量浓度6 g·L-1)相比,平均株高僅少了1.29 cm。且除了琼脂质量浓度14 g·L-1组外,其他3组株高没有显著差异。从生长表现来看,这4组也基本没有区别。
2.3 不同质量浓度的蔗糖对韭菜保存的影响
从图3可知,蔗糖质量浓度30、50 g·L-1处理和对照组相比生长趋势一致,同一时间株高没有明显的差别。蔗糖质量浓度70、90和120 g·L-1处理的组培苗则生长非常缓慢,在保存时间相同时株高明显低于对照组。
从表3可以看出,添加蔗糖质量浓度30~70 g·L-1保存的组培苗120 d后的存活率与对照组相比没有明显下降,而90 g·L-1和120 g·L-1组与对照组相比,存活率和不定芽数均大幅下降。蔗糖质量浓度120 g·L-1的条件下,存活率只有42.5%,而且组培苗大量休眠。本试验中最适合韭菜保存的蔗糖质量浓度是70 g·L-1,此质量浓度下组培苗的株高显著低于10~50 g·L-1处理。
2.4 不同质量浓度的矮壮素(CCC)对韭菜保存的影响
由图4可知,CCC质量浓度50~150 mg·L-1处理和对照组相比生长趋势一致,在培养时间相同时,株高略低于对照组,但差别不大。质量浓度200 mg·L-1时,同一保存时间组培苗的株高则明显低于对照。随着CCC质量浓度的进一步增加,250 mg·L-1和300 mg·L-1处理的株高和对照组相比有了更大幅度的下降,且两者之间没有明显差异。
从表4可以看出,CCC质量浓度50~250 mg·L-1的处理120 d后组培苗的存活率(80%~87.5%)和对照组(92.5%)相比均有所下降但幅度不大,而300 mg·L-1处理120 d后存活率只有37.5%,而且韭菜苗大部分休眠,叶片发黄。此外250 mg·L-1处理的株高与300 mg·L-1处理相比,差异不显著,与其他处理相比均显著下降。
2.5 不同质量浓度的脱落酸(ABA)对韭菜保存的影响
由图5可以看出,ABA质量浓度0.1 mg·L-1处理和对照组相比生长趋势一致,同一时间株高没有明显的差别。ABA质量浓度1.0 ~7.0 mg·L-1处理和对照组相比生长明显缓慢,同一时间的株高也明显较低。
由表5可知,从生长表现来看,1.0 mg·L-1和4.0 mg·L-1组的韭菜组培苗长势较好,叶绿。从120 d后组培苗的存活率来看,ABA质量浓度0.1 mg·L-1(91.25%)和1.0 mg·L-1(82.5%)处理和对照组(87.5%)相比,没有明显差距。随着ABA质量浓度的进一步增加,120 d后组培苗的存活率有所下降,4.0 mg·L-1处理的下降到65%,7.0 mg·L-1和10.0 mg·L-1处理的存活率则只有46.25%和42.5%。而且,ABA质量浓度1.0 mg·L-1处理株高显著低于0~0.1 mg·L-1处理。
3 讨论与结论
利用培养基的高渗透压抑制离体保存材料的生长,是植物离体保存的方法之一。通过添加蔗糖和甘露醇等渗透调节剂来提高培养基的渗透压,可抑制培养材料对水分和营养物质的吸收。本试验中,在基本培养中添加20 g·L-1的山梨醇能够有效抑制韭菜组培苗的生长,保存120 d后韭菜苗的存活率达到81.25%。山梨醇浓度进一步提高则会导致韭菜组培苗成活率大大下降。这与刘迎春[6]的山梨醇对马铃薯离体保存影响以及郭静[7]对蜜瓜离体保存影响的研究结果一致。
琼脂在培养基中的主要作用是提供支撑,同时也能够调节渗透压。培养基浓度过高会阻碍植株对营养物质的吸收。有研究表明,8~9 g·L-1的琼脂可有效抑制猕猴桃的生长[8],而本研究中4~14 g·L-1的琼脂对韭菜组培苗的生长均没有明显的抑制作用,其他浓度对韭菜缓慢生长是否有效还需要进一步探索。
蔗糖在组培苗的生长中具有双重作用,既能提供碳源又可以调节培养基的渗透压。本研究中最适宜韭菜保存的蔗糖质量浓度为70 g·L-1,该浓度下韭菜组培苗生长速度明显缓慢,120 d后韭菜的存活率达86.25%,更高浓度时组培苗的成活率则逐步下降。这可能是因为培养基渗透压升高,超出韭菜苗根尖承受限度,抑制其吸收水分和养分,从而使其生长受限。前人研究也有类似的结论,如兰伟等[9]对纪伊潮野菊试管苗离体培养的研究中最合适的蔗糖质量浓度是60 g·L-1。杨学成等[10]对黄菠萝的离体保存中,最适的蔗糖质量浓度是80 g·L-1。但也有报道认为降低培养基中蔗糖浓度能够有效减缓植株生长[11]。关于降低蔗糖浓度对韭菜种质资源离体保存是否有效,还需要进一步探索。
CCC是一种优良的植物生长调节剂,可以抑制植物细胞伸长,但是不抑制细胞分裂,能使植株变矮,茎秆变粗,叶色变绿,作为生长延缓剂被广泛应用于种质保存中。但是在不同供试材料中的效果有所差异。褚明宇等[12]在对葡萄试管苗进行离体保存时,得出最适宜保存的CCC质量浓度为200 mg·L-1,马铃薯种质保存最适宜的CCC质量浓度则为400 mg·L-1[13]。也有一些研究表明CCC对蜜瓜[7]和甜菜[14]缓慢生长没有明显作用。本研究中最合适的CCC质量浓度为250 mg·L-1,此浓度下韭菜组培苗的生长明显受到抑制且保存120 d后组培苗成活率达82.5%。
ABA是一种生长抑制剂,能够抑制植物生长。因为供试材料不同,ABA在离体保存中所体现的效果及最适浓度也有很大区别。有研究表明3.0 mg·L-1的ABA在保存草莓时效果良好[15],0.5~4.0 mg·L-1的ABA对红根草的保存效果最好[16]。本研究中,最适宜对韭菜苗进行离体保存的ABA质量浓度是1.0 mg·L-1,这可能是由于供试材料的不同造成的。
值得注意的是,保证材料能够恢复生长以及其遗传性相对稳定是植物种质资源保存的前提。缓慢生长法在许多植物种质资源的保存中能夠满足这个要求,如兰伟等[17]对那贺川野菊、陈辉等[18]对百合、叶秀仙等[19]对蝴蝶兰的相关研究都验证了这一点。但也有报道指出添加2.0 mg·L-1的ABA的培养基对半夏离体保存300 d后,进行ISSR检测出现了1条新的标记和1条缺失的标记;邵玲等[20]在对紫背天葵的离体保存研究中发现ABA能有效抑制植株的生长,在保存180 d后成活率达100%,但是在恢复培养基上再生试管苗形态纤弱,不利于其恢复生长[21]。关于缓慢生长法保存后的韭菜能否保持遗传稳定性还需要进一步探索。
综上所述,20 g·L-1的山梨醇、70 g·L-1的蔗糖、250 mg·L-1的CCC以及1.0 mg·L-1的ABA均能有效抑制韭菜组培苗的生长,且保存120 d后都有很高的存活率。常规组织培养条件下,韭菜的最佳继代周期为30 d,当继代周期超过30 d后株丛会黄化、萎缩甚至死亡。可见添加一定浓度的山梨醇、蔗糖、CCC和ABA培养可以大大延长组培苗的继代周期,将其用于韭菜种质资源保存具有一定的可行性。
参考文献
[1] 尹守恒,刘宏敏.韭菜[M].郑州:河南科学技术出版社,2007.
[2] ENGELMANN F.Plant cryopreservation:progress and prospects[J].In Vitro Cellular & Developmental Biology-Plant,2004,40(5):427-433.
[3] 周逊,向长萍.植物种质资源缓慢生长离体保存研究进展[J].中国蔬菜,2008(11):39-42.
[4] RABBAA M M,SHIBLI R A,SHATNAWI M A. In vitro medium term conservation of felty germander(Teucrium polium L.)micro-shoots[J].Jordan Journal of Agricultural Sciences,2012,8(4):523-535.
[5] 兰伟,陈发棣.植物种质资源缓慢生长法保存研究进展[J].阜阳师范学院学报(自然科学版),2010,27(2):68-72.
[6] 刘迎春.马铃薯种质资源离体保存的研究[D].呼和浩特:内蒙古农业大学,2009.
[7] 郭静.采用缓慢生长法保存蜜瓜种质资源的研究[D].呼和浩特:内蒙古农业大学,2010.
[8] 陈维伦,郭东红,安和祥,等.猕猴桃属(Actinidia)植物的离体种质保存[J].生物多样性,1998,6(4):3-5.
[9] 兰伟,陈发棣.纪伊潮菊离体保存及其遗传稳定性分析[J].西北植物学报,2010,30(3):487-494.
[10] 杨学成,邹建军,李绍臣,等.黄菠萝缓慢生长法离体保存技术的研究[J].吉林林业科技,2009,38(5):15-17.
[11] 陈艺荃,樊荣辉,叶秀仙.花叶金线莲离体保存技术研究[J].福建农业科技,2019(6):21-24.
[12] 褚明宇,毛娟,陈佰鸿.PP333和CCC对葡萄试管苗生长的影响[J].西北农业学报,2012,21(11):151-157.
[13] 岳新丽,王春珍,湛润生,等.4种植物生长抑制剂对马铃薯种质离体保存的影响[J].作物杂志,2013(5):33-36.
[14] 王小兰,李同祥.生长抑制剂对甜菜种质试管保存的影响效应[J].中国糖料,2005(4):27-29.
[15] 钱亚明,赵密珍,吴伟民,等.脱落酸对草莓种质离体保存的影响[J].江苏农业学报,2006,22(3):308-309.
[16] 付传明,赵志国,黄宁珍,等.药用植物红根草种质资源的离体保存[J].广西植物,2007,27(4):653-657.
[17] 兰伟,陈素梅,尹冬梅,等.那贺川野菊的离体保存[J].园艺学报,2010,37(12):2007-2016.
[18] 陈辉,陈晓玲,陈龙清,等.百合种质资源限制生长法保存研究[J].园艺学报,2006,33(4):789-793.
[19] 叶秀仙,黄敏玲,樊荣辉,等.蝴蝶兰离体保存及其遗传稳定性研究[J].福建农业学报,2014,29(10):976-981.
[20] 王爱华,文晓鹏.半夏缓慢生长法保存及体细胞变异的ISSR检测[J].西北植物学报,2012,32(8):1698-1703.
[21] 邵玲,卢夏玲,陈芝敏.濒危植物紫背天葵种质离体保存技术研究[J].廣东农业科学,2015,42(19):43-47.

