IL-22调控EAM小鼠心肌纤维化的初步研究①
陈 嘉 陈 蓉 曹毓文 夏 琳 刘 芳 苏兆亮
(江苏大学国际基因组学研究中心,镇江212013)
心脏纤维化是心脏疾病晚期常见的病理改变[1-2]。心脏纤维化的主要标志是成纤维细胞向纤维母细胞转化,基质分泌和降解不平衡[3]。在纤维化瘢痕的晚期阶段,胶原蛋白大量分泌,胶原蛋白通过基质金属蛋白酶(matrix metalloproteinase,MMPs)进行蛋白水解,形成稳定的纤维[4-5]。MMPs受金属蛋白酶组织抑制剂(tissue inhibitors of metalloproteinases,TIMPs)负调控[6-7]。研究表明心脏在遭受刺激时,肾素-血管紧张素-醛固酮系统(reninangiotensin-aldosterone system,RAAS)被激活,释放的血管紧张素Ⅱ(angiotensinⅡ,ANGⅡ)直接或间接刺激TGF-β的产生,充当了心脏成纤维细胞的刺激剂[8-11]。由于心脏纤维化疾病的治愈率低,致死率高,所以积极寻找治疗心脏纤维化的可能靶点一直是人们关注的热点。实验性自身免疫性心肌炎(experimental autoimmune myocarditis,EAM)小鼠的心肌炎是由心肌球蛋白肽诱导产生的心脏损伤,当EAM发展到后期,小鼠心脏就会发展至纤维化[12-13]。
IL-22是IL-10家族成员,具有抗炎和促炎两方面的作用[14-15]。IL-22主要由免疫细胞分泌,如:Th17、Th22以及固有淋巴细胞等[16-17]。近年来,IL-22被认为在心脏当中具有保护作用[18]。然而,IL-22在心脏纤维化中的作用尚不完全清楚。本研究旨在通过研究IL-22对心脏纤维化以及TGF-β/Smad3信号通路的影响,探讨IL-22抑制心脏纤维化的机制。
1 材料与方法
1.1 材料 α-SMA、β-actin、辣根过氧化物酶(HRP)标记的二抗(Abcam,美国);CollagenⅠ、Smad3、P-samd3(CST,美国);ELISA kit(联科生物,中国)。
1.2 方法
1.2.1 Western blot检测α-SMA、CollagenⅠ及PSmad3的表达 小鼠心肌成纤维细胞株计数后按照细胞数量2.5×105个/孔均匀地种入24孔板中,检测α-SMA及CollagenⅠ表达时,设置对照组,ANGⅡ组(ANGⅡ处理12 h),IL-22+ANGⅡ组(IL-22预处理12 h后ANGⅡ处理12 h)。检测IL-22对信号通路的影响时,IL-22预处理成纤维细胞12 h后,ANGⅡ处理5 min。RIPA裂解提取各组总蛋白,进行SDS-聚丙烯酰胺凝胶电泳,恒流300 mA转膜,封闭后,加入按照说明书预先稀释好的一抗(α-SMA、CollagenⅠ、β-actin、Smad3及P-Smad3),4℃孵育过夜。TBST清洗后孵育对应的二抗,室温1 h;TBST清洗后显影。
1.2.2 细胞免疫荧光染色 细胞种于预先放置好爬片的细胞培养板内,加入相应的刺激剂。培养结束后,PBS清洗后依次经历0.1%Triton破膜,5%BSA封闭,预先稀释的一抗4℃冰箱过夜孵育,对应的荧光二抗避光、室温孵育,DAPI染色,清洗后使用荧光显微镜观察并采集图像。
1.2.3 ELISA法检测TGF-β、ANGⅡ表达 按照ELISA kit说明书完成对细胞培养上清中的TGF-β、小鼠血清中ANGⅡ含量的检测。
1.2.4 天狼星红染色 4%多聚甲醛固定心脏组织,常规石蜡包埋切,4μm厚片。切片二甲苯和梯度酒精脱去石蜡后,Weigert铁苏木素染色20 min,用流水冲洗10 min,天狼星红染色液室温滴染1 h。用流水稍冲洗切片,去除表面的染色液。最后脱水透明,再用中性树胶封片,光学显微镜观察并采集图像。
1.2.5 qRT-PCR 按照酚-氯仿法提取RNA,按照逆转录试剂盒的转录方法获得cDNA,以cDNA作为模板进行qRT-PCR,检测CollagenⅠ/Ⅲ的表达。
1.2.6 重组IL-22蛋白表达、纯化 将公司构建的IL-22表达载体进行转化和诱导表达后,将重组IL-22菌体收集、离心后,进行超声波破碎菌体并留取部分总菌液,剩下的菌液离心后分别收集上清与沉淀。将总菌液、上清与沉淀利用凝胶电泳检测重组IL-22的表达形式。由于重组蛋白是大肠杆菌的异源蛋白,所以在诱导重组蛋白表达的过程中易于形成不溶解的包涵体,将包涵体进行变性及复性后获取可溶性的重组IL-22溶液。可溶性IL-22溶液经过镍柱亲和层析纯化后,获得纯度较高的IL-22蛋白,去除内毒素,BCA测定所获得蛋白的浓度。
1.2.7 动物实验 抗原肽制备:1 mg猪心肌球蛋白MyHC-α614-629(Ac-SLKLMATLFSTYASADOH)溶于1 ml PBS溶液中,与弗氏完全佐剂按照1∶1的比例混合,将试剂置于冰上研磨至油包水状态。BALB/c 6周龄小鼠分为对照组、EAM模型组、IL-22+EAM治疗组。对照组皮下注射PBS;EAM模型组和IL-22+EAM治疗组在第0天、第7天皮下注射抗原肽构建模型,IL-22+EAM治疗组在第14天开始尾静脉注射IL-22(300 ng/g),每隔1 d注射1次,直至28 d,处死小鼠,进行后续实验。
1.3 统计学分析 采用SPSS19.0软件进行数据分析,实验数据采用±s表示,两两之间比较运用独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 重组IL-22蛋白的表达和纯化 凝胶电泳结果显示,重组IL-22蛋白在15~25 kD之间有明显条带,并且主要存在于沉淀中,即以包涵体形式表达(图1A)。将包涵体进行变性和复性后的凝胶结果显示,部分重组蛋白在复性后转变为可溶性蛋白(图1B)。重组IL-22可溶性蛋白溶液进行纯化后可得到的纯度较高的蛋白(图1C)。将得到的重组蛋白进行BCA蛋白浓度测定,测得重组IL-22蛋白浓度为131 mg/ml。
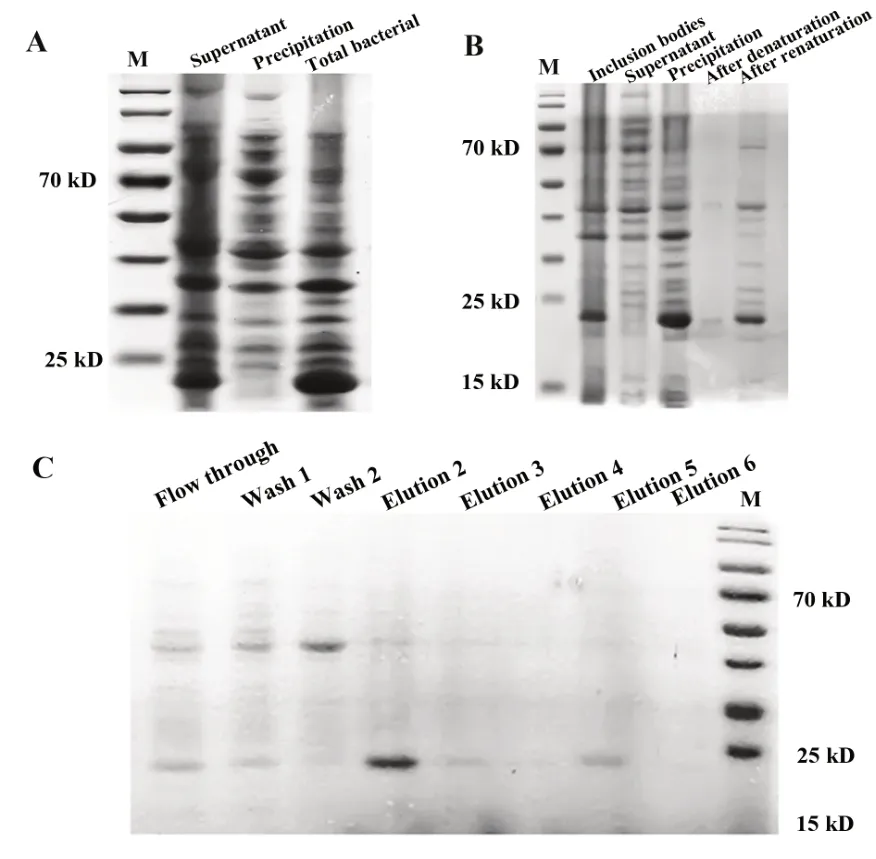
图1 重组IL-22的表达及纯化Fig.1 Expression and purification of recombinant IL-22
2.2 IL-22对ANGⅡ诱导的心肌成纤维细胞胶原及α-SMA表达的影响 Western blot和细胞免疫荧光实验显示,IL-22+ANGⅡ处理后,与ANGⅡ处理组相比,Collagen和α-SMA的表达量下降(图2A、B)。qRT-PCR显示,与ANGⅡ组相比,IL-22+ANGⅡ组CollagenⅠ/Ⅲ的mRNA表 达 量 下 降(P<0.01,图2C)。
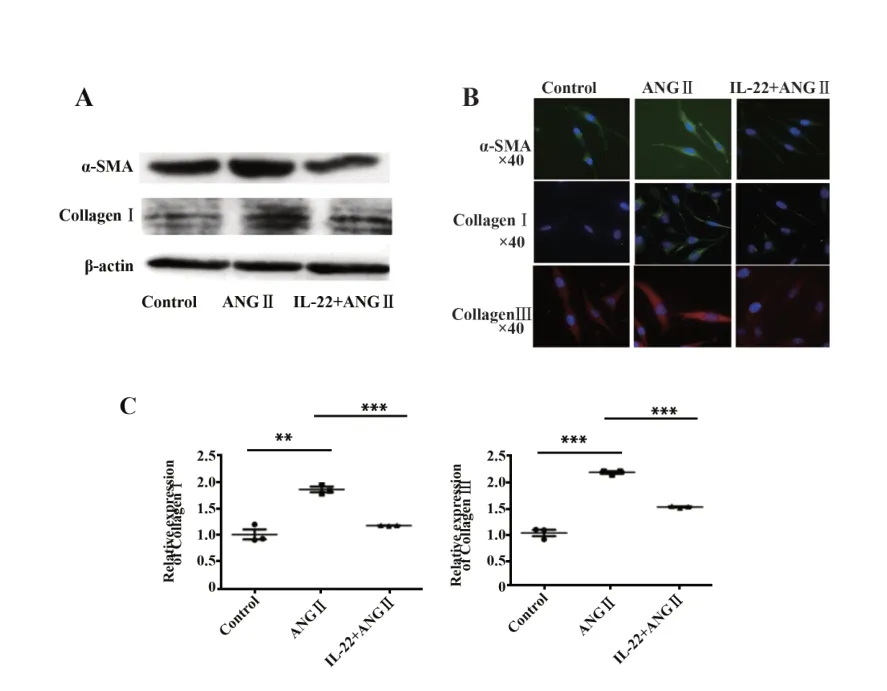
图2 IL-22对ANGⅡ诱导的心肌成纤维细胞胶原及α-SMA表达的影响Fig.2 Effect of IL-22 on expressions of collagen andα-SMA in myocardial fibroblasts induced by ANGⅡ
2.3 IL-22对ANGⅡ诱导的心肌成纤维细胞TGF-β表达水平及下游信号通路的影响 ELISA结果显示,IL-22+ANGⅡ组与ANGⅡ组相比,TGF-β表达量降低(P<0.01,图3A)。Western blot检测信号分子Smad3的磷酸化水平,结果显示ANGⅡ激活Smad3信号通路,但IL-22处理后Smad3磷酸化水平被抑制(图3B、C)。

图3 IL-22对ANGⅡ诱导的心肌成纤维细胞TGF-β表达水平及下游信号通路的影响Fig.3 Effect of IL-22 on expression level of TGF-βand downstream signaling pathways induced by ANGⅡin myocardial fibroblasts
2.4 重组IL-22干预后抑制了EAM小鼠晚期的纤维化 在诱导EAM模型后第21天和28天处死小鼠,摘取心脏,HE染色观察炎症浸润情况。结果显示,EAM小鼠21 d时炎症浸润程度最高,而28 d时炎症浸润程度减少(图4A)。本实验室前期实验结果表明,EAM模型在28 d时开始出现心脏纤维化的现象。ELISA结果显示,IL-22注射治疗后ANGⅡ表达量与EAM28天组相比明显减少(P<0.05,图4B)。qRT-PCR结果显示,IL-22注射后CollagenⅠ/Ⅲ表达与EAM 28 d相比表达量降低(P<0.001,图4C)。天狼星红染色结果显示,IL-22注射组的红色区域(胶原沉积部分)较EAM 28 d组减少,表明心脏纤维化被有效缓解(图4D)。

图4 重组IL-22干预后抑制EAM小鼠晚期的纤维化Fig.4 Interfering with recombinant IL-22 inhibits fibrosis in EAM mice
3 讨论
在心脏受损、稳态水平被破坏时,心脏基质重塑并导致心脏功能下降,最终发展为心脏纤维化[19]。心脏纤维化的主要表现是胶原沉积、肌成纤维细胞向纤维母细胞的转换以及肌成纤维细胞的增殖,心脏的顺应性降低且收缩和舒张功能障碍,最终导致心力衰竭和死亡[20]。因此,找到能逆转心脏纤维化发展的因素或药物迫在眉睫。当RAAS系统被激活后,ANGⅡ可以通过直接作用或者TGF-β介导的作用引起纤维化[21]。本实验表明IL-22通过抑制由ANGⅡ引起的TGF-β上调,从而抑制了成纤维细胞的表型转化。
近年研究表明,在器官纤维化的常见关键介质中,IL-10细胞因子家族凸显出了重要作用,IL-22作为IL-10家族的一员,因为与组织重塑相关而受到关注[22]。在已有的研究中表明,IL-22在心脏纤维化中具有保护作用,但是通过何种方式具有保护作用尚未研究清楚。本实验结果显示,IL-22通过抑制TGF-β下游的Smad3信号通路,阻断了成纤维细胞的活化。
综上所述,IL-22可以抑制TGF-β/Smad3的信号阻止成纤维细胞向纤维母细胞转化,缓解了EAM小鼠心肌纤维化的进程。