萝卜硫素对小鼠乳腺癌4T1细胞上皮-间质转化、增殖和迁移的影响研究
谢金芳,曹春雨,任 雪,田家俊,吕亚丰,黄晓飞
1.三峡大学医学院生物化学与分子生物学系,湖北 宜昌 443002;
2.三峡大学肿瘤微环境与免疫治疗湖北省重点实验室,湖北 宜昌 443002
乳腺癌是导致全球妇女癌症相关死亡的主要原因,目前随着乳腺癌发病的低龄化,其发病率和死亡率显著增加[1-2]。表观遗传调控(包括DNA甲基化、组蛋白修饰、非编码RNA和染色质重塑)的异常改变在肿瘤发生、发展中发挥重要作用[3]。其中,组蛋白去乙酰化酶(histone deacetylase,HDAC)主要催化组蛋白H3的N端第9位赖氨酸残基和非组蛋白赖氨酸残基的去乙酰化反应,由此导致染色质结构呈压缩状态,进而抑制基因转录[4-5]。HDAC被分为Ⅰ、Ⅱa、Ⅱb、Ⅲ和Ⅳ类,HDAC的异常高表达已成为抗肿瘤研究的重要靶点[6-8]。既往研究[9-11]证实,Ⅱa类HDAC5能通过下调组蛋白H3K9乙酰化抑制抑癌基因表达,参与多种肿瘤的发生,其还能够去乙酰化P53促进肿瘤细胞增殖和拮抗细胞凋亡的发生[12]。HDAC5在乳腺癌组织中异常高表达,其表达水平与乳腺癌恶性程度呈正相关,与患者预后呈负相关。HDAC5通过稳定LSD1蛋白水平,与LSD1形成基因表达调控轴,协同抑制多种抑癌基因表达,在三阴性乳腺癌和ER阳性乳腺癌的发生、发展过程中发挥重要作用,是潜在的抗乳腺癌治疗靶点[13]。萝卜硫素(sulforaphane,SFN)是提取自西兰花、芥蓝等十字花科植物的一种含硫小分子化合物,具有较强的抗氧化及抗癌作用[14-16],其化学结构式见图1。SFN对7,12-二甲基苯并蒽诱发的大鼠乳腺癌具有显著的抑制效应[17]。此外,SFN可显著提高乳腺癌细胞对他莫昔芬的敏感性,与单一化疗药物相比,可显著降低癌细胞的存活率(P<0.05)[18]。SFN联合氯法拉滨可通过解除乳腺癌细胞抑癌基因的DNA甲基化而使抑癌基因复活,诱导肿瘤细胞凋亡[19]。本课题组研究发现,SFN能够通过阻断HDAC5的转录因子USF1,下调HDAC5表达,抑制人乳腺癌MCF-7、MDA-MB-231和BT-474细胞的增殖[20]。本研究通过建立HDAC5过表达的小鼠乳腺癌4T1细胞系和4T1细胞的BALB/c小鼠移植瘤模型,研究SFN处理对4T1细胞上皮-间质转化(epithelialmesenchymal transition,EMT)、增殖、侵袭和迁移的影响,并进一步验证HDAC5作为抗三阴性乳腺癌治疗靶点和SFN用于抗三阴性乳腺癌治疗的潜在价值。
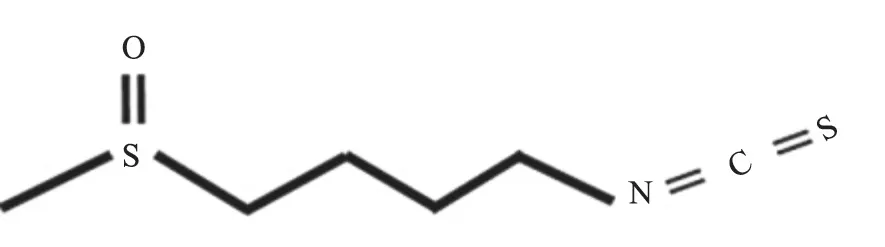
图1 SFN的化学结构式Fig.1 Chemical structure of SFN
1 材料和方法
1.1 试剂与仪器
小鼠乳腺癌4T1细胞系购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,由本实验室传代保存。SFN购自美国Sigma-Aldrich公司,胎牛血清购自以色列Biological Industries公司,RPMI-1640细胞培养基粉末购自美国Gibco公司,Turbofect转染试剂、二喹啉甲酸(bicinchoninic acid,BCA)试剂盒购自美国Thermo Fisher Sciencific公司,小鼠抗人上皮钙黏着蛋白(E-cadherin)抗体、兔抗人基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)抗体和小鼠抗人波形蛋白(vimentin)抗体购自英国Abcam公司,兔抗人β-actin、HDAC5抗体购自美国Santa Cruz公司,HRP标记山羊抗小鼠二抗/山羊抗兔二抗购自北京中杉金桥生物技术有限公司,pcDNA(3.1+)-FLAG-HDAC5质粒为本实验室前期构建,细胞计数试剂盒-8(cell counting kit-8,CCK-8)和乳酸脱氢酶检测试剂盒购自上海碧云天生物技术有限公司,TRIzol试剂、反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒购自日本Takara公司,SYBR-Green购自北京全式金生物技术有限公司,实时荧光定量PCR(real-time fluorescence quantitative PCR,RTFQ-PCR)引物由苏州金唯智生物科技有限公司合成。
1.2 方法
1.2.1 CCK-8法检测细胞增殖
收集对数生长期细胞,将细胞悬液接种于96孔培养板中,每孔100 µL(4.0×103个细胞/孔),将培养板置于37 ℃、CO2体积分数为5%的细胞培养箱中培养过夜。分别用含终浓度为0.0、1.0、2.5、5.0、10.0、25.0、50.0 μmol/L SFN的RPMI-1640完全培养基培养24、48 h。向每孔中加入10 μL CCK-8溶液,置于细胞培养箱中温育4 h。用酶标仪测定每孔在450 nm波长处的吸光度(D)值。计算细胞存活率(%)=(D实验组-D空白组)/(D阴性对照组-D空白组)×100%。药物的半数抑制浓度(half inhibition concentration,IC50)由Graphpad Prism 8.0软件计算得出。
1.2.2 乳酸脱氢酶释放实验检测药物毒性
将1×104个4T1细胞接种于96孔培养板中,分别用含终浓度为0.0、7.5、15.0、25.0、50.0 μmol/L SFN的RPMI-1640完全培养基培养。将培养细胞分为空白对照组(无细胞)、细胞对照组(无药物处理)、细胞最大酶活性对照组(无药物处理)、药物处理细胞组,每组3个复孔,加入药物后继续培养24 h。按照试剂盒说明书进行处理并测定每孔在490 nm波长处的D值。计算药物毒性(%)=(D药物处理组-D细胞对照组)/(D细胞最大酶活性组-D细胞对照组)×100%。
1.2.3 蛋白质印迹法(Western blot)检测蛋白水平
收集细胞,使用放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)全细胞裂解液[50 mmol/L羟乙基呱嗪乙硫磺酸(pH=7.5),150 mmol/L氯化钠,2 mmol/L乙二胺四乙酸,2 mmol/L乙二醇双2-氨基乙醚四乙酸,1%聚乙二醇辛基苯基醚,50 mmol/L氟化钠,5 mmol/L焦磷酸钠,50 mmol/L甘油磷酸钠,使用前加入蛋白酶抑制剂Cocktail]重悬细胞后于4 ℃下混悬15 min,于4 ℃下以10000 r/min离心15 min,收集上清液。用BCA法测定上清液的蛋白浓度后,取40 μg总蛋白的上清液准备样品,以10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE)胶分离,再经电转移至聚偏二氟乙烯(polyvinylidene fluoride,PⅤDF)膜上。然后用5%脱脂牛奶封闭2 h后,洗膜缓冲液(tris-buffered saline Tween,TBST)洗膜3次,每次8 min,加一抗4 ℃温育过夜,TBST洗膜3次,每次8 min;再加二抗温育2 h,TBST洗膜3次,每次8 min,最后用电化学发光(electrochemical luminescence,ECL)法显影并记录结果。
1.2.4 RTFQ-PCR
用1 mL/孔TRIzol裂解培养于6孔板中的细胞,并将细胞裂解液转移至Ependorf试管中,每管加入氯仿300 μL,涡旋振荡15 s,冰置5 min,然后于4 ℃下以12000 r/min离心15 min。将上清液转移至新的Ependorf试管中,每管加入异丙醇300 μL,混匀。置冰上10 min,再于4 ℃下以12000 r/min离心10 min。弃去上清液,用75%乙醇(1‰焦碳酸二乙酯水配置)600 μL润洗沉淀,于4 ℃下以12000 r/min离心10 min。在无菌台内待乙醇完全挥发,每管加入20 μL 1‰焦碳酸二乙酯水溶解沉淀。按照反转录试剂盒说明书操作,将样品中的mRNA反转录成cDNA。再以此单链cDNA为模板进行RTFQ-PCR,反应体系为20 μL:2×SYBR 10 μL,10×cDNA 1 μL,10 μmol/L上下游引物各0.5 μL,去离子水8 μL。PCR反应程序为:95 ℃5 min,95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。小鼠HDAC5上游引物序列:5’-CGCAACA AGGAGAAGAGCAAAG-3’;下游引物序列:5’-TCTCGGCTACCTTCTGTTTTAG-3’。小鼠β-actin上游引物序列:5’-AGAGGGAAATCGTG CGTGAC-3’;下游引物序列:5’-CAATAGTGA TGACCTGGCCGT-3’。以GAPDH为内参照,采用2-ΔΔCt法计算mRNA的相对表达水平。
1.2.5 Transwell实验检测4T1细胞迁移和侵袭
迁移实验:以不含血清的RPMI-1640培养基重悬4T1细胞,计数4×104个细胞、体积150 µL加入transwell小室,并将小室置于加有800 µL含15%血清培养基的24孔培养板中,于37 ℃、CO2体积分数为5%的细胞培养箱中温育24 h。将transwell小室取出,弃去小室内培养基,用1×磷酸盐缓冲液(phosphatebuffered saline,PBS)洗涤3次,加入4%多聚甲醛溶液固定30 min,润洗后加入800 μL结晶紫溶液染色30 min,再润洗3次;用棉签拭去小室内侧的细胞,于倒置显微镜下观察,并随机选取3个视野、取图保存。
侵袭实验:将50 μL Matrigel基质胶原液用无血清RPMI-1640培养基按1∶8稀释后加入小室中,于37 ℃、CO2体积分数为5%的条件下静置12 h待其凝固。然后收取不同浓度药物处理的4T1细胞,用无血清RPMI-1640培养基重悬,计数4×104个细胞、体积150 µL缓慢加入transwell小室中,余下操作同迁移实验。
1.2.6 划痕实验
分别用含0.0、7.5 μmol/L SFN的RPMI-1640培养基(含1%小牛血清)培养vector组、HDAC5-OE组4T1细胞24 h,用200 μL移液器吸嘴在每孔中划十字形划痕,再以1×PBS洗涤2次;分别在0、6、12 h时用倒置显微镜观察药物对4T1细胞迁移能力的影响,拍照取图。
1.2.7 HDAC5稳定过表达4T1细胞系的建立
使用pcDNA(3.1+)-Flag-HDAC5质粒及对照质粒载体pcDNA(3.1+)-Flag转染4T1细胞48 h,以400 μg/mL G418处理转染后4T1细胞5 d,再更换为含200 μg/mL G418的RPMI-1640培养基持续培养3周。挑取单个克隆细胞放入24孔板并以含100 μg/mL G418的RPMI-1640培养基持续培养,然后采用Western blot鉴定稳定过表达HDAC5的单克隆4T1细胞系。
1.2.8 动物实验
雌性7周龄SPF级BALB/c小鼠共24只,于SPF屏障动物实验中心内常规饲养。以随机数字法将小鼠分为4T1/vector、4T1/vector+SFN、4T1/HDAC5-OE和4T1/HDAC5-OE+SFN 4组,每组6只。胰酶消化处理4T1/vector和4T1/HDAC5-OE细胞,以1000 r/min、室温离心3 min收集细胞,冰预冷PBS重悬后细胞计数并调整细胞数至2.5×106个/mL;用1 mL无菌注射器分别在每只小鼠皮下第二乳腺脂肪垫接种上述细胞悬液100 μL。5 d后观察成瘤,并经小鼠腹腔给药,SFN剂量为30 mg/kg,对照组注射等体积的溶剂[50%二甲基亚砜(dimethyl sulfoxide,DMSO)水溶液]。每周持续给药5 d,间隔2 d不给药,共给药4周。26 d后,用CO2法处死小鼠,对小鼠荷瘤部位脱毛后拍照,然后解剖小鼠取瘤进行瘤组织称重和拍照记录。同时,取出小鼠心、肝、肾、肺拍照记录并做H-E染色、免疫组织化学检测。所有动物实验均经三峡大学动物福利与伦理委员会审核并批准。动物许可证号:SCXK(鄂)2017-0012;三峡大学动物福利与伦理审查编号:2020030M。
1.3 统计学处理
实验数据采用Graphpad Prism 8.0软件进行分析。数据组间比较采用t检验,数据以表示,P<0.05为差异有统计学意义。
2 结果
2.1 SFN对4T1细胞增殖的影响及细胞毒性评价
不同浓度SFN(0.0、1.0、2.5、5.0、10.0、25.0、50.0 μmol/L)处理4T1细胞24、48 h,以CCK-8法分析SFN对细胞增殖的影响,每组3个复孔。结果显示,与0.0 μmol/L比较,2.5、5.0、10.0、25.0、50.0 μmol/L SFN对4T1细胞的增殖有显著抑制作用,细胞存活率呈浓度依赖性下降(图2A)。经Graphpad Prism 8.0软件统计分析,SFN处理4T1细胞的IC50(95% CI)值为:24 h组,32.19 µmol/L(19.66~52.68 µmol/L);48 h组,17.60 µmol/L(10.59~29.28 µmol/L)。本课题组前期研究[20]表明,SFN可下调人乳腺癌MDAMB-231和MCF-7细胞中HDAC5的基因表达。为研究SFN抑制HDAC5表达对高侵袭性小鼠乳腺癌4T1细胞增殖、迁移和EMT的影响,需选择对4T1细胞无显著细胞毒性的作用浓度。乳酸脱氢酶释放实验检测发现,与0.0 μmol/L比较,7.5、15.0 μmol/L SFN对4T1细胞均无显著细胞毒性(图2B,P>0.05)。由于7.5 μmol/L SFN显著抑制4T1细胞增殖,选取该浓度SFN用于后续研究。
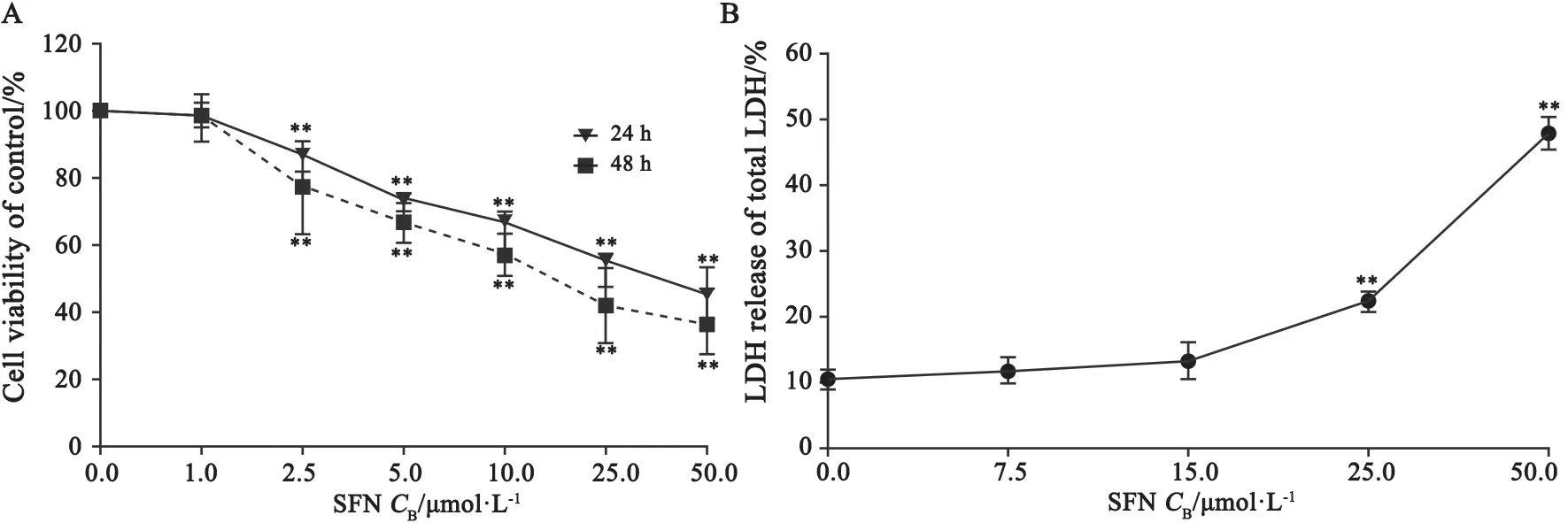
图2 SFN对4T1细胞增殖的影响与细胞毒性作用Fig.2 The effects of SFN on 4T1 cell proliferation and toxicity
2.2 SFN对4T1细胞HDAC5、EMT相关分子表达和体外侵袭、迁移的影响
为观察SFN对4T1细胞中HDAC5和EMT相关分子表达以及细胞侵袭、迁移的影响,在4T1细胞中转染质粒pcDNA-Flag-HDAC5及其载体pcDNA-Flag,24 h后以7.5 μmol/L SFN继续处理24 h,然后收集细胞进行Western blot检测内源性和外源性HDAC5的蛋白水平。结果表明,该浓度SFN能够显著下调4T1细胞中内源性HDAC5的蛋白水平,但对外源性过表达的HDAC5蛋白水平无显著影响;同时,SFN能够显著下调EMT相关分子vimentin、MMP-9、神经钙黏着蛋白(N-cadherin)的表达,上调E-cadherin的表达,但HDAC5过表达可显著逆转SFN对EMT相关分子表达的影响(图3A)。进一步以细胞划痕、transwell和transwell-Matrigel实验分析该浓度SFN对4T1细胞迁移、侵袭能力的影响,结果显示,7.5 μmol/L SFN处理24 h显著抑制乳腺癌4T1细胞迁移(图3B~3D)和侵袭(图3E),且HDAC5过表达可显著逆转SFN对乳腺癌4T1细胞迁移和侵袭的抑制作用。

图3 SFN抑制HDAC5表达对4T1细胞EMT相关分子表达和细胞侵袭、迁移的影响Fig.3 Effects of SFN-induced HDAC5 expression inhibition on the expression of EMT relative molecule and migration and invasion of 4T1 cells
2.3 HDAC5稳定过表达4T1细胞系的鉴定
为观察SFN处理及HDAC5过表达对4T1细胞体内增殖和转移的影响,使用pcDNA-Flag-HDAC5质粒及对照质粒载体pcDNA-Flag转染4T1细胞结合G418筛选,通过Western blot鉴定稳定过表达HDAC5的单克隆4T1细胞系4T1/HDAC5。结果表明,与对照细胞系相比,稳定过表达HDAC5的4T1细胞系其HDAC5蛋白和mRNA水平显著增加,且细胞组蛋白的总体H3K9乙酰化水平显著下降(图4)。
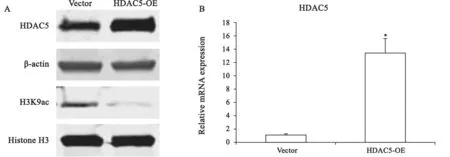
图4 HDAC5稳定高表达4T1细胞系鉴定Fig.4 The identification of HDAC5 stablely high-expressed 4T1 cell lines
2.4 SFN对移植瘤小鼠体内4T1细胞增殖、转移的影响
接种了4T1/HDAC5细胞及其对照细胞4T1/vector的BALB/c小鼠,分别接受SFN及其溶剂对照处理并观察肿瘤细胞的体内增殖、迁移。结果发现,与4T1/vector细胞相比,4T1/HDAC5细胞接种小鼠体内肿瘤的体积和平均重量显著增加。两组4T1/vector细胞移植瘤小鼠比较,SFN处理可显著抑制肿瘤组织生长,SFN处理组小鼠剥离后的肿瘤体积和重量均显著小于DMSO给药组;但在两组4T1/HDAC5细胞荷瘤小鼠中,与DMSO组相比,SFN处理对于肿瘤组织生长、肿瘤体积和重量均无显著影响(图5A~5C)。

图5 SFN对小鼠体内4T1细胞移植瘤增殖的影响Fig.5 Effects of SFN on proliferation of 4T1 cell transplanted tumor in mice
解剖小鼠,取双肺拍照并作肺部组织H-E染色观察肿瘤肺转移,结果显示,两组4T1/vector荷瘤小鼠中,DMSO处理组小鼠双肺均发现多个转移瘤,而SFN处理组小鼠双肺未发现转移瘤;但两组4T1/HDAC5-OE荷瘤小鼠双肺均发现多个转移瘤,且SFN处理对4T1/HDAC5-OE荷瘤小鼠的肺部肿瘤转移无显著影响(图6A、6B)。Ki-67增殖指数可反映肿瘤细胞增殖能力。免疫组织化学检测结果表明,SFN处理导致小鼠肿瘤组织中Ki-67增殖指数显著下降,但4T1/HDAC5-OE组小鼠肿瘤组织和肺部转移瘤组织中的Ki-67增殖指数无明显变化,4T1/HDAC5-OE组小鼠肿瘤组织的Ki-67增殖指数较4T1/vector组显著增高(图6C~6F)。

图6 HDAC5过表达对BALB/c荷瘤小鼠肺转移的影响Fig.6 The effects of HDAC5 over-expression on tumor metastasis in tumor-bearing BALB/c mice
2.5 SFN对4T1荷瘤小鼠的毒性作用
为评价SFN处理对实验小鼠的慢性毒性作用,本研究比较了实验期间各组荷瘤小鼠的体重变化,并在给药完成后取各组小鼠的心、肝、肾组织进行H-E染色,观察其细胞和组织形态。小鼠体重变化和心、肝、肾的组织形态显示,与对照组小鼠相比,SFN处理组小鼠的体重未出现显著变化,心肌纤维纹路清晰,肝小叶、肾小球结构清楚,未见细胞变性等病变引起的组织结构异常(图7)。
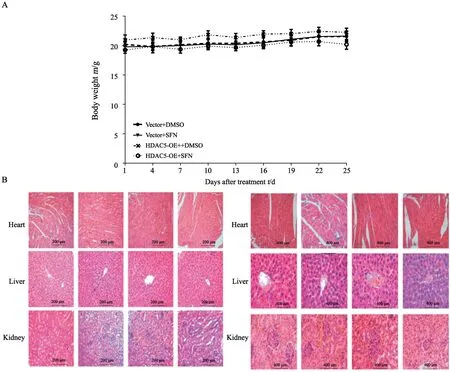
图7 SFN对BALB/c荷瘤小鼠心肝肾的毒性影响Fig.7 Effect of SFN on heart,liver and kidney of tumor-bearing BALB/c mice
3 讨 论
癌细胞迁移和侵袭是造成患者死亡的主要原因,因此寻找低毒、有效的药物抑制癌细胞迁移和侵袭是抗肿瘤研究的重点[21]。而乳腺癌病理学分型复杂,其中三阴性乳腺癌由于缺乏雌激素受体、孕激素受体和人类表皮生长因子受体2,对雌激素阻断治疗不敏感,且易复发和转移,患者5年生存率显著低于其他类型乳腺癌[22]。因此,研究抗三阴性乳腺癌转移的分子靶点及药物具有重要的临床意义。
EMT是上皮细胞逐步丧失上皮分子标志和表型而呈现出间充质细胞表型的过程,其分子机制为细胞内EMT相关分子通路激活使细胞获得增殖、迁移和侵袭的能力[23]。EMT过程中,上皮细胞标志蛋白E-cadherin表达下降至消失,同时间质细胞标志蛋白vimentin、N-cadherin的表达水平显著增加[24-27]。本研究中,SFN处理显著上调4T1细胞中E-cadherin的表达,下调vimentin和N-cadherin的表达,并抑制4T1细胞侵袭和迁移。这一结果表明,SFN能够抑制4T1细胞发生EMT,并由此抑制4T1细胞侵袭和迁移。尽管SFN能够下调HDAC5基因转录,但外源性过表达的HDAC5基因由CMⅤ启动子控制转录,而不受SFN抑制。使用SFN处理HDAC5稳定过表达的4T1细胞发现,外源性过表达HDAC5可部分逆转SFN对EMT相关分子表达和对4T1细胞侵袭、迁移的抑制效应,提示HDAC5在4T1细胞侵袭、迁移和EMT中发挥重要作用。进一步的动物实验也表明,SFN处理能够显著抑制4T1细胞在小鼠体内的增殖和肺转移,但对HDAC5稳定过表达的4T1细胞则无显著抑制作用。上述结果表明,SFN能够抑制4T1细胞侵袭和转移,其作用机制与下调HDAC5表达和通过下调间质细胞标志物vimentin、N-cadherin的表达、上调E-cadherin的表达并由此阻止4T1细胞的EMT过程有关。我们前期研究[13]表明,HDAC5能够与LSD1协同促进乳腺癌发生、发展,而SFN能够通过下调HDAC5表达,阻断其与LSD1的协同作用,本研究结果进一步证实阻断HDAC5与LSD1的协同作用,能够显著抑制三阴性乳腺癌细胞侵袭和转移。SFN作为一种天然产物,安全性较好,不良反应较轻,可作为肿瘤化疗的辅助用药[28-29]。
综上所述,鉴于SFN具有下调4T1细胞中HDAC5表达、阻断4T1细胞EMT和抑制其侵袭、迁移的作用,SFN有望用于抗乳腺癌转移治疗。本研究评价了HDAC5作为抗三阴性乳腺癌治疗靶点和SFN用于抗三阴性乳腺癌治疗的潜在价值,为抗三阴性乳腺癌研究提供了新思路。

